舒尼替尼對人高轉移肝癌細胞株MHCC97-H局部黏著斑激酶表達的影響
張塵玉 張 微 李書平 楊志強 遲新楠 岳 莉
肝癌是臨床上常見的惡性腫瘤之一,多數患者發現時已是晚期或伴有轉移,錯過了最佳手術時期[1],并且對放化療不敏感,預后不良。近年來研究發現局部黏著斑激酶(focal adhesion kinase,FAK)的高表達促進了肝癌的侵襲和轉移[2],如能有效抑制FAK,則可能抑制腫瘤的侵襲和轉移,但由于目前藥物均缺乏特異性,故尚無以FAK為靶點的藥物。舒尼替尼(Sunitinib,Sutent)是一種新型多靶向性治療腫瘤的口服藥物,能抑制癌細胞的生長,可顯著延長肝癌患者的生存期[3]。舒尼替尼是否對FAK也有靶向抑制作用,目前尚鮮見相關報道。本研究旨在探討舒尼替尼對肝癌細胞的體外殺傷作用,以及對FAK蛋白表達水平的影響。
1 材料與方法
1.1 材料 (1)細胞株:人高轉移肝癌細胞株MHCC97-H第4代,引自中國科學院上海細胞生物研究所細胞庫。(2)舒尼替尼由輝瑞公司生產。(3)鼠抗人FAK多克隆抗體購自美國Abcam公司。(4)胎牛血清、胰蛋白酶購于北京博奧森生物工程有限公司。(5)四甲基偶氮唑藍(MTT)購于北京華美公司。(6)辣根過氧化物酶標記的二抗購于北京中杉金橋生物技術有限公司。
1.2 方法
1.2.1 細胞培養 細胞在含有10%胎牛血清的DMEM培養液(含青霉素100 U/mL,鏈霉素100 mg/L)中生長,培養條件為37℃5%CO2飽和濕度,用0.25%胰蛋白酶和0.02%EDTA液消化傳代。
1.2.2 實驗分組 應用100%二甲基亞砜(DMSO)溶解舒尼替尼,于-20℃保存,使用時稀釋,DMSO終濃度小于0.5%,不影響細胞生長。空白對照組不加舒尼替尼,實驗組分別加入2.5、5、10和20 μmol/L的舒尼替尼,分別作用24、48和72 h。
1.2.3 瑞氏-吉姆薩染色觀察細胞形態 取對數生長期細胞接種于鋪有蓋玻片的6孔培養板,加入FTY720,同時設陰性對照,經藥物作用48 h,取片風干,滴加無水乙醇待風干,加瑞氏吉姆薩染液染色30 s,PBS浸泡2 min,洗去染液,無水乙醇固定,晾干、封片,鏡檢拍照。
1.2.4 MTT法檢測細胞增殖抑制率 常規消化細胞,離心制成單細胞懸液,細胞計數,調整濃度至3×104/mL;用移液器每孔加入100 μL細胞懸液,接種96孔板,每組設6個復孔,同時設置6個空白調零孔。共接種4塊96孔板;放入培養箱中孵育,以后每隔48 h換液1次;第2天選擇取出96孔板,每孔加MTT溶液20 μL。細胞放置在37℃5%CO2的培養箱中培養4 h;小心吸棄孔內上清,每孔加入150 μL DMSO,震蕩溶解10 min;在酶聯免疫儀調定在570 nm波長處,測定吸光度(A)值。根據吸光度值計算細胞抑制率(%)=(1-實驗組A值/空白調零組A值)×100%。
1.2.5 Western blot檢測用藥前后FAK的蛋白表達 收集各組細胞,加入細胞裂解液,放置在冰上15 min,在4℃10 000 r/min離心10 min,上清液采用Bradford法測蛋白含量;加入2×SDS上樣緩沖液,煮沸5 min;離心,取20 μg蛋白上樣到10%SDS-PAGE膠進行電泳,電轉90 min后將蛋白轉到PVDF膜,加入一抗(1∶1 000),在搖床上室溫搖2 h,4℃孵育過夜;加入辣根過氧化物酶標記的二抗(1∶700)孵育1 h。最后用發光試劑發光,X線膠片進行曝光、顯影、定影。以β-ac?tin為內參,Western blot檢測FAK的蛋白表達水平,通過Quantity One軟件對結果進行定量分析。以各組FAK表達水平的光密度(OD)值與β-actin OD值比即為相對表達量
1.3 統計學方法 采用SPSS 17.0軟件進行統計分析,計量資料采用均數±標準差(±s)表示,不同時間資料比較采用重復測量資料方差分析,同一時間點不同濃度組之間數據比較采用單因素方差分析,多重比較采用LSD-t法,以P<0.05為差異有統計學意義。
2 結果
2.1 細胞形態 光鏡下未經舒尼替尼作用的MHCC97-H細胞無核碎裂及溶解等現象,見圖1A。舒尼替尼10 μmol/L濃度下作用48 h后可觀察到大部分細胞發生凋亡,細胞膜完整,但胞漿出現發泡現象,染色質固縮、胞核碎裂及凋亡小體等典型的凋亡形態,見圖1B。
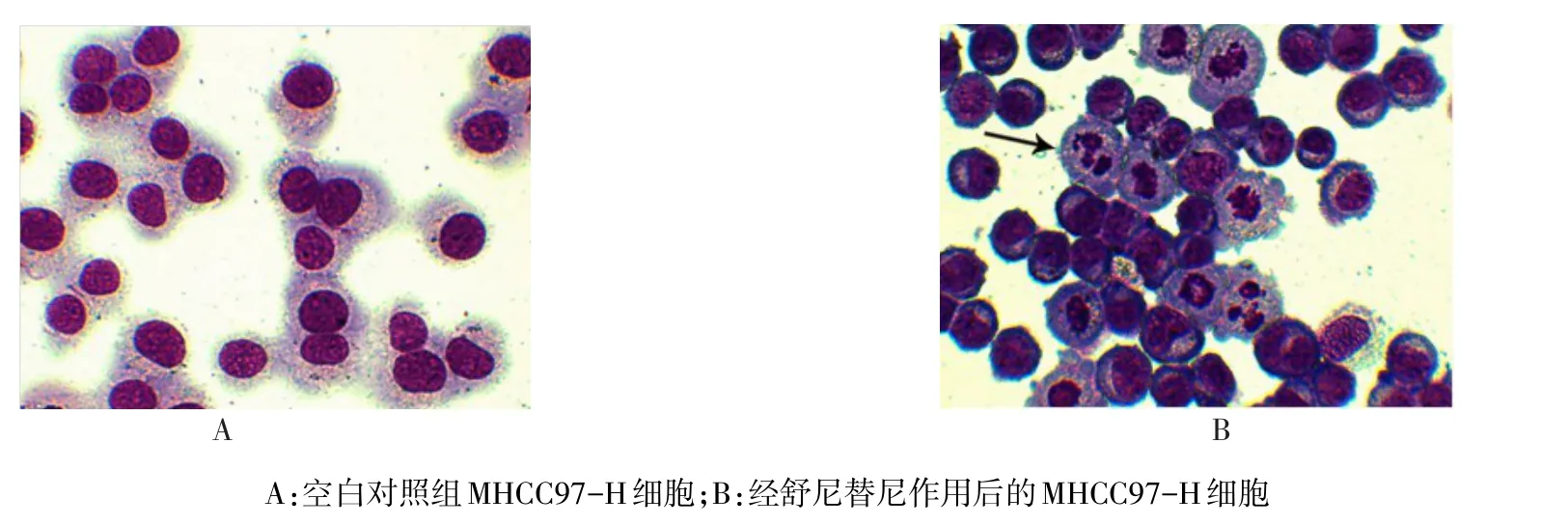
Figure 1 The cell morphology of MHCC97-H before and after sunitinib treatment(Wright-Giemsa stain,×200)圖1 舒尼替尼作用前后MHCC97-H細胞形態學的影響(瑞氏-吉姆薩染色,×200)
2.2 舒尼替尼對肝癌MHCC97-H細胞的抑制作用 MHCC97-H細胞經舒尼替尼2.5、5、10和20 μmol/L處理后,細胞均出現不同程度的抑制,作用48 h時抑制率最明顯,各組比較差異均有統計學意義(P<0.05),見表1。
Table 1 Comparison of inhibitory rates of MHCC97-H between different concentrations and different times of sunitinib treatment表1 舒尼替尼不同濃度作用時間下肝癌細胞MHCC97-H抑制率比較(n=3,%,±s)
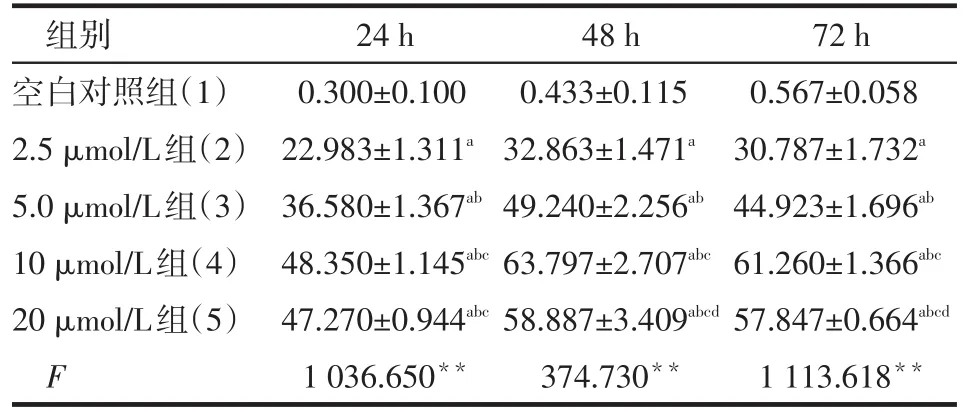
Table 1 Comparison of inhibitory rates of MHCC97-H between different concentrations and different times of sunitinib treatment表1 舒尼替尼不同濃度作用時間下肝癌細胞MHCC97-H抑制率比較(n=3,%,±s)
*P<0.05,**P<0.01;F時間=213.995,F分組=1 188.270,F交互= 15.329,均P<0.01;a與(1)組比較,b與(2)組比較,c與(3)組比較,d與(4)組比較,P<0.05;表2同
組別空白對照組(1)2.5 μmol/L組(2)5.0 μmol/L組(3)10 μmol/L組(4)20 μmol/L組(5)F 24 h 0.300±0.100 22.983±1.311a 36.580±1.367ab 48.350±1.145abc 47.270±0.944abc 1 036.650**48 h 0.433±0.115 32.863±1.471a 49.240±2.256ab 63.797±2.707abc 58.887±3.409abcd 374.730**72 h 0.567±0.058 30.787±1.732a 44.923±1.696ab 61.260±1.366abc 57.847±0.664abcd 1 113.618**
2.3 Western blot檢測FAK的蛋白表達 舒尼替尼作用于肝癌細胞48 h時抑制率最明顯,FAK蛋白表達水平出現不同程度的下降,見圖2、表2。
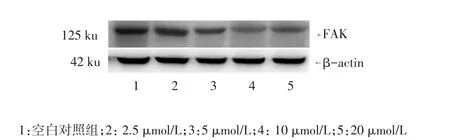
Figure 2 The effects of different concentrations of sunitinib on the expression of FAK圖2 不同濃度舒尼替尼對FAK蛋白表達的影響
Table 2 The effects of different concentrations of sunitinib on the expression of FAK protein表2 不同濃度舒尼替尼對FAK蛋白表達的影響(n=3,±s)
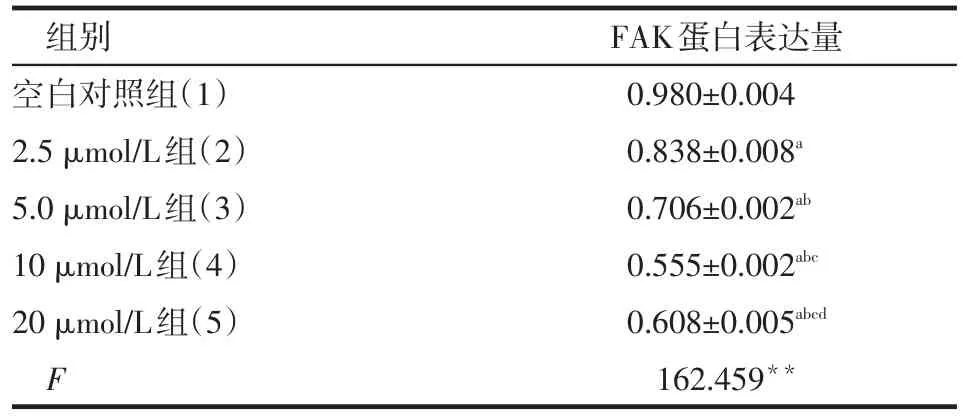
Table 2 The effects of different concentrations of sunitinib on the expression of FAK protein表2 不同濃度舒尼替尼對FAK蛋白表達的影響(n=3,±s)
組別空白對照組(1)2.5 μmol/L組(2)5.0 μmol/L組(3)10 μmol/L組(4)20 μmol/L組(5)F FAK蛋白表達量0.980±0.004 0.838±0.008a 0.706±0.002ab 0.555±0.002abc 0.608±0.005abcd 162.459**
3 討論
3.1 研究背景 原發性肝癌作為五大惡性腫瘤之一,每年大約有50萬的新發病例[4],其中肝細胞癌(HCC)是最常見且預后最差的類型[5]。肝癌對放化療不敏感,患者預后較差,因此靶向治療為肝癌患者帶來了新的希望。無論侵襲還是轉移都是在多基因作用下形成的,任何致癌基因的過度表達及抑癌基因的缺失都會導致侵襲和轉移的發生。不少分子靶向藥物也應運而生,但臨床上應用的腫瘤標志物在腫瘤鑒別的靈敏度及特異度均未達到理想的程度。3.2 FAK與腫瘤的關系 FAK是由Schaller等首先發現的一種非受體酪氨酸激酶,在多種惡性腫瘤中高表達或過度激活。有研究發現FAK能促進肝癌細胞的侵襲和轉移,是肝癌患者無病生存率和總生存率的獨立預后影響因素之一[6]。動物模型研究發現,降低FAK的表達可以減少肝癌細胞的轉移[7],圍繞FAK開發新的靶向藥物以抑制腫瘤細胞的侵襲和轉移,成為目前的研究熱點,但由于藥物均缺乏特異性,結果并不理想。目前單靶點/單基因的藥物種類較多,療效不一,成本也相當昂貴,因此尋求多靶點藥物成為治療腫瘤患者的首要目標。
3.3 舒尼替尼在治療肝癌方面的應用 舒尼替尼是一種多靶點酪氨酸激酶抑制劑,具有抗血管生成活性[8],在治療轉移性腎癌方面取得了較好的療效[9],它能降低腫瘤細胞的生長速度,并提高患者的生存期。研究發現舒尼替尼對肝癌患者同樣有效,它能抑制血管內皮生長因子(VEGF)受體,延長肝癌患者的總生存期[10]。舒尼替尼可能通過VEGF、細胞外調節蛋白激酶(ERK)等多條信號轉導通路作用于癌細胞[11-12],并能提高自然殺傷(NK)細胞的殺傷活性[13]。但其是否對FAK也有靶向抑制作用,目前國內外鮮見相關文獻報道。
3.4 本研究的意義和局限性 本研究顯示舒尼替尼作用于人高轉移肝癌MHCC97-H細胞株48 h后抑制率達峰值,可出現典型的細胞凋亡形態,且在2.5~20 μmol/L濃度范圍內出現了不同程度的抑制,10~20 μmol/L可能是抑制細胞的最佳濃度,體外藥物實驗可能為臨床的最佳給藥濃度提供一定的參考。經不同濃度舒尼替尼作用48 h時抑制最明顯,肝癌MHCC97-H細胞中FAK的蛋白表達出現了不同程度的下調,這表明舒尼替尼對特異性不高的FAK也存在一定的靶向抑制作用,其具體的作用機制仍需要進一步探索和研究。
[1] Chaudhury PK,Hassanain M,Bouteaud JM,et al.Complete re?sponse of hepatocellular carcinoma with sorafenib and Y radioembo?lization[J].Curr Oncol,2010,17(5):67-69.
[2]Luedde T.MicroRNA-151 and its hosting gene FAK(focal adhe?sion kinase)regulate tumor cell migration and spreading of hepato?cellular carcinoma[J].Hepatology,2010,52(3):1164-1166.doi: 10.1002/hep.23854.
[3]Yeo W,Chen PJ,Furuse J,et al.Eastern Asian expert panel opin?ion:designing clinical trials of molecular targeted therapy for hepa?tocellular carcinoma[J].BMC Cancer,2010,10:620.doi:10.1186/ 1471-2407-10-620.
[4] Horger M,Lauer UM,Schraml C,et al.Early MRI response monitor?ing of patients with advanced hepatocellular carcinoma under treat?ment with the multikinase inhibitor sorafenib[J].BMC Cancer, 2009,9:208.doi:10.1186/1471-2407-9-208.
[5]Yang ZQ,Yang ZY,Zhang LD,et al.Increased liver-infiltrating CD8+FoxP3+regulatory T cells are associated with tumor stage in hepatocellular carcinoma patients[J].Hum Immunol,2010,71(12): 1180-1186.doi:10.1016/j.humimm.2010.09.011.
[6]Yuan Z,Zheng Q,Fan J,et al.Expression and prognostic signifi?cance of focal adhesion kinase in hepatocellular carcinoma[J].J Cancer Res Clin Oncol,2010,136(10):1489-1496.doi:10.1007/ s00432-010-0806-y.
[7]Xu WJ,Zhang S,Zhang N,et al.RNA interference targeting focal adhesion kinase inhibited the growth of human hepatocellular carci?noma sk-hep-1[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2011,42(4):455-460.
[8] Harmon CS,DePrimo SE,Raymond E,et al.Mechanism-related circulating proteins as biomarkers for clinical outcome in patients with unresectable hepatocellular carcinoma receiving sunitinib[J].J Transl Med,2011,9:120.doi:10.1186/1479-5876-9-120.
[9]Yoshino T,Kawai K,Miyazaki J,et al.A case of acute adrenal insuf?ficiency unmasked during sunitinib treatment for metastatic renal cell carcinoma[J].Jpn J Clin Oncol,2012,42(8):764-766.doi: 10.1093/jjco/hys070.
[10]Serova M,de Gramont A,Tijeras-Raballand A,et al.Benchmark?ing effects of mTOR,PI3K,and dual PI3K/mTOR inhibitors in he?patocellular and renal cell carcinoma models developing resistance to sunitinib and sorafenib[J].Cancer Chemother Pharmacol,2013, 71(5):1297-1307.doi:10.1007/s00280-013-2129-6.
[11]Piscazzi A,Costantino E,Maddalena F,et al.Activation of the RAS/ RAF/ERK signaling pathway contributes to resistance to sunitinib in thyroid carcinoma cell lines[J].J Clin Endocrinol Metab,2012,97(6):E898-906.doi:10.1210/jc.2011-3269.
[12]Fenton MS,Marion KM,Salem AK,et al.Sunitinib inhibits MEK/ ERK and SAPK/JNK pathways and increases sodium/iodide sym?porter expression in papillary thyroid cancer[J].Thyroid,2010,20(9):965-974.doi:10.1089/thy.2010.0008.
[13]Krusch M,Salih J,Schlicke M,et al.The kinase inhibitors sunitinib and sorafenib differentially affect NK cell antitumor reactivity in vi?tro[J].J Immunol,2009,183(12):8286-8294.

