FOXM1轉(zhuǎn)錄因子在人宮頸癌組織中的表達及其臨床意義*
劉 波,黃世峰,袁 虹
(重慶醫(yī)科大學附屬第一醫(yī)院:1.燒傷科/醫(yī)療美容科;2.檢驗科;3.婦產(chǎn)科 400016)
宮頸癌是女性主要惡性腫瘤之一,其發(fā)病率在發(fā)達國家位于惡性婦科腫瘤第3位,在中國則位于第2位[1]。每年全世界50余萬新發(fā)病例中大約1/3來自中國。人乳頭瘤病毒(HPV)感染在宮頸癌發(fā)病中起重要作用,是宮頸癌的重要危險因素[2-3],但單純HPV感染并不足以引起宮頸上皮細胞的惡性轉(zhuǎn)化[4]和宮頸癌的發(fā)生[5]。因此,推測在宮頸組織低級別病變,即宮頸上皮內(nèi)瘤樣病變(cervical intraepithelial neoplasia,CIN)向侵襲性宮頸癌轉(zhuǎn)化的過程中必定涉及其他影響癌基因、抑癌基因或信號轉(zhuǎn)導通路的細胞遺傳學改變。
FOXM1轉(zhuǎn)錄因子是FOX基因家族中的一個重要成員,僅特異性表達于增殖期細胞中,在細胞增殖、分化和凋亡過程中發(fā)揮關(guān)鍵性作用[6]。FOXM1與胚胎發(fā)育、衰老、再生和腫瘤等許多病理生理過程均有密切關(guān)系,可通過對細胞周期相關(guān)因子的調(diào)控而促進細胞周期G1期向S期、G2期向M期過渡,并誘導細胞發(fā)生有絲分裂[7]。新近的研究證實,F(xiàn)OXM1異常表達與多種人類惡性腫瘤包括肝癌[8]、乳腺癌[9]、肺癌[10]和膀胱癌[11]等的發(fā)生和發(fā)展均有密切關(guān)系,是腫瘤增殖所必需的轉(zhuǎn)錄因子,其表達水平常與腫瘤的惡性進展程度相關(guān),已成為臨床腫瘤治療的一個新靶點[12]。然而,F(xiàn)OXM1在宮頸癌組織中的表達情況及其在宮頸癌發(fā)生和進展過程中的臨床意義尚未見報道。本研究旨在通過檢測宮頸CIN和鱗狀細胞癌組織中FOXM1表達情況,評估FOXM1與宮頸癌臨床病理學參數(shù)間的相關(guān)性。
1 資料與方法
1.1 一般資料 收集2013年1~6月在重慶醫(yī)科大學附屬第一醫(yī)院婦產(chǎn)科進行宮頸活檢或手術(shù)治療、且未經(jīng)放化療的初診住院患者組織標本77例,包括17例正常宮頸組織、22例CIN標本、38例宮頸癌標本,標本類別均經(jīng)病理學檢查確診。所有患者臨床資料完整,年齡25~71歲,平均47.6歲。
1.2 FOXM1和Ki-67免疫組織化學染色檢測 小鼠抗人FOXM1單克隆抗體和小鼠抗人Ki-67單克隆抗體均購自Santa Cr uz公司,S-P免疫組織化學試劑盒購自北京中杉生物技術(shù)有限公司。嚴格參照試劑盒說明書進行免疫組織化學染色操作。
參照參考文獻[10]將FOXM1染色結(jié)果計為0~3分。0分:細胞核和細胞質(zhì)均未染色(-);1分:細胞質(zhì)染色為主(+);2分:異質(zhì)性染色即細胞質(zhì)和細胞核混合染色(++);3分:連續(xù)的細胞核染色(+++)。0分判為FOXM1表達陰性,1~3分者均判為陽性表達。Ki-67抗原均定位于細胞核,以細胞核呈清晰棕黃色染色為陽性。按切片中陽性細胞數(shù)的比例劃分染色等級:無明確陽性細胞為(-);陽性細胞數(shù)小于10%為弱陽性;陽性細胞數(shù)大于10%為強陽性。
1.3 統(tǒng)計學處理 FOXM1與臨床病理學參數(shù)的相關(guān)性分析采用SPSS13.0軟件進行分析處理。分類數(shù)據(jù)采用Pearson′s χ2檢驗或Fisher′s精確概率法進行統(tǒng)計分析,以P<0.05為差異有統(tǒng)計學意義。
2 結(jié) 果
2.1 正常宮頸組織、CIN組織和宮頸鱗狀細胞癌組織中FOXM1表達情況比較 采用免疫組織化學染色方法對正常宮頸組織、CIN組織和宮頸鱗狀細胞癌組織標本中FOXM1表達情況進行檢測。結(jié)果顯示,F(xiàn)OXM1在正常宮頸、CIN和宮頸癌組織中的異常表達率分別為5.88%、63.6%和92.1%(表1)。正常宮頸上皮組織中FOXM1染色均為陰性或弱陽性,陽性染色僅見于基底膜下層和中間層宮頸組織中(圖1A);而宮頸癌組織細胞核內(nèi)FOXM1出現(xiàn)高表達(圖1C);CIN組織中FOXM1表達程度介于正常組織和宮頸癌組織之間(圖1B),且CIN組織內(nèi)FOXM1表達水平呈現(xiàn)從CINⅠ向CINⅢ逐漸增強的趨勢(圖2),提示FOXM1表達僅局限于增殖性宮頸上皮細胞中,且其表達水平與宮頸癌的惡性進展顯著相關(guān)。
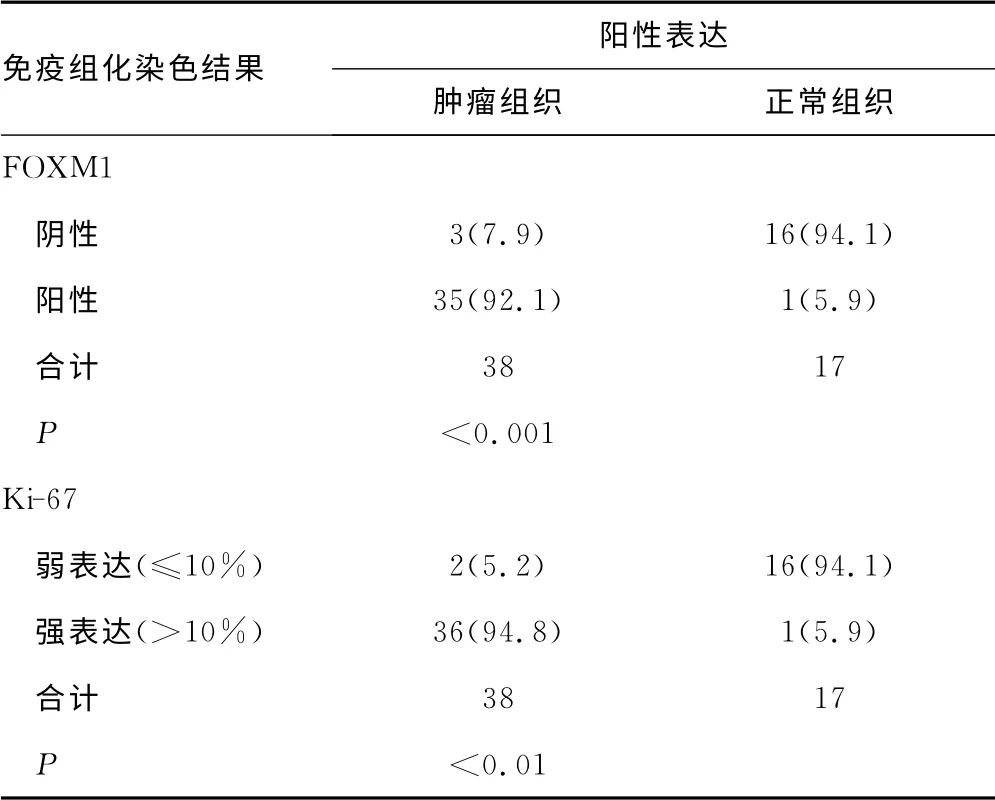
表1 宮頸鱗狀細胞癌組織中FOXM1和Ki-67 表達結(jié)果分析[n(%)]
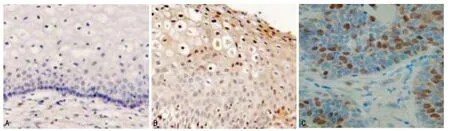
圖1 正常宮頸、CIN和宮頸癌組織FOXM1免疫組織化學染色檢測結(jié)果(×200)

圖2 不同病變級別CIN組織中FOXM1免疫組織化學染色檢測結(jié)果(×200)
2.2 宮頸鱗狀細胞癌組織中FOXM1表達水平與Ki-67表達水平的相關(guān)性分析 Ki-67是一種常用于對包括宮頸癌在內(nèi)的惡性腫瘤病變的增殖情況進行評估的標記物。為進一步研究FOXM1在宮頸癌進展中的作用,本研究進一步通過免疫組織化學染色方法檢測了Ki-67在以上各種宮頸組織標本中的表達情況。研究結(jié)果顯示,與FOXM1表達情況類似,絕大多數(shù)正常宮頸上皮組織中Ki-67表達為陰性或僅見微弱表達(表1)。使用10%作為臨界值時發(fā)現(xiàn)36例(94.8%)宮頸癌組織標本中Ki-67為強表達,而僅2例(5.2%)為Ki-67低表達(表1)。通過對FOXM1和Ki-67的表達類型進一步分析發(fā)現(xiàn),在所有宮頸癌組織中FOXM1染色增強與Ki-67陽性增殖細胞比例呈強相關(guān)性(圖3),即FOXM1表達與宮頸癌組織中較高的Ki-67陽性增殖分數(shù)相關(guān)(表2)。以上結(jié)果提示FOXM1過表達于高度增殖的人宮頸癌組織中。
2.3 FOXM1表達水平與宮頸癌患者臨床病理學參數(shù)間的相關(guān)性分析 臨床病理學相關(guān)性分析顯示,宮頸癌組織中FOXM1陽性表達與腫瘤較晚的分期、較低的病理分化程度和術(shù)后復發(fā)均顯著相關(guān),但與患者年齡、放療敏感性以及HPV感染等均無顯著相關(guān)性(表2)。
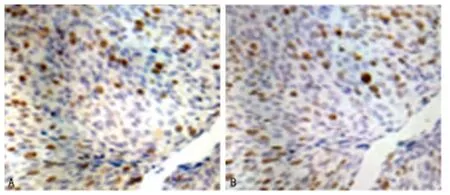
圖3 同一張宮頸癌病理組織切片中FOXM1和Ki-67免疫組織化學染色結(jié)果
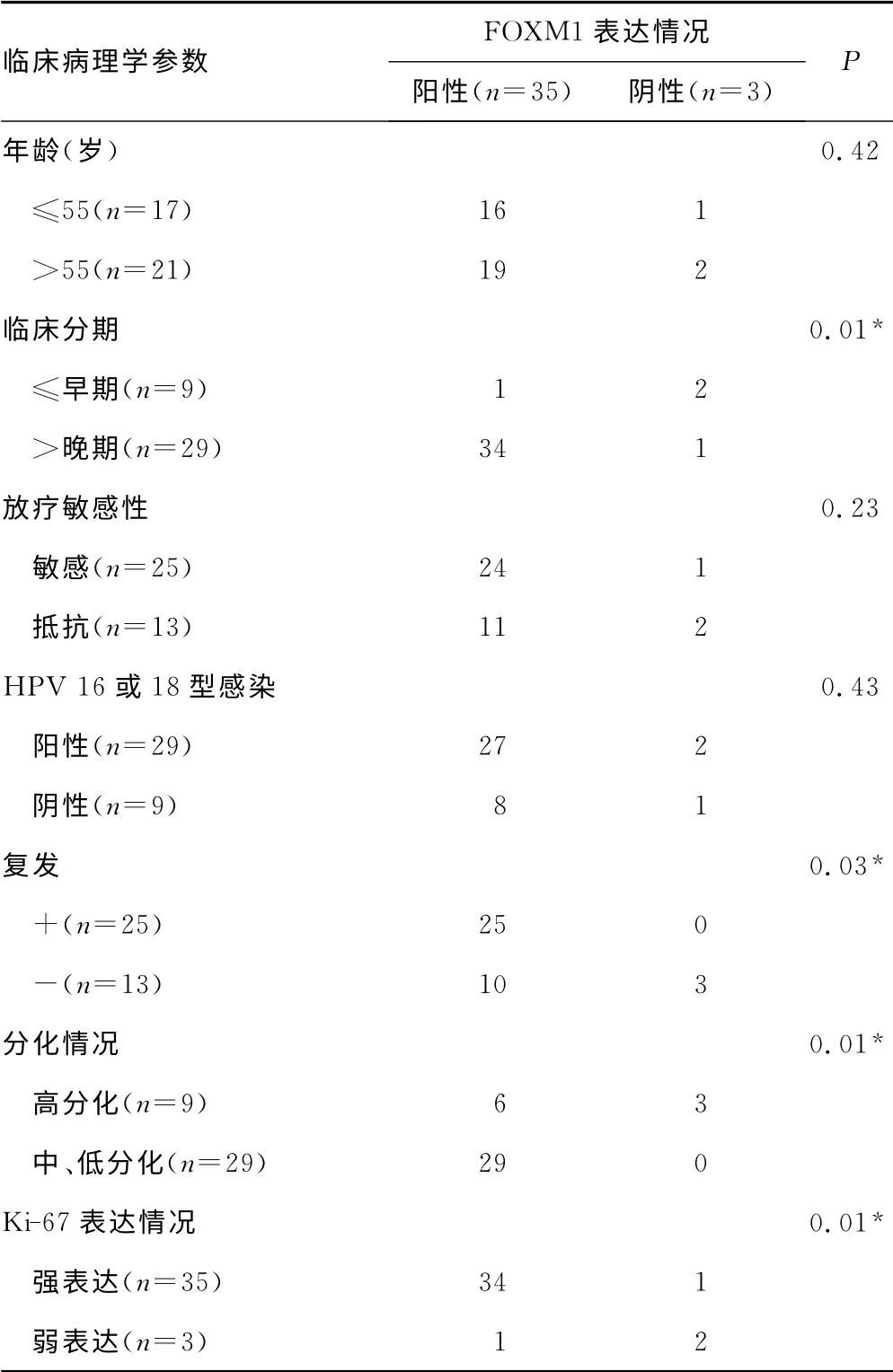
表2 宮頸鱗狀細胞癌組織中FOXM1表達情況及其與 患者臨床病理學參數(shù)相關(guān)性分析
3 討 論
FOXM1是一種典型的增殖相關(guān)性轉(zhuǎn)錄因子,在細胞增殖、分化和凋亡過程中起重要作用。FOXM1在不同組織起源的多種人類腫瘤,如肝細胞肝癌[8]、乳腺癌[9]、肺癌[10]、膀胱癌[11]等惡性腫瘤中均普遍上調(diào),并與腫瘤的發(fā)生和惡性進展顯著相關(guān)。宮頸鱗狀細胞癌源于宮頸上皮細胞,通過系列增殖性改變由CIN病變進展所致。
本研究采用免疫組織化學方法檢測了正常宮頸上皮組織、CIN組織和鱗狀細胞癌組織標本中FOXM1的表達情況,并結(jié)合患者臨床病理學資料對FOXM1在宮頸癌發(fā)生、發(fā)展中的臨床意義進行了評估。結(jié)果顯示,正常宮頸、CIN和宮頸癌組織中FOXM1的檢出率分別為5.88%、63.6%和92.1%。FOXM1在正常宮頸上皮組織中不表達或僅微弱表達,而在CINⅠ、CINⅡ、CINⅢ和宮頸鱗狀細胞癌等組織中,其表達水平隨著細胞增殖程度的增加及細胞惡性程度的進展而逐漸增強;FOXM1異常表達與宮頸癌惡性病變增殖性標記物Ki-67的表達水平高度相關(guān)。此外,F(xiàn)OXM1的表達水平與宮頸癌的病理分化程度、臨床分期和術(shù)后復發(fā)等病理學參數(shù)亦顯著相關(guān)。以上研究結(jié)果提示FOXM1在宮頸癌的發(fā)生和進組按每一髖作為單元統(tǒng)計手術(shù)時間為展中起重要作用,可能成為一個與Ki-67類似的宮頸癌預后標記物。FOXM1已被證實與各種腫瘤的多種臨床病理學參數(shù)顯著相關(guān)。Calvisi等[13]研究發(fā)現(xiàn),在大鼠和人肝癌形成過程中出現(xiàn)FOXM1過表達,且FOXM1表達水平與肝癌細胞的增殖指數(shù)呈正相關(guān);在肺鱗狀細胞癌中,F(xiàn)OXM1過表達被證實與腫瘤細胞的分化程度和患者預后等均顯著相關(guān)[10]。Huang等[14]研究證實,胰腺癌中FOXM1過表達可促進腫瘤發(fā)生上皮-間質(zhì)轉(zhuǎn)化、侵襲和轉(zhuǎn)移;在大腸癌中,F(xiàn)OXM1信號通路活化可促進腫瘤進展和轉(zhuǎn)移[15]。本研究則進一步證實FOXM1表達與宮頸鱗狀細胞癌病理學分化程度及臨床分期均顯著相關(guān),F(xiàn)OXM1檢測有助于對宮頸癌患者預后進行早期預測。
[1]Jemal A,Simard EP,Dorell C,et al.Annual report to thenation on the status of cancer,1975-2009,featuring theburden and trends in human papillomavirus(HPV)-associated cancers and HPV vaccination coverage levels[J].JNatl Cancer Inst,2013,105(3):175-201.
[2]Castle PE,Glass AG,Rush BB,et al.Clinical human papillomavirus detection forecasts cervical cancer risk inwomen over 18 years of follow-up[J].J Clin Oncol,2012,30(25):3044-3050.
[3]Saslow D,Solomon D,Lawson HW,et al.American cancer society,american society for colposcopy and cervicalpathology,and american society for clinical pathologyscreening guidelines for the prevention and early detectionof cervical cancer[J].CA Cancer J Clin,2012,62(3):147-172.
[4]González Martín A.Molecular biology of cervical cancer[J].Clin Transl Oncol,2007,9(6):347-354.
[5]Kim YT,Zhao M.Aberrant cell cycle regulation in cervical carcinoma[J].Yonsei Med J,2005,46(5):597-613.
[6]Wang X,Quail E,Hung NJ,et al.Increased levels of fork-head box M1B transcription factor in transgenic mousehepatocytes prevent age-related proliferation defects in re-generating liver[J].Proc Natl Acad Sci USA,2001,98(20):11468-11473.
[7]Wonsey DR,F(xiàn)ollettie MT.Loss of the forkhead transcription factor Fox M1 causes centrosome amplification andmitotic catastrophe[J].Cancer Res,2005,65(12):5181-5189.
[8]Zeng J,Wang L,Li Q,et al.Fox M1 is up-regulated in gastric cancer and its inhibition leads to cel-lular senescence,partially dependent on p27 kip1[J].JPathol,2009,218(4):419-427.
[9]Xia L,Huang W,Tian D,et al.Upregulated Fox M1 expression induced by hepatitis Bvirus X protein promotes tumormetastasis and indicates poor prognosis in hepatitis Bvirus-related hepatocellular carcinoma[J].J Hepatol,2012,57(3):600-612.
[10]Yang DK,Son CH,Lee SK,et al.Forkhead box M1 expression in pulmonary squamous cell carcinoma:correlation with clinicopathologic features and its prognostic significance[J].Hum Pathol,2009,40(4):464-470.
[11]Liu D,Zhang Z,Kong CZ.High FOXM1 expression wasassociated with bladder carcinogenesis[J].Tumour Biol,2013,34(2):1131-1138.
[12]Bhat UG,Halasi M,Gartel AL.Thiazole antibiotics targetFox M1 and induce apoptosis in human cancer cells[J].PLoS One,2009,4(5):e5592.
[13]Calvisi DF,Pinna F,Ladu S,et al.Forkhead box M1B is adeterminant of rat susceptibility to hepatocarcinogenesisand sustains ERK activity in human HCC[J].Gut,2009,58(5):679-687.
[14]Huang C,Xie D,Cui J,et al.FOXM1c promotes pancreatic cancer epithelial-to-mesenchymal transition and metastasis via upregulation of expression of the urokinase plasminogen activator system[J].Clin Cancer Res,2014,20(6):1477-1488.
[15]Li DW,Wei P,Peng ZH,et al.The critical role of dysregulated FOXM1-PLAUR signaling in human colon cancerprogression and metastasis[J].Clin Cancer Res,2013,19(1):62-72.

