大劑量高壓氧超早期治療對局部腦梗死大鼠細胞凋亡的影響
于秋紅,李婕,劉亞玲,郁軍超,薛連璧
神經(jīng)保護是腦梗死的治療策略之一,也是腦血管病領域的研究熱點之一。有研究提示高壓氧(hyperbaric oxygenation,HBO)治療能促進腦血管側(cè)支循環(huán)建立[1],且有直接神經(jīng)保護作用,可保護缺血半暗帶休眠腦細胞[2]。我們前期實驗[3]提示大劑量HBO超早期治療永久性大腦中動脈阻塞(middle cerebral artery occlusion,MCAO)大鼠,可能在抑制、阻斷,甚至逆轉(zhuǎn)其腦缺血后病理變化方面具有一定的作用,通過提高內(nèi)源性血管內(nèi)皮因子(vascular endothelial growth factor,VEGF)促進側(cè)支循環(huán)建立,減小腦梗死體積可能是其機制之一。有研究[4]顯示高壓氧可以通過抑制一氧化碳中毒大鼠海馬神經(jīng)細胞線粒體膜電位(mitochondrial membrane potential,MMP)降低來影響細胞凋亡,但對腦梗死大鼠是否具有同樣作用,目前尚無研究。基于此,我們采用HBO單次9 h方案治療超早期局部腦梗死大鼠,觀察HBO對細胞凋亡和膜電位的影響。
1 材料與方法
1.1 實驗動物 清潔級雄性SD大鼠72只,重量(280±20)g,由北京維通利華實驗動物技術(shù)有限公司提供,實驗前大鼠禁食不禁水3 h以上。
1.2 試劑 北京化學試劑公司生產(chǎn)水合氯醛、2,3,5苯四氮唑(tetrazolium chloride,TTC)、蔗糖,南京凱基生物科技發(fā)展有限公司出品多聚甲醛(Cat#KGT558)、磷酸鹽緩沖液(phosphate buffered saline,PBS,Cat#KGT549)、檸檬酸鈉(Cat#KGT553)、聚乙二醇辛基苯基醚(Triton X-100,Cat#KGT551)、脫氧核糖核苷酸末端轉(zhuǎn)移酶介導的缺口末端標記法(terminaldeoxynucleotidyl transferase mediated nick end labeling,TUNEL)試劑盒(Cat#KGA7044,含緩沖液、熒光素標記的脫氧尿嘧啶核苷三磷酸、脫氧核糖核苷酸末端轉(zhuǎn)移酶、抗熒光素抗體、辣根過氧化酶底物二氨基聯(lián)苯胺顯色劑)、細胞懸液制備試劑盒(Cat#KGA829)、羅丹明123染色試劑盒(Cat#KGA217)。
1.2 模型制作及分組 采用改良的Zea-longa線栓法[5]制作大鼠永久性MCAO模型,選擇阻塞左側(cè)大腦中動脈,模型制作后3 h采用姿勢反射實驗對大鼠進行行為學評分(3分制)[6],評分≥1分的動物視為造模成功,排除麻醉未清醒、死亡、無自主行動大鼠和無神經(jīng)功能缺損大鼠,造模成功的大鼠隨機分為對照組(n=36)和HBO組(n=36)。
1.3 實驗方法 采用上海減壓器廠生產(chǎn)的透明純氧動物實驗艙。HBO組動物于MCAO后3 h內(nèi)開始HBO。治療壓力為0.2 MPa。升壓20 min,穩(wěn)壓9 h,減壓40 min。為避免氧中毒,大鼠分別于1 h、3 h、5 h、7 h、9 h呼吸純氧,2 h、4 h、6 h、8 h呼吸艙內(nèi)高壓空氣。對照組大鼠于MCAO后,呼吸常壓空氣。
1.4 觀察指標 ①神經(jīng)功能評分:采用Garcia評分標準[7]在MCAO后3 h、13 h、72 h對大鼠行為學進行評價。②腦梗死體積:大鼠于缺血后13 h、72 h斷頭取腦,各時間點每組取6只大鼠,全腦于冷凍狀態(tài)下切成5片,每片冠狀切片厚度2 mm。對腦組織進行TTC染色后測定各組腦梗死體積,正常腦組織染成粉紅或紫紅色,梗死灶染成白色。用ⅠmageJ軟件對每只大鼠腦組織梗死面積、半球面積進行定量測定,為除去梗死部位組織水腫帶來的誤差,采用校正的梗死面積測定公式,即梗死面積=右側(cè)半球面積-(左側(cè)半球面積-測定的左側(cè)半球梗死面積)[8]。梗死容積=Σ(相鄰兩片腦組織梗死面積相加×1/2×層厚)。考慮到不同體重大鼠的腦組織的基線重量不同,所以計算相對梗死容積,即梗死容積占大腦總?cè)莘e的百分比[8]。③凋亡細胞數(shù):于模型制成后13 h、72 h取材,每組取6只大鼠麻醉,生理鹽水、4%甲醛灌注,取前囟后3~6 mm處腦組織冷凍切片后行TUNEL染色,按TUNEL染色說明書操作,將厚度為20 μm冷凍切片浸入通透液,冰上促滲2 min,PBS沖洗3次,滴加脫氧核糖核苷酸末端轉(zhuǎn)移酶反應液,置于濕盒中37℃反應60 min,PBS沖洗3次后熒光顯微鏡觀察,各組均可見標記為綠色熒光的TUNEL陽性細胞,各樣本隨機選取5個缺血半暗帶視野觀察,計數(shù)視野中的陽性細胞數(shù),取平均數(shù)。④線粒體膜電位:大鼠于缺血后13 h、72 h斷頭取腦,每組各時間點取6只大鼠,將缺血半暗帶腦組織[9]剪成糊糜,加入消化酶A消化25 min,經(jīng)過漂洗、吹打、研磨、過濾、離心制成細胞懸液,加入羅丹明123染液,按說明書操作,孵育、離心、重懸細胞培養(yǎng)、離心、再重懸,流式細胞儀檢測羅丹明123熒光強度以觀察膜電位變化情況,激發(fā)波長488~505 nm,發(fā)射波長515~575 nm。熒光值越高,表示線粒體跨膜電位越低,反映線粒體功能越差,正常值為1067.96。
1.5 統(tǒng)計學分析 采用SPSS 16.0統(tǒng)計軟件分析。計量資料符合正態(tài)分布,以s表示,同組間不同時間點比較采用相關樣本t檢驗,兩組比較采用兩獨立樣本t檢驗。以P<0.05為有顯著差異。
2 結(jié)果
對照組大鼠死亡7只,13 h內(nèi)2只,13~24 h、24~48 h、48~72 h內(nèi)分別死亡1只、2只和2只,經(jīng)解剖證實死因分別為腦出血、腦水腫和蛛網(wǎng)膜下腔出血,剔除數(shù)據(jù)后重新補充模型。HBO組治療過程中無死亡、癲癇發(fā)生。
2.1 神經(jīng)功能評分 兩組各時間點Garcia評分比較見表1。由表1可見,與3 h相比,各組大鼠在MCAO 13 h時神經(jīng)功能較MCAO 3 h時即有明顯改善(P均=0.007),72 h時改善有更明顯的趨勢(P均<0.001),但72 h時與13 h時比無顯著差異。各時間點對照組與HBO組相比,神經(jīng)功能無顯著差異。
2.2 腦梗死容積 可以觀察到梗死灶主要位于左側(cè)MCA分布區(qū)的皮層、皮層下白質(zhì)和基底節(jié)區(qū)。各組腦梗死容積比符合正態(tài)分布,對照組13 h、72 h時梗死容積百分比分別為(15±5.2)%、(28±5.3)%,HBO組大鼠13 h、72 h時梗死容積比分別為(11±3.0)%、(15±7.3)%,缺血13 h時兩組大鼠腦梗死容積比無顯著差異,72 h時對照組腦梗死容積比較13 h時增大(P=0.02),HBO組腦梗死容積比較對照組小,差異有顯著性(P=0.02)。
2.3 凋亡細胞數(shù) 缺血半暗帶區(qū)可見大量凋亡細胞,13 h時凋亡細胞數(shù)HBO組較對照組少,差異有顯著性(P=0.04),72 h時兩組的凋亡細胞數(shù)無顯著差異(P=0.92)。對照組72 h時凋亡細胞數(shù)少于13 h時,差異有顯著性(P=0.03),HBO組72 h時與13 h時無顯著差異(P=0.47),詳見表2。
2.4 線粒體膜電位 從MCAO后13 h開始,對照組熒光值升高,提示線粒體膜電位下降,至72 h無明顯變化(P=0.76)。HBO組熒光值相對穩(wěn)定于較低水平,提示線粒體膜電位穩(wěn)定于較高水平,72 h與13 h比,無顯著差異(P=0.58)。對照組各時間點膜電位均低于HBO組(P<0.001)(表3)。
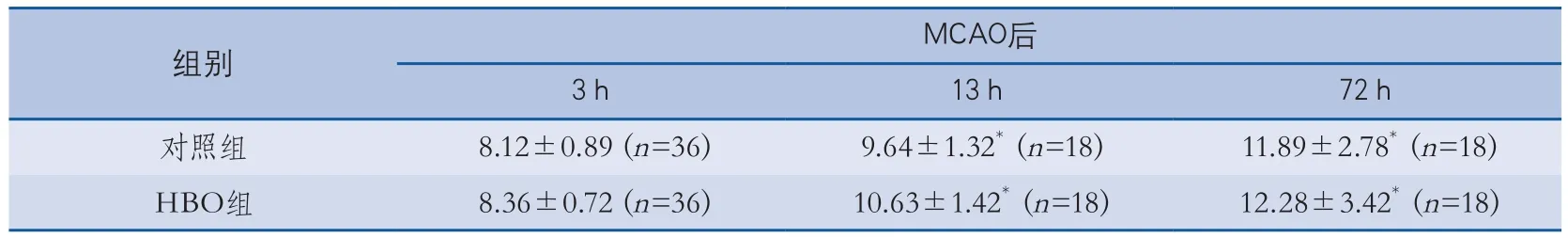
表1 各組大鼠Garcia評分比較
3 討論
目前的動物實驗顯示HBO治療永久性腦動脈阻塞模型結(jié)論存在爭議,HBO時間窗和劑量是療效差異的關鍵。有文獻表明,幕上非腔隙性梗死的病理演變時間是6~18 h,平均約10 h[10]。基于上述理論,我們采用9 h HBO在3 h內(nèi)開始治療永久性MCAO大鼠,力求阻止,甚至逆轉(zhuǎn)卒中的病理演變過程。本研究和前期結(jié)果[3,11]類似,顯示了單次9 h HBO能改善局部腦梗死大鼠神經(jīng)功能,縮小腦梗死容積。缺血周圍區(qū)存在部分休眠細胞,及時供氧可能挽救其功能,反之,則發(fā)生細胞凋亡或壞死。細胞凋亡是個主動耗能過程,需要三磷酸腺苷(adenosine triphosphate,ATP)供能,ATP的缺乏將直接阻斷凋亡通路,使細胞轉(zhuǎn)向壞死[12-13],進而擴大梗死容積。ATP的主要來源是線粒體,從理論上講,如果能促進線粒體產(chǎn)生ATP,則可減少細胞壞死,縮小梗死容積。線粒體膜電位是線粒體進行氧化磷酸化產(chǎn)生ATP的先決條件,膜電位下降,標志著細胞不可逆損傷的開始[14]。李強等[15]發(fā)現(xiàn)缺血后腦組織線粒體存在短暫的內(nèi)源性代償修復機制,但不足以逆轉(zhuǎn)氧化應激對線粒體的持續(xù)損傷。Li等[13]應用培養(yǎng)的海馬細胞證實減少氧自由基聚集,可以抑制膜電位的降低,從而抑制細胞壞死。一方面,HBO提高梗死周圍組織氧供[16],增加線粒體的ATP含量,從而減少細胞壞死,減輕組織損傷,另一方面又產(chǎn)生氧自由基,對膜電位到底有何影響,目前的研究尚未得出結(jié)論。

表2 各組凋亡細胞計數(shù)比較(個)

表3 各組線粒體的羅丹明123熒光強度比較
本研究結(jié)果顯示大劑量HBO后,膜電位持續(xù)穩(wěn)定于較高水平,缺血半暗帶區(qū)凋亡細胞數(shù)在13 h降低,考慮HBO提供了充足的氧供,挽救了休眠細胞,所以凋亡細胞數(shù)減少。而72 h后,兩組凋亡細胞幾近相等,推測原因:一是MCAO后部分細胞壞死,故而凋亡數(shù)量減少,二是HBO持續(xù)作用時間有限,未能覆蓋缺血灶病理生理變化的全過程。本研究中HBO組大鼠72 h時腦梗死體積與13 h無顯著性差異,提示細胞發(fā)生凋亡,所以梗死體積變化不大,而對照組72 h時梗死體積較13 h明顯擴大,考慮此階段細胞壞死,故而梗死體積擴大,這與本研究凋亡細胞數(shù)及線粒體膜電位的變化趨勢也是相符的,提示缺血超早期提供充足氧供,減少細胞凋亡,有助于縮小梗死容積,通過線粒體途徑影響細胞凋亡,可能是HBO的機制之一。本課題組以前的研究[17]發(fā)現(xiàn),雖然9 h HBO可能增加了腦組織中某些自由基的含量,但不僅沒有加重過氧化損傷水平,反而顯著降低了實驗大鼠腦組織的過氧化損傷程度,可能是HBO產(chǎn)生的神經(jīng)保護作用比自由基產(chǎn)生的損傷作用更強大。
此外,還有其他體內(nèi)體外的研究證實HBO可以通過線粒體途徑影響細胞凋亡。Weber等[18]將T細胞暴露于高壓氧氣中,發(fā)現(xiàn)1次30 min的HBO暴露即可通過線粒體機制引起淋巴細胞凋亡。而Bai等[19]則認為HBO治療早期急性胰腺炎大鼠,正是通過線粒體途徑引起外周血淋巴細胞凋亡,抑制了炎性反應,從而降低了大鼠胰腺炎的程度。其機制包括凋亡誘導因子[13]轉(zhuǎn)位、神經(jīng)蛋白[20]等,有關機制本課題組亦將繼續(xù)研究。
本研究尚存以下局限:①觀察點較少,觀察時間短,可能不足以反映腦梗死過程中各指標的演變過程;②樣本量小;③由于缺血半暗帶是一個動態(tài)變化的區(qū)域,故取材定位的缺血半暗帶與實際的缺血半暗帶可能存在差距。
1 Rusyniak DE, Kirk MA, May JD, et al. Hyperbaric oxygen therapy in acute ischemic stroke:Results of the hyperbaric oxygen in acute ischemic stroke trial pilot study[J]. Stroke, 2003, 34:571-574.
2 Selman WR, Lust WD, Pundik S, et al. Compromised metabolic recovery following spontaneous spreading depression in the penumbra[J]. Brain Res, 2004,999:167-174.
3 于秋紅, 張紅霞, 劉亞玲, 等. 單次9小時高壓氧超早期治療對大鼠腦梗死體積的影響[J]. 中國卒中雜志, 2008,3:662-665.
4 高春錦, 葛環(huán), 武連華, 等. 高壓氧對一氧化碳中毒大鼠海馬神經(jīng)細胞線粒體膜電位與細胞凋亡的影響[J]. 中國航海醫(yī)學與高氣壓醫(yī)學雜志, 2001, 8:90-93.
5 Longa EZ, Weinstein PR, Carlson S, et al. Revesible middle cerebral artery occlusion without cranitonomy in rats[J]. Stroke, 1989, 20:84-91.
6 Zhang L, Schallert T. A test for detecting long term sensorimotor dysfunction in the mouse after focal cerebral ischemia[J]. J Neuroscience Meth, 2002,117:207-214.
7 Julio HG, Simone W, Kai-Feng L, et al. Neurological def i cit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats[J]. Stroke, 1995,26:627-635.
8 Doerfler A, Schwab S, Hoffmann TT, et al.Combination of decompressive craniectomy and mild hypothermia ameliorates infarction volume after permanent focal ischemia in rats[J]. Stroke, 2001,32:2675.
9 Ashwal S, Tone B, Tian HR, et al. Core and penumbral nitric oxide synthase activity during cerebral ischemia and reperfusion[J]. Stroke, 1998, 29:1037-1047.
10 Saver JL. Time is brain-quantified[J]. Stroke, 2006,37:263-266.
11 于秋紅, 劉亞玲, 吳雅麗, 等. 單次9 h高壓氧超早期治療局部腦梗死大鼠療效探討[J]. 山東醫(yī)藥, 2008, 48:36-38.
12 Nicotera P, Leist M, Ferrando-May E. Intracellular ATP, a switch in the decision between apoptosis and necrosis[J]. Toxicol Lett, 1998, 102-103:139-142.
13 Li H, Chen G, Ma W, et al. Water-soluble coenzyme q10 inhibits nuclear translocation of apoptosis inducing factor and cell death caused by mitochondrial complex I inhibition[J]. Int J Mol Sci, 2014, 31, 15:13388-13400.
14 Sun X, Xu H, Shen J, et al. Real-time detection of intracellular reactive oxygen species and mitochondrial membrane potential in THP-1 macrophages during ultrasonic irradiation for optimal sonodynamic therapy[J]. Ultrason Sonochem, 2014.06.30 [Epub ahead of print].
15 李強, 翟宇, 張婷, 等. 腦缺血再灌注后線粒體氧化應激損傷的動態(tài)變化[J]. 中國臨床神經(jīng)病學, 2014, 3:241-247.
16 Sunami K, Takeda Y, Hashimoto M, et al. Hyperbaric oxygen reduces infarct volume in rats by increasing oxygen supply to the ischemic periphery[J]. Crit Care Med, 2000, 28:2831-2836.
17 薛連璧, 王擁軍, 于秋紅, 等. 大劑量HBO治療急性腦卒中的療效及對氧化應激的影響[J]. 首都醫(yī)科大學學報,2008, 29:64-68.
18 Weber SU, Koch A, Kankeleit J, et al. Hyperbaric oxygen induces apoptosis via a mitochondrial mechanism[J]. Apoptosis, 2009, 14:97-107.
19 Bai X, Song Z, Zhou Y, et al. The apoptosis of peripheral blood lymphocytes promoted by hyperbaric oxygen treatment contributes to attenuate the severity of early stage acute pancreatitis in rats[J]. Apoptosis,2014, 19:58-75.
20 Liu J, Yu Z, Guo S, et al. Effects of neuroglobin overexpression on mitochondrial function and oxidative stress following hypoxia/reoxygenation in cultured neurons[J]. Neurosci Res, 2009, 87:164-170.

