頭孢拉定、諾氟沙星及羅紅霉素在中華鱉(Pelodiscus sinensis)日本品系體內殘留代謝的比較研究*
何 欣 張海琪 戴志遠① 王 揚 李詩言
(1.浙江工商大學食品與生物工程學院 杭州 310035;2.浙江省水產質量檢測中心 杭州 310012)
中華鱉(Pelodiscus sinensis)屬于龜鱉目(Testudinata)、鱉科(Trionychidae)、鱉屬(Pelodiscus),是我國重要的水產養殖品種,2012年產量為33.1萬t。目前大陸養殖中華鱉的種類主要包括國家水產新品種中華鱉日本品系、清溪烏鱉,本地種中華鱉太湖群體、黃河群體、廣西群體、江西群體,引進種臺灣群體、泰國群體以及雜交種,以中華鱉日本品系養殖為最多。中華鱉日本品系的養殖模式主要包括溫室養殖、外塘養殖、兩段法養殖、稻鱉共生、蝦鱉混養等,以兩段法養殖最為普遍,經 7—8個月溫室養殖和 4個月的外塘養殖,平均規格在0.75kg以上。隨著中華鱉日本品系的養殖推廣,種質管理不嚴,相互引種混雜導致其優良性能降低,尤其是在人為控溫、高密度集約化的溫室養殖環境下,一些養民為追求高產加大了苗種放養密度,受空間制約、管理水平及水質惡化等影響,其養殖病害時有發生,迫使其使用一些抗生素進行病害的有效治療和預防。已有報道在中華鱉養殖中使用的漁藥有慶大霉素、氨卞青霉素、新霉素、土霉素、四環素、鏈霉素、磺胺類藥物、頭孢拉定、諾氟沙星、羅紅霉素等(孫紅祥等,2000;黃鈞等,2008;譚愛萍等,2011;冷闖等,2012;朱凝瑜等,2013)。這些漁藥的使用雖可在短期內起到很明顯的療效,但會引起病原的抗藥性,為下一次疾病治療埋下隱患;還會導致其在養殖生物體內的積累,進而以食物的途徑進入人體,影響消費安全。雖然大多漁藥的半衰期不長,但由于頻繁使用并進入環境,其引起的環境污染及其可能導致的生態風險已成為國內外關注的熱點環境問題之一。通過漁藥代謝的研究,不僅可以了解漁藥在中華鱉日本品系體內的代謝特征,還可以獲得漁藥在中華鱉體內的殘留狀況,為其合理應用和食用安全提供理論依據。
漁藥的代謝受品種、溫度、給藥方式等因素的影響,因此不同藥物及同種藥物在不同生物體內的殘留代謝不盡相同(湛嘉等,2003)。中華鱉具有獨特的水陸兩棲生活習性,有別于魚蝦等水產動物,也有別于其他陸生生物,其藥物殘留代謝有其自身的特點,不能用魚蝦等其它水生動物體內的藥動學規律來套用。目前有關中華鱉體內藥物代謝規律的研究已有一些報道,涉及的藥物主要有:氟苯尼考(朱麗敏等,2006;張海琪等,2013b)、諾氟沙星(陳文銀等,1997;周輝明等,2009;朱秋華等,2001)、磺胺甲基異惡唑(尹文林等,2004b)、紅霉素(尹文林等,2004a)等,與其他的水產品種相比研究偏少。頭孢拉定屬于β-內酰胺類抗生素,已有在兔(李忠思等,2005)、羊(黃偉雄等,2000)、鼠(吳桂月等,2001)等動物體內的藥動學研究報道,而水產動物體內尚未見有報道。諾氟沙星為喹諾酮類漁藥,已有一次口灌、一次注射、連續注射及一次拌餌口服等不同給藥方式在中華鱉體內的代謝研究(陳文銀等,1997;朱秋華等,2001;潘連德等,2005;周輝明等,2009),但未見有連續多次拌餌給藥方式下中華鱉體內的代謝研究報道。羅紅霉素屬于大環內酯類抗生素,是紅霉素經過修飾,即9位成肟衍生物的產物(Chantotet al,1986),其在人體中的消除半衰期為12.69h(秦玉花等,2003),在家犬體內羅紅霉素消除半衰期為19.50h(唐星等,2003),未見有其在水產動物中的藥代研究報道。本試驗將頭孢拉定、諾氟沙星、羅紅霉素添加到飼料中制作成藥餌口服給藥,并應用液相色譜-串聯質譜(HPLC-MS/MS)分別測定分析中華鱉日本品系在連續 7d給藥后各組織中頭孢拉定、諾氟沙星、羅紅霉素的殘留變化規律,為三種藥物的安全合理用藥及休藥期的制定提供科學依據。
1 材料與方法
1.1 主要儀器與試劑
漁藥濃度測定用儀器為API 4000型高效液相色譜-三重四極桿串聯質譜儀。標準物質頭孢拉定純度大于 91.8%,諾氟沙星純度大于 97.8%,羅紅霉素純度大于96.5%。漁藥頭孢拉定(上海新先鋒藥業有限公司),諾氟沙星(寧波四明制藥有限公司),羅紅霉素(康普藥業股份有限公司)。
1.2 實驗動物
實驗動物采用中華鱉日本品系,來自杭州某生物科技有限公司,取中華鱉日本品系450只,體重為(250±50)g,體質健壯,隨機分為三組,每組 150只,分別放養在大棚控溫水泥池中。試驗前馴養7d,經抽樣測定頭孢拉定、諾氟沙星或羅紅霉素殘留均未檢出,然后開始給藥實驗。
1.3 給藥方法
分別制作頭孢拉定濃度30mg/kg,諾氟沙星濃度300mg/kg及羅紅霉素濃度 30mg/kg的配合飼料。在(25±2)°C水溫下,分別連續7d投喂大棚控溫水泥池中養殖的中華鱉日本品系,日投喂藥餌量為體重的1%—2%。每天8:00時和16:00時各投喂一次,投放于食臺上,以30min之內攝食結束為止。
1.4 樣品采集與濃度測定
自最后一次投喂之后按 1h、2h、4h、8h、16h、24h、48h、72h、120h、144h、168h、240h 和 360h進行取樣,每次分別從三個養殖池塘中隨機各抽取9只,以3只中華鱉的混合組織為一組,3個平行,取血液于肝素化處理過的離心管中,取肝臟、肌肉組織分別保存于無菌的采樣袋中,20°C冰箱保存待測定。分別參照《GB/T 22960-2008河豚魚和鰻魚中頭孢唑啉、頭孢匹林、頭孢氨芐、頭孢洛寧、頭孢喹肟殘留量的測定 液相色譜-串聯質譜法》(中華人民共和國國家質量監督檢驗檢疫總局,2008)、《農業部783號公告-2-2006水產品中諾氟沙星、鹽酸環丙沙星、恩諾沙星殘留量的測定-液相色譜法》(中華人民共和國農業部,2006)和《SN/T 1777.2-2007動物源性食品中大環內酯類抗生素殘留測定方法 第2部分:高效液相色譜串聯質譜法》(中華人民共和國國家質量監督檢驗檢疫總局,2007)進行中華鱉組織中頭孢拉定、諾氟沙星和羅紅霉素殘留濃度測定。采用加標回收和精密度評價檢測方法。
1.5 數據分析
采用藥代動力學 3p97軟件進行數據處理,得出藥動學參數,建立相關方程。
2 結果與分析
2.1 液相色譜-串聯質譜方法學評價
根據頭孢拉定、諾氟沙星和羅紅霉素的理化性質和分子量,通過一級質譜 Q1掃描獲得母離子峰,再進行二級質譜 Q2掃描,得到碎片離子信息,分別篩選兩個離子強度較高的離子與母離子組建成MRM離子對,然后優化去簇電壓(declustering potential,DP)、碰撞能量(collision energy,CE)、離子噴霧電壓(ion spray voltage,IS)、離子源溫度(ion source temperature,TEM)、碰撞氣(Collision-Activated Dissociation,CAD)、射入電壓(entrance potential,EP)、射出電壓(collision cell exit potential,CXP)等質譜參數。三種藥物優化后的部分質譜條件如表1所示。色譜柱為 ACQUITY UPLC BEN Shield RP18分析柱(50mm×2.1mm,1.7μm);流動相為:乙腈–0.1%甲酸水溶液。以空白基質樣品分別添加 1、2、4μg/kg 頭孢拉定,100、200、400μg/kg的諾氟沙星和5、10、20μg/kg的羅紅霉素,采用上述建立的液相色譜串聯質譜方法進行方法學的評價,回收率等結果如表2所示。由表2可見,與以往大多藥物代謝動力學研究所采用的液相色譜法相比,液相色譜-串聯質譜法更具快速、準確、靈敏等優勢,是一種適宜的藥物代謝動力學研究手段。
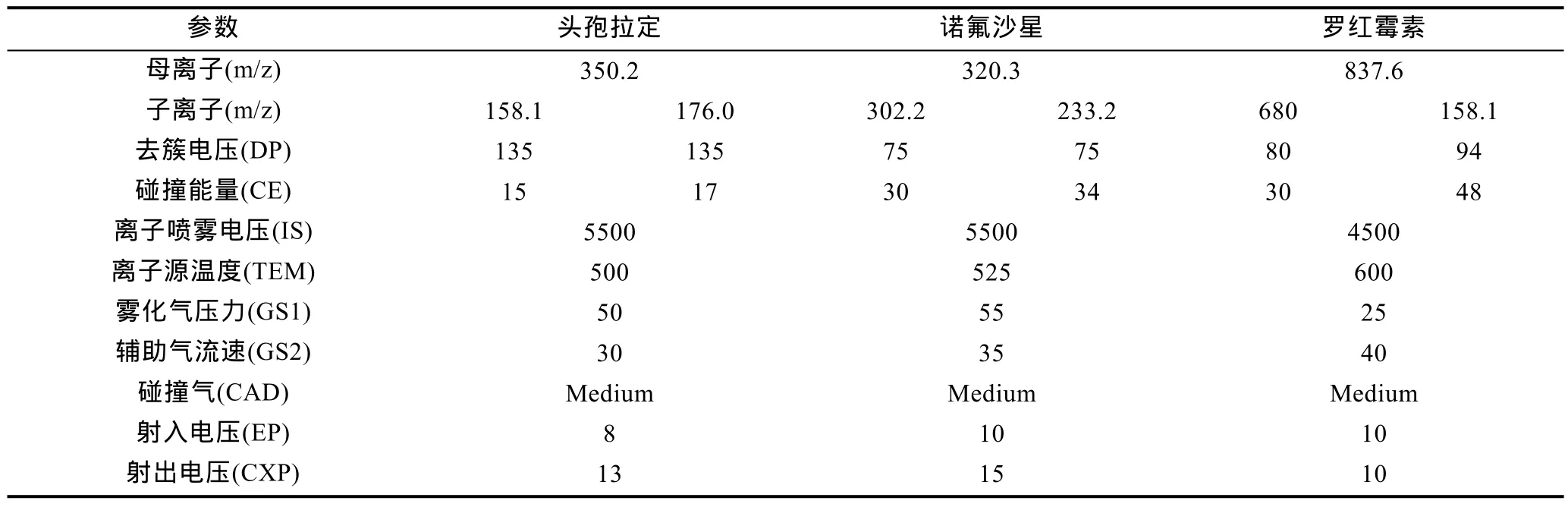
表1 三種藥物優化后的部分質譜條件Tab.1 MS conditions after optimization of three drugs
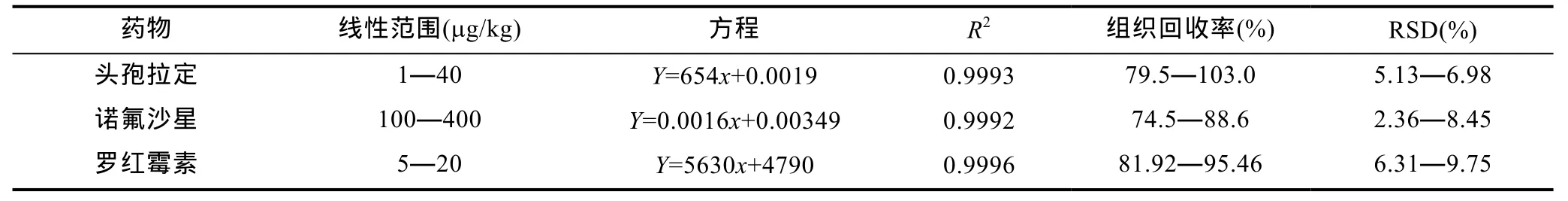
表2 三種藥物的液相色譜-串聯質譜的方法學評價(n=6)Tab.2 The methodological evaluation of the determination of three drugs by HPLC-MS/MS(n=6)
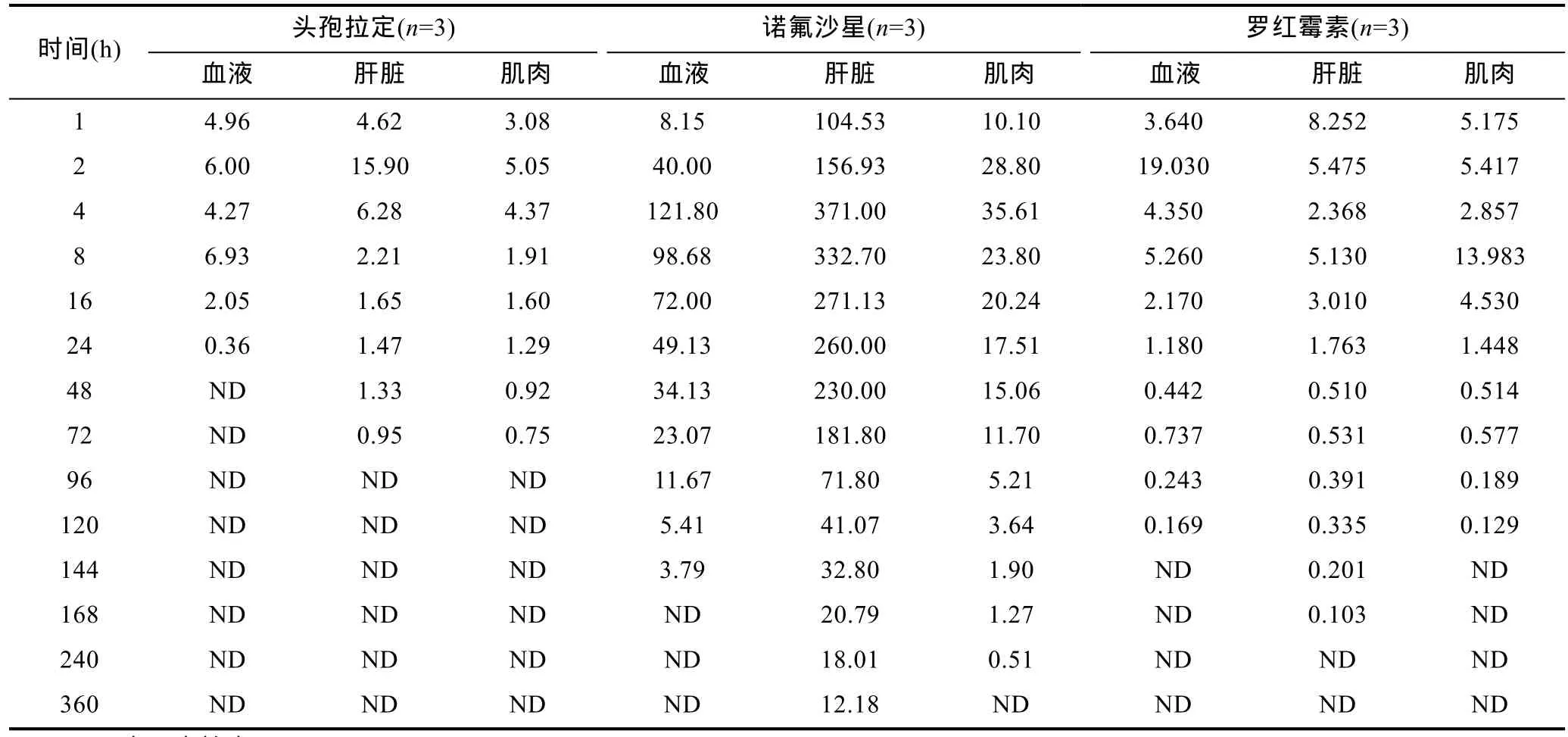
表3 頭孢拉定、諾氟沙星和羅紅霉素在中華鱉各組織中的濃度(μg/kg)Tab.3 Concentrations of cefradine,norfloxacin and roxithromycin in different tissues from soft-shelled turtles(μg/kg)
2.2 各組織中漁藥殘留濃度變化情況
經過對中華鱉日本品系中三種藥物不同時間點殘留的檢測,頭孢拉定、諾氟沙星和羅紅霉素在中華鱉各組織中的濃度如表3所示。頭孢拉定在肝臟和肌肉組織中均在2h時出現最高峰,濃度分別為15.9μg/kg和5.05μg/kg,隨著時間推移,漁藥濃度逐漸下降,直至96h時不再測及。在血液中出現了雙峰,分別在2h和8h時,濃度分別為6.00μg/kg和6.93μg/kg。諾氟沙星在血液、肝臟和肌肉組織中均在 4h出現最高峰,濃度分別為 121.8μg/kg、371μg/kg和 35.61μg/kg。隨著時間推移,濃度逐漸下降。血液和肌肉中分別于168h和 360h時不再有檢出,而在肝臟中至 360h仍能檢出。羅紅霉素2h在血液中達到最高濃度19.03μg/kg,隨后逐步下降,至 144h未有檢出。而在肝臟和肌肉中則出現了雙峰現象,最高峰的濃度分別為8.252μg/kg和 13.983μg/kg。
2.3 藥動學參數的計算
通過藥動學 3P97分析軟件,分別計算了頭孢拉定、諾氟沙星和羅紅霉素在中華鱉血液,肝臟和肌肉中的藥動學參數。經過分析,以Akaike Information Criterion法(AIC信息準則)作為評判標準,頭孢拉定和諾氟沙星在中華鱉血液,肝臟和肌肉中的代謝符合一室消除模型。羅紅霉素在中華鱉血液,肝臟和肌肉中的代謝符合二室消除模型。三種藥物在中華鱉日本品系組織中的藥動學參數如表4、表5、表6所示。

表4 頭孢拉定在中華鱉日本品系三種不同組織中的藥動學參數Tab.4 Pharmacokinetic parameters of cefradine in three different tissues from soft-shelled turtles Japanese strain
頭孢拉定中C血液= 11.69×e-0.1130t,R2=0.9316;C肝臟=20.16×e-0.0684t,R2=0.9691;C肌肉= 3.599×e-0.0770t,R2=0.9061;諾氟沙星中C血液= 129.21×e-0.0308t,R2=0.9267;C肝臟= 409.6×e-0.0167t,R2=0.9996;C肌肉= 31.24×e-0.0179t,R2=0.9486;羅紅霉素中C血液= 40.21×e-0.8514t+1.471×e-0.1798t,R2=0.9884;C肌肉= 3.349×e-0.0816t+5.358×e-0.04430t,R2=0.9342;C肝臟= 4.942×e-0.07221t+0.7362×e-0.006898t,R2=0.9396。頭孢拉定在中華鱉日本品系血液、肌肉和肝臟中消除半衰期T1/2(Ke)分別為6.132h、9.002h和 10.132h。諾氟沙星在中華鱉日本品系血液、肌肉和肝臟中消除半衰期T1/2(Ke)分別為22.526h、39.715h和 41.585h。羅紅霉素在中華鱉日本品系血液、肌肉和肝臟中消除半衰期T1/2(β)分別為38.54h、15.65h和100.5h。
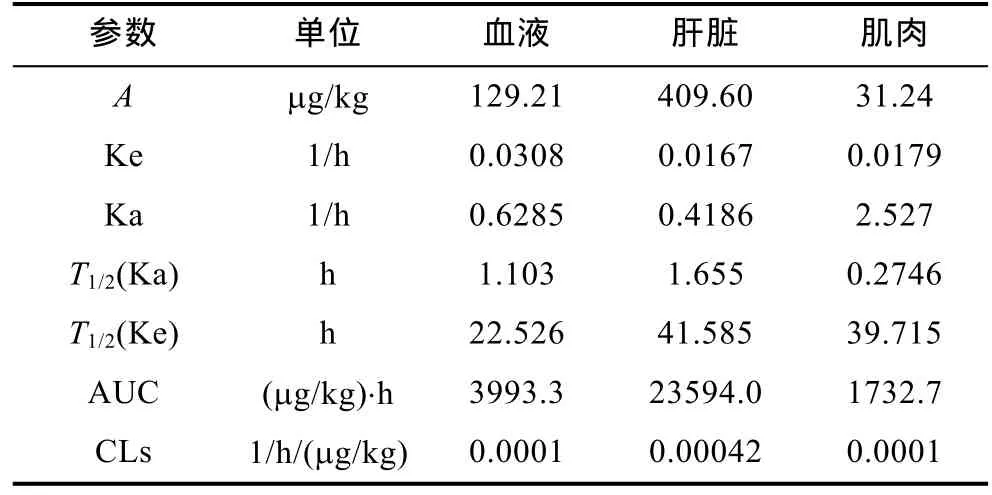
表5 諾氟沙星在中華鱉日本品系三種不同組織中的藥動學參數Tab.5 Pharmacokinetic parameters of norfloxacin in three different tissues from soft-shelled turtles Japanese strain
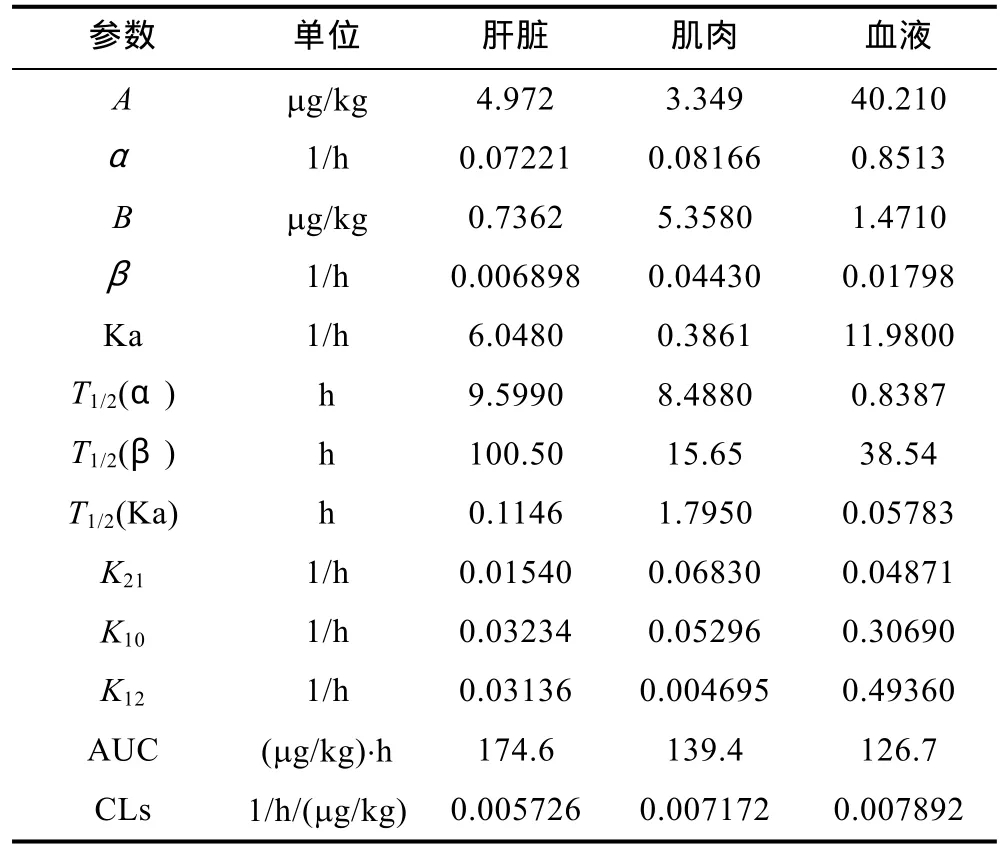
表6 羅紅霉素在中華鱉日本品系三種不同組織中的藥動學參數Tab.6 Pharmacokinetic parameters of roxithromycin in three different tissues from soft-shelled turtles Japanese strain
3 討論
3.1 藥時曲線中多峰現象的討論
本次實驗中華鱉經過連續7d投喂三種藥物之后,其中頭孢拉定和羅紅霉素的藥-時曲線中出現了雙峰的現象。該現象也存在于不少藥動學研究中,如給家兔灌胃阿司匹林腸溶片后,受試動物的藥時曲線均有雙峰現象(談恒山等,1994)。目前有關多峰的產生大致有兩種可能的機制:一是由于藥物在胃腸道中存在的不同部位有多個吸收位點,口服后在不同部位的吸收時間和吸收速率產生了不一致,被吸收的藥物在血液中疊加形成雙峰或多峰現象;二是藥物的肝腸循環作用,即藥物在腸道被重吸收所導致(Manishet al,2003;魏鳳環等,2005)。
3.2 三種藥物在中華鱉日本品系體內不同組織的消除半衰期規律的探討
本試驗選用頭孢拉定、諾氟沙星和羅紅霉素進行連續給藥 7d拌餌投喂的方式給藥,從三種藥物在中華鱉日本品系體內的半衰期來看,頭孢拉定在中華鱉日本品系血液、肝臟和肌肉中消除半衰期分別為6.132h、10.132h和9.002h,時間最短。諾氟沙星在血液、肝臟和肌肉中的消除半衰期分別是 22.526h、41.585h和39.715h。羅紅霉素在血液、肌肉和肝臟中的消除半衰期分別為38.54h、15.65h和100.5h,時間最長。羅紅霉素的蛋白結合率高達90%—95%,有較強的滲透能力,呼吸道及血液內的濃度高,能夠穿透并能進入吞噬細胞內(單靖珊,1999),主要由膽汁與糞便排除體外,尿排出量很少(陳強,1994)。諾氟沙星的口服后約35%—45%的給藥量可被吸收,蛋白結合率為14%(李海濱等,1997),排泄主要通過腎臟,其次通過肝臟消除(曾振靈等,1992)。而頭孢拉定除了在體內的轉化外,原藥幾乎全部從腎臟中排除(張志林等,1989)。因此體內的蛋白結合率與原藥排泄的途徑是影響藥物在動物體內消除半衰期的重要因素之一。
與其他研究相比,頭孢拉定在中華鱉血液中的半衰期遠長于人血液中的1.13h(石焱等,2009)、老鼠血液中的 145.65min(梁駿,2008)和雞血液中的65.493min(杜云良等,2010)。有學者認為導致種屬間差異的原因包括某種酶的有無或活性的差別,以及血漿蛋白結合率,靶器官結合率等(鄒文等,2007)。此外,溫度的不同也是重要因素,本實驗中采用的水溫是(25±2)°C,中華鱉體內溫度遠低于雞的 41.5—43.0°C、人和老鼠的35—38.5°C的正常體溫,因此半衰期相對要長一些。本實驗在(25±2)°C的水溫下,諾氟沙星采用連續給藥 7d的給藥方式,在中華鱉日本品系血液中至144h時不再有檢出,肌肉在240h仍能檢出,而肝臟則在 360h時仍然能檢出殘留,結果與以往研究結果相似,如潘連德等(2005)研究表明,經單次口服灌胃給藥,患病和健康的中華鱉血液中的諾氟沙星適合于一室消除模型,其消除半衰期分別為 17.279h和 45.112h;朱秋華等(2001)在 30°C的水溫中以3種水平混入飼料中投喂中華鱉,其血液中的諾氟沙星在120h時仍能檢出殘留,直到240h才未檢出。肌肉組織中可達到相對較高水平,在停藥后肌肉中藥物殘留量較高,直到240h排出75.8%。在生產實踐中,諾氟沙星大多采用多次拌餌的給藥方式進行,因此本結果更具應用性。本實驗中羅紅霉素(25±2)°C下在中華鱉日本品系血液、肌肉和肝臟中的消除半衰期分別為38.54h,比人體血液的12.69h和家犬體內的 19.50h要高,也比紅霉素在中華鱉中的消除半衰期要長(尹文林等,2004a),因此羅紅霉素作為漁藥使用,需要更長的休藥期。
3.3 漁藥殘留監控組織的選擇
不同的漁藥在水產動物體內各組織中的殘留持久性不盡相同,因此對水產品質量安全監控提出不同的要求。目前,我國允許諾氟沙星作為漁藥使用,其在水產品中的限量標準(MRL)為50μg/kg(《NY5070-2001無公害食品 水產品中漁藥殘留限量》)。2005年中華人民共和國農業部第 560號公告將羅紅霉素和頭孢拉定列為抗生素、合成抗菌藥及農藥類范疇(中華人民共和國農業部,2006),至今未有相關限量標準。羅紅霉素和紅霉素都屬于大環內酯類抗生素,紅霉素屬于無公害標準的禁用漁藥,由于羅紅霉素的結構和治療功效與其相似,因此羅紅霉素是替代紅霉素的首選漁藥。通過羅紅霉素于紅霉素在中華鱉組織中的代謝情況的分析,羅紅霉素比紅霉素的消除半衰期更長,需要更長的休藥期方能上市。在以往的水產品質量安全殘留監控中,全部采用肌肉組織作為監控組織。但從本文的三種藥物以及本實驗室以往報道的氟甲喹的結果來看(張海琪等,2013a),肝臟組織的濃度要遠高于肌肉組織。肝臟器官作為代謝場所,除了通過腎臟以原型藥物排出體外之外,漁藥在體內的轉化必須要通過的細胞色素P450酶系在肝臟中的含量最豐富(Slaughteret al,1995),因此肝臟組織濃度普遍高于其它組織。在人們對水產品質量安全要求越來越高的背景下,建議在殘留監控時,選擇肝臟組織進行分析。
中華人民共和國農業部,2006.水產品中諾氟沙星、鹽酸環丙沙星、恩諾沙星殘留量的測定——液相色譜法.北京:中國標準出版社,1—3
中華人民共和國國家質量監督檢驗檢疫總局,2007.動物源性食品中大環內酯類抗生素殘留測定方法 第 2部分:高效液相色譜串聯質譜法.北京:中國標準出版社,1—4
中華人民共和國國家質量監督檢驗檢疫總局,2008.河豚魚和鰻魚中頭孢唑啉、頭孢匹林、頭孢氨芐、頭孢洛寧、頭孢喹肟殘留量的測定.液相色譜-串聯質譜法.北京:中國標準出版社,1—4
尹文林,沈錦玉,錢 冬等,2004a.紅霉素在中華鱉體內的藥代動力學及中長期殘留的研究.水產學報,12(28):69—72
尹文林,沈錦玉,錢 冬等,2004b.磺胺甲基異惡唑在中華鱉體內藥代動力學及殘留研究.水產學報,12(28):58—62
石 焱,弓小雪,張 洋等,2009.頭孢拉定膠囊人體藥代動力學和生物等效性.臨床軍醫雜志,37(6):1097—1099
朱麗敏,楊先樂,林啟存等,2006.肌注和口服氟苯尼考在中華鱉體內殘留分析及藥代動力學.水產學報,8(30):515—519
朱秋華,錢國英,2001.3種藥物在甲魚體內的殘留研究.中國水產科學,8(3):50—53
朱凝瑜,孔 蕾,貝亦江等,2013.中華鱉遲緩愛德華氏菌的分離鑒定與致病性研究.海南:中國水產學會魚病專業委員會2013年學術研討會論文摘要匯編,184
孫紅祥,舒妙安,2000.中華鱉溶血性腹水病病原菌的分離鑒定及藥敏性研究.浙江大學學報(農業與生命科學版),26(2):177—180
杜云良,劉彥威,韓 博等,2010.雞單劑量口服頭孢拉定的藥代動力學研究.江蘇農業科學,(2):232—233
李忠思,張小娜,陳 方等,2005.HPLC法測定頭孢硫脒大鼠體內分布濃度及其藥動學研究.中國抗生素雜志,30(10):611—616
李海濱,林美清,1997.諾氟沙星的臨床藥理.云南民族學院學報(自然科學版),6(1):73—75
吳桂月,孫成春,董玉波等,2001.硫酸頭孢噻利在兔體內的藥動學研究.中國藥房,22(1):24—26
鄒 文,周 文,2007.藥物代謝的種屬和性別差異研究.齊魯藥事,26(12):735—737
冷 闖,鄧舜洲,張文波等,2012.中華鱉致病性嗜水氣單胞菌的分離鑒定及藥敏試驗.動物醫學進展,33(2):124—129
張志林,朱天癢,1989.頭抱拉定的藥理和臨床.新藥與臨床,8(5):271—275
張海琪,何 欣,錢鳴蓉等,2013a.氟甲喹在中華鱉日本品系組織中的殘留代謝規律研究.西南大學學報(自然科學版),35(9):36—42
張海琪,林 靜,黎 飛等,2013b.中華鱉日本品系體內氟苯尼考藥物代謝動力學研究.動物學雜志,48(3):465—473
陳 強,1994.大環內酯類抗生素的臨床評價.上海醫藥情報研究,35(4):13—17
陳文銀,印春華,1997.諾氟沙星在中華鱉體內的藥代動力學研究.水產學報,12(21):434—437
周輝明,張愛芳,吳志強,2009.兩種抗生素在甲魚組織中的殘留研究.江西水產科技,(3):23—26
單靖珊,1999.羅紅霉素藥理作用特點.河北醫藥,21(1):44
秦玉花,趙紅衛,丁祖銳等,2003.羅紅霉素膠囊劑藥代動力學及相對生物利用度的研究.數理醫藥學雜志,(16):149—150
唐 星,張 倩,邵瑞瑩等,2003.羅紅霉素緩釋膠囊在家犬體內的藥動學及相對生物利用度.沈陽藥科大學學報,11(20):391—394
談恒山,姚 斌,顧培德,1994.阿司匹林藥-時曲線的雙峰研究.中國藥理學通報,10(5):387
黃 鈞,朱 蕓,韋友傳,2008.中華鱉“浮腫病”致病菌的分離與鑒定.廣西畜牧獸醫,24(6):375—376
黃偉雄,宋國維,甘小莊等,2000.羊的膜肺過程對頭孢拉定藥代動力學的影響.基礎醫學與臨床,20(5):82—84
梁 駿,2008.頭孢拉定在糖尿病大鼠和正常大鼠體內藥代動力學的比較性研究.大連:大連醫科大學碩士學位論文,22
曾振靈,馮淇輝,1992.獸用氟喹諾酮類藥物研究與臨床應用進展.中國獸醫科技,25(3):39—41
湛 嘉,李佐卿,康繼韜等,2003.影響水產動物藥代動力學的因素.中國獸藥雜志,37(12):38—41
譚愛萍,趙 飛,姜 蘭等,2011.中華鱉致病性蠟樣芽孢桿菌的分離鑒定與特性分析.廣東農業科學,(20):115—119
潘連德,石張東,鄧華美等,2005.中華鱉對諾氟沙星的代謝動力學研究.上海:中國水產學會魚病學專業委員會第六次委員大會暨國際學術討論會論文(摘要)集,236—243
魏鳳環,王永剛,羅佳波,2005.藥動學多峰現象研究概況.中國藥學雜志,(23):1772—1774
Chantot J F,Bryskier A,Gasc J C,1986.Antibacterial activity of roxithromycin:a laboratory evaluation.J Antibiot,39(5):660—668
Manish I,Shio K S,Bhrameshwar Met al,2003.Pharmacokinetics,in-situ absorption and protein binding studies of a new neuroleptic agent centbutindole in rats.Eur J Pham Sci,(19):105
Slaughter R L,Edwards D J,1995.Recent advances:the cytochrome P450 enzymes.Ann Pharmacother,29(6):619—624

