毛尖紫萼蘚(Grimmia pilifera)耐旱相關cDNA文庫中4個候選基因的表達分析
宋曉宏, 沙 偉
(1.長江師范學院生命科學與技術學院,重慶 涪陵 408100;2.齊齊哈爾大學生命科學與工程學院,黑龍江 齊齊哈爾161006)
苔蘚植物是自然界的拓荒者之一,在長期的進化過程中許多耐旱蘚類植物形成了特殊的形態、細胞及大分子等特征,具有很強的耐旱能力,并且在復水過程中可誘導啟動恢復機制,如叢本蘚(Anoectangium compactum)和土生蘚類(Tortula ruralis),經受幾個月甚至幾十年的干旱仍能保持生命力[1-2]。國外從20世紀70年代起開始研究苔蘚植物抗旱性,其中以土生墻蘚研究較多,已有大量關于其應對嚴重的水分和干旱脅迫的生理學、生物化學、細胞響應及分子生物學的研究[3-6]。毛尖紫萼蘚(Grimmia pilifera)是紫萼蘚屬(Grimmia)中典型旱生植物,生長在向陽的裸巖上,久旱而不喪失生活力,是很好的抗旱資源。本研究從已構建的毛尖紫萼蘚耐旱cDNA文庫中篩選4個干旱脅迫誘導表達的基因,分析其在干旱及復水條件下的表達模式,試圖找到重要的抗旱相關基因,為研究毛尖紫萼蘚抗旱分子機制提供初步的理論基礎。
1 材料與方法
1.1 材料及處理
毛尖紫萼蘚采自黑龍江省北部五大連池風景區的老黑山。清洗后在自然光照條件下,保持水分充足,室溫培養7~10 d至生理指標[質膜透性、丙二醛(MDA)含量、游離脯氨酸含量等]穩定,作為對照材料。然后停止澆水進行干旱處理,依據已有對毛尖紫萼蘚干旱及復水過程中抗旱相關生理指標測定結果選擇取材范圍[7],分別取干旱 1 d、3 d、5 d,再復水 0 h、0.5 h、1.0 h、6.0 h、12.0 h、24.0 h、36.0 h、48.0 h共11個時間點材料,液氮速凍后-80℃冰箱保存備用。
1.2 總RNA提取及cDNA合成
蘚類植物普遍含有萜類、固醇類、酚類等次生代謝產物,使提取的 RNA易于降解。為此在 SDS法[8]基礎上加以改進,液氮研磨過程中加入聚乙烯吡咯烷酮(PVP)和抗壞血酸(VC)粉末,裂解步驟中加入終濃度20%的乙醇,沉淀步驟用1/2體積8 mol/L LiCl和1/2體積75%乙醇,-20℃沉淀30 min。RNA純化使用RQ1 RNase-free DNas試劑盒。cDNA合成采用Promega公司的M-MLV RT試劑盒,合成方法參照說明書進行。
1.3 候選基因及引物設計
通過生物信息學分析,從毛尖紫萼蘚耐旱cDNA文庫[9]中選取與活性氧清除、信號轉導、代謝、物質轉運及離子平衡相關的過氧化氫酶相似基因(GpCAT)、絲氨酸/蘇氨酸蛋白激酶相似基因(Gp-PAK)、H+-ATP酶相似基因(GpATP)和蔗糖合成酶相似基因(GpSuSy)進行表達分析。根據這4個基因的EST序列,結合熒光定量PCR引物設計原則,采用Primer express v3.0軟件設計定量PCR引物。引物序列見表1。
1.4 候選基因表達分析
以18SrRNA作為內參基因,設置空白對照,每個反應設置3次重復。分別以對照和11個時間點材料cDNA為模板,采用熒光定量PCR分析各基因在干旱及復水條件下的表達。熒光定量PCR使用TaKaRa公司的 SYBR Premix Ex TaqTMⅡ(Perfect Real Time)試劑盒在伯樂公司的Chromo4熒光定量PCR儀上進行,試驗數據采用OpticonMonitor3軟件自動分析。

表1 候選基因熒光定量PCR引物序列Table 1 Fluorescence quantitative PCR primer sequences of the candidate genes
2 結果與分析
2.1 干旱條件下基因的表達
以復水培養7~10 d的毛尖紫萼蘚材料中基因表達量作為對照,并定義為1個單位,干旱條件下各基因表達量如圖1所示。4個基因在干旱條件下基因表達均上調,干旱5 d時GpCAT、GpPAK、GpATP和GpSuSy基因表達量分別達到對照的3.5、3.7、4.6和3.2倍,說明4個候選基因均受干旱誘導表達。在毛尖紫萼蘚抵御干旱的過程中,GpPAK作為信號轉導系統的關鍵酶,通過可逆的蛋白質磷酸化過程在細胞內外形成信號轉導途徑,完成信號轉導過程;GpCAT作為活性氧清除酶系統的一員發揮作用,使細胞免于遭受H2O2的毒害;GpATP調節植物離子及滲透物質平衡;GpSuSy調控蔗糖的合成,從而維持細胞膨壓,保證其正常生長。
2.2 復水條件下基因的表達
復水條件下各基因表達量如圖2所示。復水初期(0.5至1.0 h),4個基因均表達下調,但之后表達水平各異。其中,GpCAT基因復水后1.0 h表達水平開始大幅上升并呈波動變化,至復水后48.0 h表達量仍為對照的2倍;GpSuSy基因復水后0.5 h表達水平迅速下降,并逐漸恢復到對照水平;GpATP基因復水后1.0 h表達量大幅上升,復水24.0 h時表達量最高,為對照的7.3倍,干旱5 d的1.6倍;GpPAK基因復水后與其他基因相比在短時間內表達量有較大幅度升高,復水6.0 h表達量最高,達到對照的4.2倍,之后逐漸下降到對照水平。說明并不是所有基因都受復水誘導表達,有些基因可能對毛尖紫萼蘚復水后快速恢復生長發揮作 用,并且分別作用于復水后的不同時期。
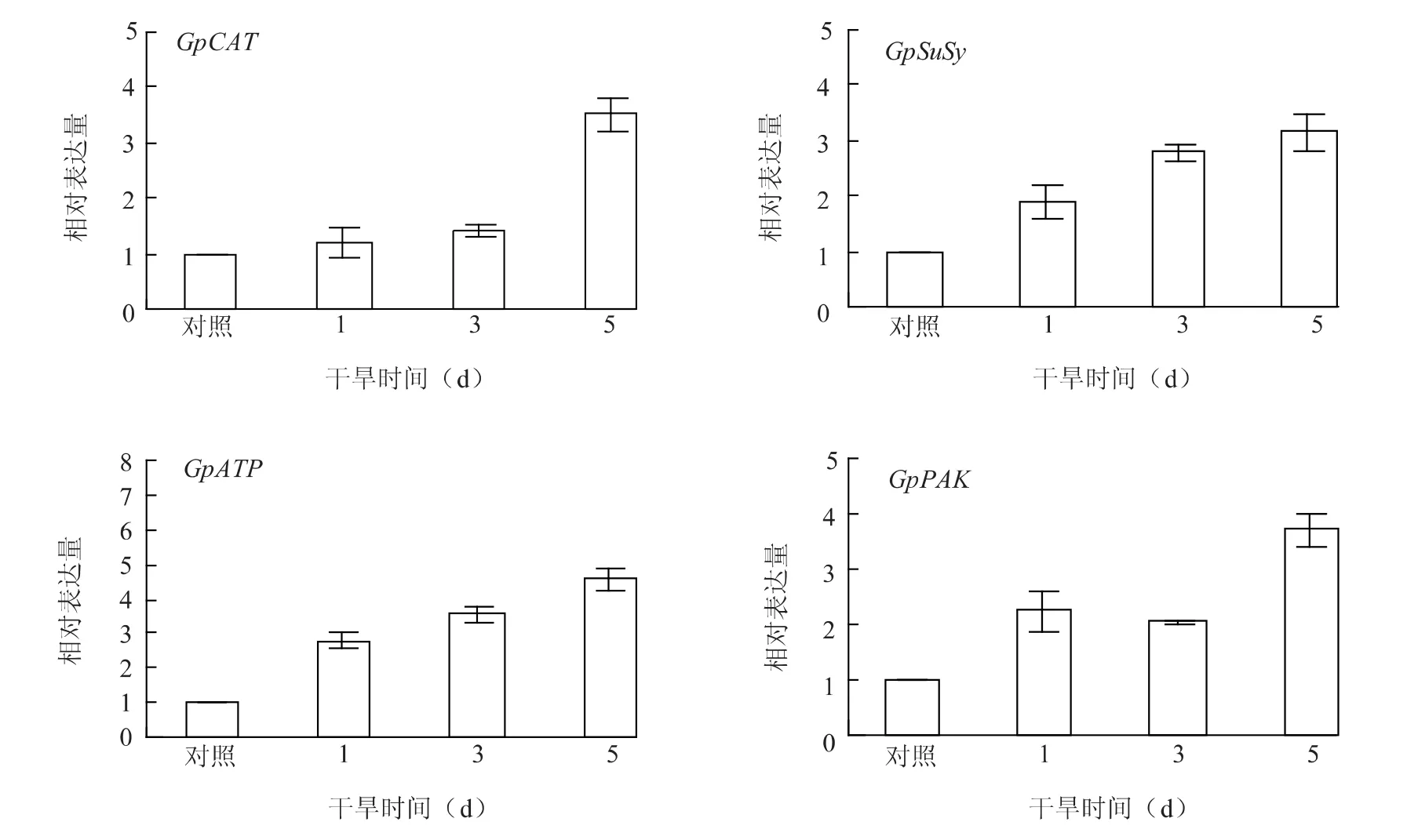
圖1 干旱過程中基因的表達模式Fig.1 Expression profiles of drought stress induced genes during dehydration
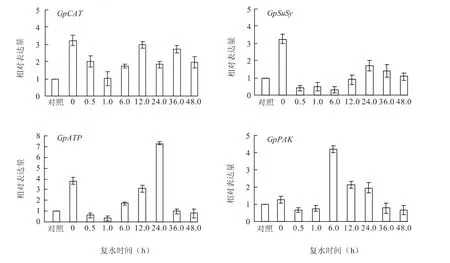
圖2 復水過程中基因的表達模式Fig.2 Expression levels of drought stress induced genes during rehydrationn
3 討論
耐旱蘚類具有特殊的形態、細胞及大分子等特征,既可以適應緩慢干旱脅迫,又可以抵御快速干旱造成的傷害,復水后幾秒鐘外部形態特征即可恢復正常,并很快恢復生長,區別在于緩慢干旱后復水生理代謝恢復速度很快,而快速干旱后復水要較長時間恢復。Hinshiri等[10]研究牛舌蘚(Anomdonviticu losus)和光萼苔(Porella pltyphylla)時發現,緩慢干旱8~9 d后再復水,兩種苔蘚的呼吸和光合速率可迅速達到正常水平,積極的碳平衡幾乎在瞬間建立。
植物干旱后復水能繼續生長也是抗旱性的一種表現,多數復蘇植物可以在復水24 h后恢復正常代謝水平[11-12],并且復水后的基因表達與干旱脅迫時的基因表達是一個連續的過程,很多基因的表達具有連續性,在復水過程中依然起到重要作用[13-14]。耐旱蘚類復水時基因表達有很大變化,Oliver等[15-16]對土生墻蘚的研究結果表明,復水時蛋白質的合成受到巨大影響,其中25種蛋白質合成終止或大幅度下降,74種蛋白質合成開始或大幅度上升,這2組蛋白質分別被稱為Hydrins和Rehydrins。在復水延長期,Rehydrins和Hydrins的合成在恢復至正常水平的過程中也有所不同,在水化后2~4 h內,幾乎所有Hydrins的合成達到正常水平,而一些Rehydrins僅合成不到2 h,另一些10~12 h后仍呈上升趨勢,24 h后所有蛋白質均達到正常水平[17]。因此也有學者[18]推測,復水早期的Rehydrins蛋白質可能參與修復質膜損傷,而復水延長期間的Rehydrins蛋白質則可能參與細胞器結構和功能的長期恢復過程。本研究中,GpSuSy基因在復水后表達量大幅下降,推測其可能為編碼Hydrins的基因;GpPAK和GpATP基因在復水后表達量高于干旱處理,分別在復水6 h和24 h時達到最高,推測它們為編碼Rehydrins的基因,主要受復水誘導,在再水化恢復過程中對細胞的質膜氧化損傷及細胞器的結構功能進行修復;GpCAT基因在干旱及復水條件下都有很高的表達量,無法判斷其是編碼Rehydrins或Hydrins的基因,但證明了毛尖紫萼蘚與土生墻蘚有類似的特點,干旱及復水條件下某些基因表達具有連續性。
[1] 江 洪.黔西北鉛鋅礦廢棄地與黔西南紅土型金礦苔蘚植物的比較[J].江蘇農業科學,2013,41(7):365-367.
[2] 張安世,張為民,陳 娟,等.基于葉綠體rps4基因序列的部分苔蘚植物的親緣關系[J].江蘇農業科學,2012,40(12):52-53.
[3] WOOD A J,OLIVER M J.Translational control in plant stress:the formation of messenger ribonucleoprotein particles(mRNPs)in response to desiccation of Tortula ruralis gametophytes[J].The Plant Journal,1999,18(4):359-370.
[4] WOOD A J,DUFF R J,OLIVER M J.Expressed sequence tags(ESTs)from desiccated Tortula ruralis identify a large number of novel plant genes[J].Plant Cell Physiology,1999,40(4):361-368.
[5] CHEN X B,ZENG Q,WOOD A J.The stress-responsive Tortula ruralis gene ALDH21A1 describes a novel eukaryotic aldehyde dehydrogenase protein family[J].Journal of Plant Physiology,2002,59:677-684.
[6] OLIVER M J,DOWD SE,ZARAGOZA J,et al.The rehydration transcriptome of the desiccation-tolerant bryophyte Tortula ruralis:transcript classification and analysis[J].BMC Genomics,2004,5:89.
[7] 郭周良.不同環境下兩種耐旱蘚的蛋白質表達及生理指標差異的研究[D].齊齊哈爾:齊齊哈爾大學,2007:14-25.
[8] 沙 偉,閆苗苗,呂鳳香.自然干燥紫萼蘚總RNA提取方法[J].植物研究,2006,26(6):715-717
[9] 宋曉宏,沙 偉,林 琳,等.毛尖紫萼蘚干旱脅迫cDNA文庫的構建[J].植物研究,2010,30(6):713-717.
[10] HINSHIRI H M,PROCTOR M C F.The effect of desiccation on subsequent assimilation and respiration of the bryophytes Anomodon viticu Losus and Porella platyphylla[J].New Phytologist,1971,70:527-538.
[11] OLIVER M J,VELTEN J,MISHLER B D.Desiccation tolerance in bryophytes:a reflection of the primitive strategy for plant survival in dehydrating habitats[J].Integrative and Comparative Biology,2005,45:788-799.
[12] LE T N,MCQUEEN-MASON S J.Desiccation-tolerant plants in dry environments[J].Reviews in Environmental Science and Biotechnology,2006,5:269-279.
[13] MICHAEL P.Patterns of desiccation tolerance and recovery in bryophytes[J].Plant Growth Regulation,2001,35:147-156.
[14] JIANG G Q,WANG Z,SHANG H H,et al.Proteome analysis of leaves from the resurrection plant Boea hygrometrica in response to dehydration and rehydration[J].Planta,2007,225:1405-1420.
[15] OLIVER M J.Influence of protoplasmic water loss on the control of protein synthesis in the desiccation-tolerant moss Tortula ruralis:Ramifications for a repair-based mechanism of desiccation-tolerance[J].Plant Physiol,1991,97(4):1501-1511.
[16] OLIVER M J,VELTEN J,WOOD A J.Bryophytes as experimental models for the study of environmental stress tolerance:Tortula ruralis and desiccation-tolerance in mosses[J].Plant Ecology,2000,151(1):73-84.
[17] OLIVER M J.Desiccation Tolerance in vegetative plant cells[J].Pysiologia Pantarum,1996,97:779-787.
[18]張 萍,白學良.耐旱苔蘚植物生理學及分子生物學研究進展[J].內蒙古大學學報:自然科學版,2004,35(2):227-233.

