養殖活動對超微型浮游生物分布影響的研究*
孫 輝 汪 岷① 汪 儉 宋 雪 邵紅兵 甄 毓
(1. 中國海洋大學 海洋生物遺傳學與基因資源利用教育部重點實驗室 青島 266003;2. 中國海洋大學 環境科學與工程學院 青島 266100)
由于長期的過度捕撈和市場需求的擴大使得近海漁業資源日漸枯竭, 自20世紀70年代起, 世界各國都開始大力發展近海養殖業, 而中國的近海養殖經過近三十年的發展, 無論是近海養殖面積還是總產量都已經是世界首位。隨著近海養殖業的快速發展,養殖區的生態環境惡化問題日益凸顯, 針對這些問題學者們展開了一系列的研究, 包括對養殖區的網采浮游植物分布以及種類鑒定的研究, 發現養殖區網采浮游植物的峰值出現在秋季, 其中赤潮生物有近60種(陳碧鵑等, 2001; 張玉宇等, 2008); 對養殖區異養細菌的研究, 發現其豐度呈現出典型的單峰型周年變化模式, 年度峰值出現在夏季, 而專性或兼性厭氧細菌豐度的增加會導致養殖環境的進一步惡化(劉文華等, 1996; 王文強等, 2006; 吳建平等, 2006;馬繼波等, 2007); 對養殖區浮游病毒的研究, 發現浮游病毒的峰值出現在夏季, 且養殖區浮游藻類對浮游病毒豐度的影響較大(于佐安等, 2011)。目前對養殖區的各項研究報道主要集中于對單一生物因子的觀察和分析, 尚未對多種生物因子進行同時檢測和分析, 以探討人類養殖活動對超微型生物生態環境的影響。
本文利用流式細胞儀對河北省扇貝養殖區聚球藻、微微型真核藻類、異養細菌、浮游病毒4季的豐度分布特征進行了研究。河北省扇貝養殖區自90年代以來一直是我國北方重要的扇貝養殖基地之一,養殖面積超過了400km2。隨著養殖密度的逐年增加,養殖區的生態環境越來越脆弱。自2009年起, 每年6—7月間發生由微微型浮游藻類引發的大范圍赤潮(Zhanget al, 2012), 表明人類養殖活動給海洋生態環境帶來了巨大的影響, 尤其是超微型生物生態系統。本文通過分析養殖區主要的三類超微型生物豐度分布特征以及三者之間的關系、各生物因子與環境因子的相關性, 并與渤海、北黃海非養殖區的相關研究數據進行對比, 以期全面了解人類養殖活動對養殖區超微型生物生態所產生的影響, 為養殖環境的預警及生態修復提供依據。
1 調查海域與站位設定
河北省扇貝養殖主要集中在秦皇島市沿海, 境內有洋河、戴河、新開河、石河等多條河流入海, 為近海養殖區帶來大量豐富的營養鹽。這一海域除港區外圍的錨地和航道未設養殖區外, 其余近海基本都布有養殖設施, 其中撫寧、昌黎兩地從5米等深線一直延伸至外海12海里處均設有扇貝養殖區, 其范圍在緯度39°20′—40°00′, 經度119°10′—119°55′。
本文分別于春(2012年4月)、夏(2012年6月)、秋(2012年8月)、冬(2012年12月)4個季節對河北省扇貝養殖區進行采樣, 設3個采樣點Q1、Q2和Q3,在2012年6月采樣期間觀察到赤潮暴發; 依托國家自然科學基金委共享航次, 對渤海內和北黃海非養殖區進行春(2012年4月)、夏(2011年7月)、秋(2010年9月)、冬(2012年11月)4季樣品采集, 渤海內非養殖區設3個采樣點B1、B2和B3; 北黃海非養殖區設3個采樣點Y1、Y2和Y3(圖1)。
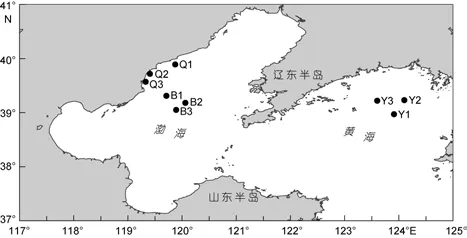
圖1 河北省扇貝養殖區與渤海、北黃海非養殖區采樣站位圖Fig.1 The sampling stations in scallop cultivation and the no-cultured area of the Bohai Sea and the Yellow Sea
2 材料與方法
2.1 樣品采集與儲存
使用Niskin采水器采集表層海水, 取3mL海水用多聚甲醛進行固定, 終濃度為1%, 液氮速凍, 保存于-80°C, 用于聚球藻和微微型真核浮游藻類的分析; 取5mL海水用戊二醛進行固定, 終濃度為0.5%,液氮速凍, 保存于-80°C, 用于異養細菌和浮游病毒的分析。
2.2 聚球藻、微微型真核浮游藻類、異養細菌和浮游病毒計數
聚球藻與微微型真核浮游生物測定時, 取1mL樣品加入10μm內標熒光微球, 利用流式細胞儀(Beckman Coulter FC500-MPL)測定其豐度。
異養細菌與浮游病毒測定時, 取495μL樣品加入5μL SYBR Green-I (Molecular Probes)染色劑, 終濃度為10-4, 放置于暗處染色15分鐘, 加入1μm內標熒光微球, 使用流式細胞儀(Beckman Coulter FC500-MPL)測定其豐度。
2.3 環境理化參數的測定
養殖區水溫、鹽度、營養鹽等數據由本課題化學組提供; 非養殖區水溫、鹽度、營養鹽等資料由船載SBE19-CTD測得。
2.4 數據分析
用SPSS軟件進行獨立樣本均值的差異性檢驗,并分析聚球藻、微微型真核藻類、異養細菌和浮游病毒的豐度在季節分布上的差異; 利用Canoca 4.5軟件進行養殖區與非養殖區超微型浮游生物與環境因子主成分分析。
3 結果
3.1 聚球藻豐度的分布
養殖區3個站位聚球藻豐度季節變化一致(圖2),聚球藻豐度在9.00×102—7.07×105cell/mL之間, 平均值為(1.06±0.36)×105cell/mL (n=24)。聚球藻豐度峰值出現在秋季, 且顯著高于其他季節(P<0.01)。
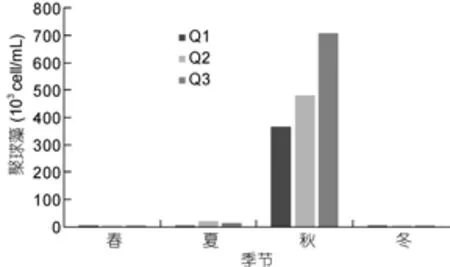
圖2 扇貝養殖區聚球藻豐度變化Fig.2 The abundance of Synechococcus in scallop cultivation area
非養殖區6個站位聚球藻豐度季節變化一致(圖3), 渤海內非養殖區聚球藻豐度在1.24×103—6.25×105cell/mL之間, 平均值為(1.35±0.67)×105cell/mL(n=12); 北黃海非養殖區聚球藻豐度在1.59×103—4.25×105cell/mL之間, 平均值為(0.92±0.43)×105cell/mL(n=12)。非養殖區聚球藻豐度峰值出現在夏季, 且顯著高于其他季節(P<0.01)。與養殖區聚球藻4季豐度變化對比, 發現養殖區與非養殖區在夏、秋季的聚球藻豐度存在顯著的差異(P<0.01)。
3.2 微微型真核浮游藻類豐度的分布
養殖區3個站位微微型真核浮游藻類豐度季節變化一致(圖4), 微微型真核浮游藻類豐度在5.80×102—3.23×105cell/mL之間, 平均值為(3.06±1.27)×104cell/mL (n=24)。微微型真核浮游藻類豐度峰值出現在夏季, 且顯著高于其他季節(P<0.01)。
非養殖區6個站位微微型真核浮游藻類豐度季節變化一致(圖5), 渤海內非養殖區微微型真核浮游藻類豐度在1.88×103—7.63×104cell/mL之間, 平均值為(2.64±0.68)×104cell/mL (n=12); 北黃海非養殖區微微型真核浮游藻類豐度在1.47×103—5.24×104cell/mL之間, 平均值為(2.16±0.63)×104cell/mL (n=12)。非養殖區微微型真核浮游藻類豐度在夏季顯著高于其他季節(P<0.01)。與養殖區微微型真核浮游藻類4季豐度變化對比, 發現養殖區夏季微微型真核浮游藻類豐度顯著高于非養殖區(P<0.01)。
3.3 異養細菌豐度的分布
養殖區3個站位異養細菌豐度季節變化一致(圖6), 異養細菌豐度在3.10×105—3.79×106cell/mL之間,平均值為(1.68±0.19)×106cell/mL (n=24)。異養細菌峰值出現在秋季, 且豐度在夏、秋季顯著高于春、冬季(P<0.01)。
非養殖區異養細菌豐度季節變化一致(圖7), 渤海內非養殖區異養細菌豐度在4.20×104—4.35×105cell/mL之間, 平均值為(2.81±0.50)×105cell/mL(n=12); 北黃海非養殖區異養細菌豐度在5.90×104—8.64×105cell/mL之間, 平均值為(3.45± 0.78)×105cell/mL(n=12)。非養殖區異養細菌豐度無顯著的季節變化(P>0.05)。與養殖區異養細菌4季豐度對比, 發現養殖區異養細菌豐度4季均顯著高于非養殖區(P<0.01)。
3.4 浮游病毒豐度
養殖區3個站位浮游病毒豐度季節變化一致(圖8), 浮游病毒的豐度在2.50×105—2.17×106cell/mL之間, 平均值為(1.02±0.11)×106cell/mL (n=24)。浮游病毒峰值出現在秋季, 但養殖區浮游病毒豐度無顯著的季節變化(P>0.05)。
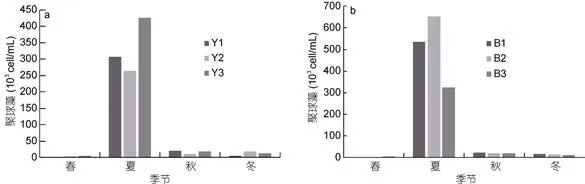
圖3 北黃海非養殖區(a)和渤海內非養殖區(b)聚球藻豐度變化Fig.3 The abundance of Synechococcus in no-cultured area(a): Bohai Sea; (b): Yellow Sea
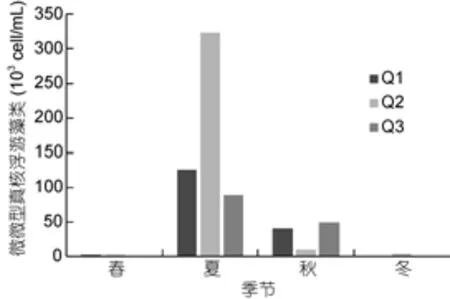
圖4 扇貝養殖區微微型真核浮游藻類豐度變化Fig.4 The abundance of Picoeukaryote in scallop cultivation area
非養殖區6個站位浮游病毒豐度季節變化一致(圖9), 渤海內非養殖區浮游病毒豐度在2.15×105—8.64×106cell/mL之間, 平均值為(3.31±0.90)×106cell/mL(n=12); 北黃海非養殖區浮游病毒豐度在1.14×105—8.74×106cell/mL之間, 平均值為(3.69±1.05)×106cell/mL (n=12)。非養殖區浮游病毒豐度在夏、秋季顯著高于春、冬季且差異顯著(P<0.01)。與養殖區浮游病毒4季豐度變化對比, 發現浮游病毒豐度在養殖區與非養殖區各季節均無顯著差異(P>0.05)。
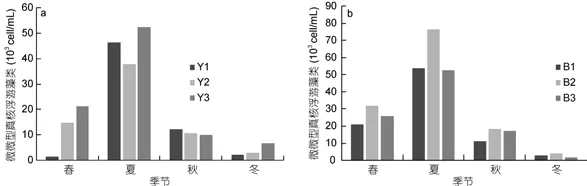
圖5 北黃海非養殖區(a)和渤海內非養殖區(b)微微型真核浮游藻類豐度變化Fig.5 The abundance of Picoeukaryote in no-cultured area(a): Yellow Sea ; (b): Bohai Sea
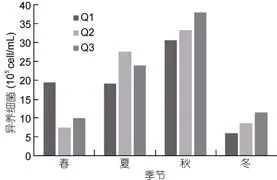
圖6 扇貝養殖區異養細菌豐度變化Fig.6 The abundance of heterotrophic bacteria in scallop cultivation area
3.5 養殖區與非養殖區環境因子的對比
對比養殖區與非養殖區的環境因子發現, 養殖區與非養殖區4季的溫度和鹽度并無顯著的差異性(P>0.05), 這可能由于養殖區與非養殖區所處的緯度相近, 因此兩者的溫度與鹽度差異并不顯著。但養殖區的營養鹽濃度顯著高于非養殖區(P<0.01), 這是由于養殖區養殖活動密集造成水體中的有機物濃度以及營養鹽濃度升高所致。
3.6 養殖區與非養殖區超微型浮游生物與環境因子主成分分析
本文運用主成分(PCA)分析對養殖區與非養殖區超微型浮游生物與環境因子進行相關性研究(圖10)。環境因子主要包括: 溫度、鹽度、以及營養鹽(硝酸鹽、亞硝酸鹽、磷酸鹽、銨鹽和活性硅酸鹽)濃度。通過PCA分析發現養殖區與非養殖區超微型生物生態環境4季均存在顯著差異。養殖區異養細菌4季均為超微型生物的主成分, 而非養殖區4季超微型生物主成分則是微微型浮游植物。超微型浮游生物與環境因子之間的相關性分析表明, 在養殖區, 聚球藻、微微型真核藻類在春、冬季與溫度呈顯著正相關, 夏、秋季聚球藻與銨鹽、硝酸鹽、磷酸鹽呈顯著正相關, 而微微型真核藻類與銨鹽、硝酸鹽、磷酸鹽呈顯著負相關;異養細菌在夏季與銨鹽、硝酸鹽、磷酸鹽呈顯著負相關, 秋季與銨鹽、硝酸鹽、磷酸鹽呈顯著正相關, 而在春、冬季無顯著相關性; 浮游病毒在春、冬季與異養細菌呈顯著正相關, 與聚球藻及溫度呈顯著負相關, 在夏季與微微型真核藻類呈顯著負相關, 在秋季與聚球藻呈顯著負相關。在非養殖區, 聚球藻和微微型真核藻類在春、冬季與溫度呈顯著正相關, 在夏、秋季與銨鹽、硝酸鹽、磷酸鹽呈顯著的負相關; 異養細菌與環境因子無顯著相關性; 浮游病毒在夏、秋季與聚球藻和微微型真核藻類顯著正相關。
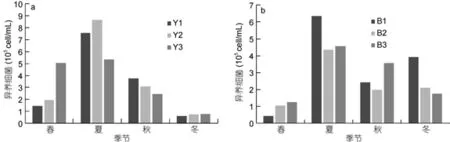
圖7 北黃海非養殖區(a)和渤海內非養殖區(b)異養細菌豐度變化Fig.7 The abundance of heterotrophic bacteria in no-cultured area(a): Yellow Sea ; (b): Bohai Sea
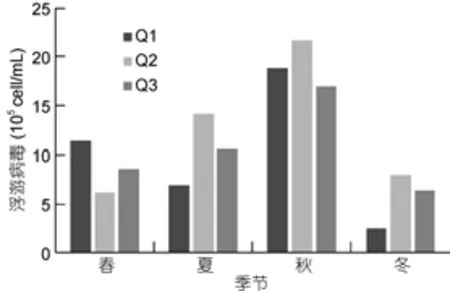
圖8 扇貝養殖區浮游病毒豐度變化Fig.8 The abundance of virioplankton in scallop cultivation area
4 討論
微微型浮游植物是海洋初級生產力的主要貢獻者(Zubkovet al, 2003), 養殖區的微微型浮游植物在夏、秋季對初級生產力的貢獻較大, 由聚球藻和微微型真核藻類組成。對聚球藻的季節分布研究發現, 養殖區聚球藻峰值出現在秋季, 而非養殖區聚球藻峰值出現在夏季。這是由于養殖區夏季微微型真核藻類暴發赤潮, 消耗了大量的營養鹽, 抑制了聚球藻的生長。隨著赤潮消退, 微微型真核藻類的抑制作用減弱,并且異養細菌分解大量有機物使得養殖區海域營養鹽濃度升高, 利于聚球藻大量繁殖, 因此, 秋季的聚球藻豐度顯著高于其他季節(P<0.01)。而非養殖區并未暴發赤潮, 聚球藻豐度在春末隨溫度的升高逐漸增加, 因此夏季豐度達到峰值。對養殖區與非養殖區聚球藻與環境因子之間的相關性研究發現, 秋季, 在養殖區聚球藻與銨鹽、硝酸鹽等營養鹽顯著正相關,而非養殖區聚球藻與營養鹽呈顯著負相關。養殖區赤潮消退后, 異養細菌通過分解有機物使得海水中各營養鹽濃度升高, 隨著營養鹽濃度升高, 聚球藻大量繁殖, 因此, 秋季聚球藻與營養鹽呈顯著正相關。相比而言, 非養殖區秋季營養鹽并未升高, 且聚球藻大量消耗營養鹽并保持較高豐度, 因此兩者呈顯著的負相關。春、冬季, 聚球藻在養殖區與非養殖區生長均主要受到溫度的限制。許多研究表明, 聚球藻對溫度的變化敏感, 適于較高的溫度, 其生長的最適溫度為17—25°C(Liet al, 1983; Olsonet al, 1990; Changet al, 1996; Heywoodet al, 2006)。本研究中, 養殖區與非養殖區春、冬季海水平均溫度為4.9°C, 遠低于聚球藻的最適生長溫度, 因此溫度成為其生長的主要限制因素。其夏、秋季海水平均溫度為20.2°C, 是聚球藻的最適生長溫度, 此時, 溫度不再是聚球藻生長的限制因素。
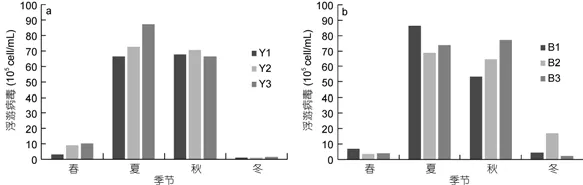
圖9 北黃海非養殖區(a)和渤海內非養殖區(b)浮游病毒豐度變化Fig.9 The abundance of virioplankton in no-cultured area(a): Yellow Sea; (b): Bohai Sea
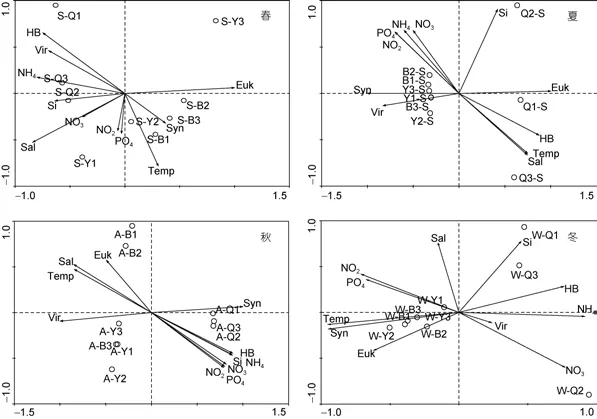
圖10 養殖區與非養殖區生物與環境因子主成分分析Fig.10 Principal components analysis of the biological and environmental factors of cultured and no-cultured area
微微型真核藻類物種組成非常復雜, 多樣性豐富, 其中存在多種赤潮藻類(焦念志, 2002)。養殖區在2012年與2013年6月間均發生赤潮, 本實驗室對微微型真核藻類豐度的檢測發現, 其豐度在夏季顯著高于其他季節(P<0.01)。Zhang等(2012)對秦皇島養殖區赤潮的研究發現, 河北省扇貝養殖區赤潮是由抑食金球藻(A. anophagefferens)引發的微微型藻類赤潮。楊紅生等(1998)認為春末夏初, 養殖區開始大量放養扇貝, 而扇貝主要攝食硅藻、綠藻等微型浮游植物, 且具有巨大的攝食力, 大范圍的養殖活動使得養殖區微型浮游植物對微微型浮游植物的競爭力減弱,因此, 養殖區微微型真核藻類中的赤潮藻暴發。然而,非養殖區微微型真核藻類與其他浮游藻類的生長保持平衡, 因此無赤潮暴發。夏、秋季, 養殖區微微型真核藻類與銨鹽、硝酸鹽、磷酸鹽等營養鹽呈顯著負相關。夏季, 微微型真核藻類大量繁殖, 消耗大量的營養鹽, 使得夏季微微型真核藻類豐度與營養鹽呈顯著負相關。赤潮消退后, 微微型真核藻類豐度急劇下降, 營養鹽濃度由于異養細菌分解大量有機物而升高, 因此, 秋季微微型真核藻類豐度與營養鹽豐度也呈顯著負相關。相對而言, 非養殖區夏、秋季微微型真核藻類與營養鹽也呈負相關, 但均是由于微微型真核藻類繁殖大量消耗營養鹽造成的。
異養細菌是海洋生態系統的分解者和二次生產者, 對海洋生態系統中物質循環、能量流動以及微食物環都十分重要。對比養殖區與非養殖區異養細菌豐度的分布發現, 養殖區異養細菌豐度4季均顯著高于非養殖區(P<0.01)。這是由于養殖活動使得養殖區海水中的有機物以及營養鹽濃度顯著高于非養殖區,為異養細菌的生長繁殖提供了更有利的環境。對異養細菌的季節分布研究發現, 養殖區異養細菌在夏、秋季顯著高于春、冬季(P<0.01), 而非養殖區異養細菌4季無顯著差異(P>0.05)。由于養殖區的養殖活動主要集中在夏、秋兩季, 此時海域有機物濃度顯著高于春、冬季, 因此養殖區異養細菌豐度在夏、秋季顯著高于春、冬季(P<0.01), 這與其他學者的研究結果一致(吳建平等, 2006; 馬繼波等, 2007)。然而, 在非養殖區有機物濃度的季節變化不顯著, 使得異養細菌豐度4季均無顯著差異。由異養細菌與環境因子的相關性分析可知, 養殖區異養細菌與營養鹽在夏季呈現顯著負相關, 在秋季呈現顯著正相關, 然而非養殖區異養細菌與營養鹽4季均無顯著相關性。夏季, 養殖區發生赤潮, 營養鹽被大量消耗, 但異養細菌豐度較高, 因此, 異養細菌豐度與營養鹽濃度呈現出負相關。隨著赤潮的消退, 異養細菌分解有機物產生大量的營養鹽, 使得營養鹽濃度升高, 因此, 在秋季異養細菌豐度與營養鹽濃度呈現出顯著正相關。相比而言,異養細菌與營養鹽濃度4季均無顯著相關性。
浮游病毒是懸浮在水體中各類病毒的總稱, 主要為噬菌體和藻類病毒, 對海洋生態系統中營養物質的流動以及生物群落的調控都起到重要的作用(Thingstad, 2000)。對養殖區浮游病毒季節分布的研究發現, 浮游病毒峰值出現在秋季。養殖區夏季微微型真核藻類暴發赤潮, 在赤潮后期浮游病毒通過裂解赤潮藻使得豐度升高, 并在秋季達到峰值。通過浮游病毒與宿主的相關性研究發現, 養殖區春、冬季浮游病毒豐度與異養細菌豐度呈顯著的正相關。由養殖區主成分分析可知, 春、冬季異養細菌是養殖區超微型浮游生物的第一主成分, 此時浮游病毒的主要宿主是異養細菌。相比發現, 非養殖區春、冬季浮游病毒與主要宿主之間均無顯著相關性。夏季, 養殖區浮游病毒與微微型真核藻類呈顯著負相關。夏季, 養殖區微微型真核藻類發生赤潮, 使得微微型真核藻類成為養殖區第一主成分, 由于浮游病毒對微微型真核藻類的裂解作用, 使得赤潮后期微微型真核藻類豐度急劇下降, 浮游病毒豐度上升, 因此兩者呈現顯著負相關。秋季養殖區浮游病毒豐度與聚球藻豐度呈顯著負相關。養殖區赤潮消退后, 聚球藻大量繁殖成為養殖區第一主成分, 在海水中的密度增高, 與噬藻體接觸的機率增大, 成為浮游病毒的主要宿主。浮游病毒通過裂解作用控制聚球藻豐度, 因此兩者呈現出顯著的負相關性。綜上可知, 浮游病毒對養殖區的群落結構調控起到重要的作用。相比而言, 非養殖區浮游病毒與微微型真核藻類、聚球藻在夏、秋季均呈顯著正相關, 浮游病毒的豐度隨著宿主豐度升高而升高。
養殖區與非養殖區不僅在4類超微型浮游生物豐度分布之間存在顯著差異, 其4季超微型浮游生物主成分也存在顯著差異, 異養細菌在養殖區4季均為超微型浮游生物的主成分, 而非養殖區超微型浮游生物的主成分是微微型浮游植物, 表明養殖活動顯著影響了養殖區超微型浮游生物的群落結構和功能。由于海水養殖產生的殘餌碎屑、養殖生物的排泄物以及分泌物的影響, 使得養殖區海域顆粒有機物濃度升高, 異養細菌分解顆粒有機物形成溶解有機物, 并利用溶解有機物進行繁殖, 導致異養細菌豐度升高;伴隨著細菌生物量的增長, 海水中的大量溶解有機碳通過異養細菌轉換為顆粒有機碳, 進入微食物環,再通過原生動物對異養細菌的捕食, 進入經典食物鏈, 因此, 異養細菌所主導的微食物環是養殖區重要的物質和能量流動的渠道之一。對比發現, 非養殖區超微型浮游生物的主成分是微微型浮游植物, 由其參與的經典食物鏈在物質和能量流動中可能起到更主要的作用。本文認為異養細菌增多, 可能是自然環境產生的一種代償和修復機制, 在一定的范圍內, 維持生態系統的平衡。然而, 當環境產生的有機物超出異養細菌所能分解的能力時, 生態平衡將被打破, 發生赤潮等環境惡化問題。
于佐安, 李文姬, 張 明, 李華琳, 劉項峰, 李大成, 2011. 大連市長海縣蝦夷扇貝養殖海區浮游病毒的豐度. 水產學報, 35(6): 911—916
馬繼波, 董巧香, 黃長江, 2007. 粵東大規模海水增養殖區柘林灣浮游細菌的時空分布. 生態學報, 27(2): 478—482
王文強, 韋獻革, 溫琰茂, 2006. 啞鈴灣網箱養殖對表層沉積物的污染. 熱帶海洋學報, 25(1): 57—60
劉文華, 葉德贊, 倪純治等, 1996. 廈門潯江灣牡蠣養殖區弧菌研究. 臺灣海峽, 15(4): 413—416
張玉宇, 呂頌輝, 齊雨藻, 2008. 2003—2004年大亞灣澳頭養殖區水域浮游植物群落結構及數量變動特征. 海洋環境科學, 27(2): 132—134
吳建平, 蔡創華, 周毅頻, 吳灶和, 2006. 大亞灣網箱養殖區異養細菌和弧菌的數量動態. 湛江海洋大學學報, 26(3):22—25
陳碧鵑, 陳聚法, 崔 毅, 李秋芬, 2001. 萊州灣東部養殖區浮游植物的生態特征. 海洋水產研究, 22(3): 65—69
楊紅生, 周 毅, 1998. 濾食性扇貝對養殖海區環境的研究進展. 海洋科學, (2): 42—44
焦念志, 2002. 海洋微型生物生態學. 北京: 科學出版社, 129—131
Chang J, Chung C C, Gong G C, 1996. Influences of cyclones on chloropgyllaconcentration and Synechococcus abundance in a subtropical western Pacific coastal ecosystem. Marine Ecology Progress Series, 140: 199—205
Heywood J L, Zubkov M V, Tarran G Aet al, 2006.Prokaryoplankton standing stocks in oligotrophic gyre and equatorial provinces of the Atlantic Ocean: evaluation of inter-annual variability. Deep-Sea Research Part II: Topical Studies in Oceanography, 53(14—16): 1530—1547
Zhang Q C, Qiu L M, Yu R Cet al, 2012. Emergence of brown tides caused byAureococcus anophagefferensHargraves et Sieburth in China. Harmful Algae, 19: 117—124
Li W K W, Subba E D V, Harrison W Get al, 1983. Autotrophic picoplankton in the tropical ocean. Science, 219: 292—295
Olson R J, Chisholm S W, Zettler E Ret al, 1990. Spatial and temporal distributions of prochlorophyte picoplankton in the North Atlantic Ocean. Deep-Sea Research I, 37(6):1033—1051
Thingstad T F, 2000. Elements of a theory for the mechanisms controlling abundance, diversity, and biogeochemical role of lytic bacterial viruses in aquatic systems. Limnol Oceanogr,45(6): 1320—1328
Zubkov M V, Fuchs B M, Tarran G Aet al, 2003. High rate of uptake of organic nitrogen compounds by Prochlorococcus cyanbacteria as a key to their dominance in oligotrophic oceanic waters. Applied and Environmental Microbiology,69: 1299—1304
- 海洋與湖沼的其它文章
- 大菱鲆(Scophthalmus maximus)、星斑川鰈(Platichthys stellatus)及其雜交種的形態學分析*
- 半滑舌鰨(Cynoglossus semilaevis Günther)生長激素體外重組表達及活性分析*
- 香港牡蠣(Crassostrea hongkongensis)與長牡蠣(Crassostrea gigas)種間雜種遺傳力評估*
- 三疣梭子蟹(Portunus trituberculatus)胞內氯離子通道蛋白基因克隆及其表達分析*
- 褪黑激素對香港細首紐蟲(Cephalothrix hongkongiensis)性腺發育的影響及羥基吲哚-O-甲基轉移酶(HIOMT)的測定*
- 飼養空間大小對單體筐養養殖系統中三疣梭子蟹(Portunus trituberculatus)的攝食行為與生長特性的影響研究*

