褪黑激素對香港細首紐蟲(Cephalothrix hongkongiensis)性腺發育的影響及羥基吲哚-O-甲基轉移酶(HIOMT)的測定*
李應東 孫世春
(中國海洋大學海洋生物多樣性與進化研究所 青島 266003)
褪黑激素(melatonin)是在生物進化過程中非常保守的一類激素, 廣泛存在于藻類、無脊椎動物和脊椎動物體內(Vivien-Roelset al, 1984; Hardelandet al,1996; 李經才等, 2000)。自1958年首次在牛的松果體中發現以來(Lerneret al, 1958), 它的分泌、合成以及生理功能一直是學者們研究的熱點。
在水生無脊椎動物中, 前人的工作先后在甲殼動物、軟體動物、扁形動物、腔腸動物和紐形動物等檢測到褪黑激素的存在(Vivien-Roelset al, 1986; Moritaet al, 1987; Anctilet al, 1991; Arnoultet al, 1994)。褪黑激素被認為是調節水生無脊椎動物生長、發育和繁殖的關鍵激素(Vivien-Roelset al, 1993; Mechawaret al,1997)。其主要作用包括清除自由基、調節生理節律和免疫等(Hardelandet al, 2003; Galanoet al, 2011)。
紐形動物褪黑激素的相關研究開始較晚, 僅有的少量工作都是由Arnoult等圍繞Ramphogordius lacteus開展的。研究發現,R. lacteus體內的褪黑激素含量會隨著繁殖周期和晝夜節律而改變, 其濃度在性腺成熟期低于休止期, 在白天低于夜間(Arnoultet al,1994); 外源的褪黑激素會影響R. lacteus性腺發育以及組織再生速度(Arnoultet al, 1995, 1996); 褪黑激素的主要合成酶之一羥基吲哚-O-甲基轉移酶(HIOMT)位于R. lacteus腦神經節內(Arnoultet al, 2001)。
本文通過測定香港細首紐蟲(Cephalothrix hongkongiensisSundberget al.)的性腺(精巢, 卵巢)和卵母細胞大小的變化, 研究了手術(去頭)和褪黑激素對其性腺發育的影響, 并通過Western bolt和免疫組織化學方法對香港細首紐蟲頭部的HIOMT進行了測定和定位。
1 材料與方法
1.1 實驗動物
實驗所用的香港細首紐蟲均采自青島太平角潮間帶石下或粗砂中, 在實驗室暫養兩周后開始實驗。暫養期間每4—5天投喂淡水寡毛類1次, 投喂5h后換全量水, 海水鹽度31, 溫度20°C。實驗開始前5天停止投喂。去頭實驗(1.2)和褪黑激素毒性實驗(1.3)所用紐蟲采于2012年9月上旬, 體重為(16.7±3.4)mg(11.4—19.7mg)。褪黑激素對性腺發育影響實驗(1.3)及HIOMT測定和定位實驗(1.4和1.5)所用紐蟲采于2012年10月上旬, 體重為(15.8±4.1)mg (10.8—17.9mg)。
1.2 去頭對性腺發育的影響
處理組紐蟲用7.5%的MgCl2麻醉后, 將紐蟲頭部(口前)切除。對照組使用正常紐蟲。實驗容器為15cm培養皿, 每個培養皿隨機放入5條紐蟲, 設置12個平行。用恒溫光照培養箱控制實驗條件(溫度20°C, 鹽度31, 光照周期12D : 12L)。實驗開始前隨機抽取20條蟲體固定, 實驗開始20天后第1次取樣,之后每隔5天取樣1次, 每次每個培養皿取1條紐蟲固定, 備做組織學研究。實驗過程中, 每隔5天換水1次, 不投餌。
用于石蠟切片的紐蟲用7.5% MgCl2麻醉后于身體中后部取5—10mm長的片段, Bouin’s液固定。梯度酒精脫水, 二甲苯透明, 石蠟包埋、切片(厚度8μm)。常規H.E染色。Nikon Eclipse E600顯微鏡觀察,Olympus DP72數碼成像系統拍照, CellSens stardard軟件測量性腺/卵子的長徑(a)和短徑(b)。并用下列公式估算標準化直徑: 標準化直徑每個樣品測量6組數據, 取最大值用于后續數據分析(即以最大數據表示樣品的性腺發育水平)。
1.3 褪黑激素對成活率及性腺發育的影響
參照其他學者對渦蟲(Yoshizawaet al, 1991)和紐蟲(Arnoultet al, 1996)的研究, 選取6個濃度的褪黑激素(25, 50, 75, 100, 150和200mg/L)及1個空白(0mg/L)對照, 首先對香港細首紐蟲進行毒性實驗, 旨在找到其耐受濃度。用恒溫光照培養箱控制實驗條件(溫度20°C, 鹽度31, 光照周期12D : 12L)。實驗容器為15cm培養皿, 每個培養皿放入褪黑激素海水溶液100mL。每個濃度3個平行, 每個平行10條紐蟲。實驗共進行60天, 實驗過程中不投餌, 每5天全量更換試液。
參考毒性試驗的結果, 選取3個濃度(25, 50和75 mg/L)的褪黑激素及1個對照(0mg/L)對去除頭部的香港細首紐蟲進行試驗, 檢測外源褪黑激素對性腺發育的影響。每個濃度6個平行。實驗容器同上, 每個培養皿放試液100mL, 10條紐蟲。實驗過程中不投餌, 每5天全量更換試液。實驗開始前對實驗紐蟲隨機抽取20條固定, 實驗開始后第1次取樣在培養20天后, 之后每隔10天取樣1次, 每次每個培養皿隨機抽取2條紐蟲固定, 進行組織學研究。組織學研究方法同1.2。
1.4 羥基吲哚-O-甲基轉移酶(HIOMT)的Western blot測定
取10條紐蟲, 迅速割取頭部(口前部分), 0.01mol/L的PBST洗3次, 每次5min。之后冰盒上勻漿, 4°C離心。取100μL上清液沸水浴10min, 加入上樣緩沖液進行12% SDS-PAGE電泳。蛋白質轉膜。BSA 4°C孵育膜過夜。一抗使用BSA稀釋500倍的兔抗小鼠ASMTY/HIOMT(Abcam公司), 4°C孵育過夜。PBST洗3次, 每次5min。二抗使用PBST稀釋2000倍的辣根過氧化物酶標記山羊抗兔IgG, 37°C孵育2h。PBST洗3次, 每次5min, DAB顯色。
1.5 羥基吲哚-O-甲基轉移酶(HIOMT)的免疫組織化學定位
選取活躍的紐蟲, MgCl2麻醉后割取頭部(口前部分), 4%多聚甲醛固定。梯度酒精脫水, 二甲苯透明,石蠟包埋、切片(厚度5μm), 甘油蛋白粘片。經二甲苯脫蠟、梯度酒精復水后, 0.01mol/L的PBST洗3次,每次5min。3% H2O2-PBS孵育10min。PBST洗3次,每次5min, 10%山羊血清室溫封閉2h。一抗使用10%山羊血清稀釋400倍的兔抗小鼠ASMTY/HIOMT(Abcam公司), 4°C孵育24h后再室溫孵育1h。PBST洗3次, 每次5min。二抗使用PBST稀釋2000倍的辣根過氧化物酶標記山羊抗兔IgG, 37°C孵育2h。PBST洗3次, 每次5min, DAB顯色。
1.6 數據分析
數據使用SPSS 19.0軟件進行單因素方差分析(One-Way ANOVA)和Duncan多重比較。顯著性水平用P<0.05表示。
2 實驗結果
2.1 手術(去頭)對性腺發育的影響
見圖1。在實驗開始時, 性腺均未發育。培養20天后, 去頭個體性腺已經發育, 精巢、卵巢和卵母細胞的平均直徑分別為(85.0±43.8) μm、(121.4±25.7) μm和(57.4±9.5) μm; 30天時, 精巢、卵巢的大小及配子成熟度均高于20天, 卵母細胞的平均直徑在80μm左右;40天時, 卵細胞成熟, 平均直徑接近100μm, 并且精巢中有大量成熟精子。對照組個體在整個實驗過程中未見性腺發育。
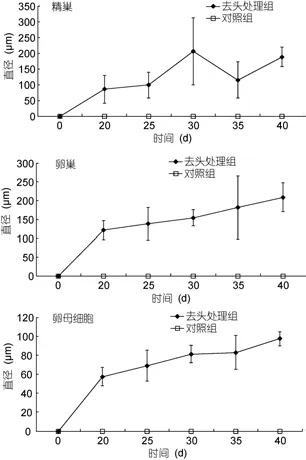
圖1 去除頭部對香港細首紐蟲性腺發育的影響——精巢、卵巢和卵母細胞的標準化直徑(平均值±標準差; n=12)Fig.1 The effect of decapitation on gonad development of C.hongkongiensis. Data are presented as standardized diameters of testes, ovaries, and oocytes (mean±SD; n=12)
2.2 褪黑激素對成活率和性腺發育的影響
不同濃度的褪黑激素對香港細首紐蟲成活率的影響見圖2。結果表明, 隨著褪黑激素濃度的上升, 紐蟲出現活性變差、不攝食、斷尾、吐吻、對外界刺激無反應和死亡率高等現象。濃度大于75mg/L的褪黑激素對香港細首紐蟲有較高的致死率。在濃度為200、150和100mg/L條件下, 香港細首紐蟲分別在15天、20天和25天內全部死亡。在75mg/L濃度下, 60天內全部死亡; 50mg/L條件下60天后存活率約為70%。25mg/L濃度對紐蟲的成活率無影響。實驗期間, 對照組紐蟲的存活率為100%, 也未見異常行為。
褪黑激素對香港細首紐蟲性腺發育具有顯著的抑制作用(圖3)(P<0.05), 并且隨褪黑激素濃度的增加,抑制作用增強。在實驗開始時, 性腺未發育。培養20天后, 受試紐蟲性腺均已發育, 但褪黑激素組紐蟲的性腺和卵母細胞大小均顯著小于對照組(P<0.05)。第30、40天時, 各個處理組的性腺(精巢、卵巢)和卵母細胞的大小均表現為75mg/L組<50mg/L組<25mg/L組<0mg/L組。其中, 第40天時, 75mg/L組的性腺已退化消失。
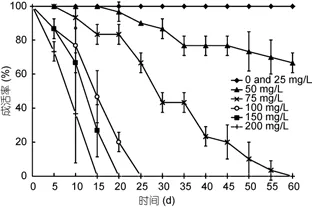
圖2 不同濃度褪黑激素對香港細首紐蟲成活率的影響(平均值±標準差; n=3)Fig.2 Survival rate of C. hongkongiensis under melatonin solutions of different concentrations (mean±SD; n=3)
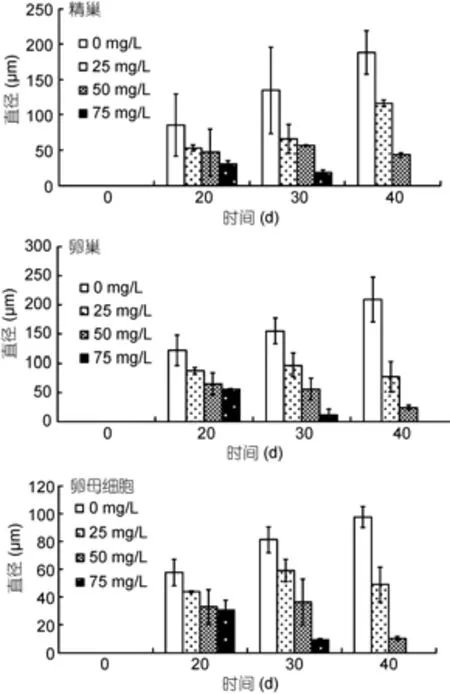
圖3 不同濃度褪黑激素對香港細首紐蟲性腺發育的影響——精巢、卵巢及卵母細胞的標準化直徑(平均值±標準差; n=12)Fig.3 Impact of melatonin on gonad development of C.hongkongiensis. Data are presented as standardized diameters of testes, ovaries, and oocytes (mean±SD; n=12)
2.3 HIOMT的測定和定位
香港細首紐蟲頭部蛋白與兔抗小鼠HIOMT抗體Western blot免疫印跡實驗顯示, 在約38kDa處有明顯的陽性條帶(圖4)。說明香港細首紐蟲的頭部存在HIOMT。由圖5可以看出, HIOMT親和免疫定位發生在腦神經節內側的幾個神經細胞中, 呈對稱分布。對照組無陽性反應。

圖4 香港細首紐蟲頭部HIOMT的Western blot檢測Fig.4 Western blot for HIOMT of the cephalic region of C.hongkongiensis
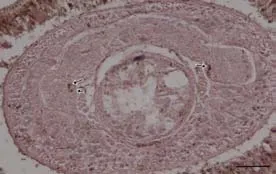
圖5 香港細首紐蟲腦部HIOMT的免疫組織化學定位Fig.5 Immunocytochemistry of HIOMT in the cerebral ganglia of C. hongkongiensis
3 討論
大多數水生無脊椎動物會通過神經系統來對生長、發育和繁殖進行調節(Golding, 1974; Hartenstein,2006)。去除其主要的神經激素中心, 會使生長和繁殖受到影響。如切除甲殼動物的眼柄, 會使其性腺發育速度加快(Primavera, 1978); 去除渦蟲的頭部會使其斷裂再生速度加快(Moritaet al, 1984)。對紐蟲的研究也發現, 手術去除Ramphogordius lacteus的腦部會使其性腺發育速度加快(Gontcharoffet al, 1958)。Vernet等(1988)認為紐蟲腦神經中樞分泌的性腺發育抑制激素(GIH)是控制其性腺發育的主要激素, 去除這種激素會使紐蟲的性腺迅速發育。去頭術可迅速誘導香港細首紐蟲的性腺發育, 表明香港細首紐蟲的頭部也存在GIH或類似物抑制其性腺發育。一些學者們推測, 紐蟲GIH分泌可能受褪黑激素的直接或間接調節(Vernetet al, 1993; Arnoultet al, 1994,2001)。
自Vivien-Roels等(1984)在昆蟲的復眼中發現褪黑激素以來, 已在多種無脊椎動物體內檢測到褪黑激素(Vivien-Roelset al, 1993; Roopinet al, 2012)。在對紐形動物的研究中, Arnoult等(2001)應用放射免疫法在異紐目紐蟲R. lacteus的腦和眼點中檢測到褪黑激素的存在, 且其含量存在晝夜變化, 說明該激素的合成可能受光的調控(Arnoultet al, 1994)。本文通過Western blot方法在香港細首紐蟲的頭部組織檢測到了褪黑激素合成酶HIOMT[褪黑激素合成的一種特異性標記(Arnoultet al, 2001)] (圖4), 免疫組化結果顯示其分布于腦神經節的少數幾個細胞(圖5), 說明香港細首紐蟲的中樞神經也具有合成褪黑激素的功能。Arnoult等(2001)認為紐蟲腦神經節中的這些細胞可能與脊椎動物松果體、視網膜中的光受體細胞類似。
雖然很多研究指出褪黑激素具有抗衰老、延長壽命的功能(Bakaevet al, 1997), 但外源褪黑激素對無脊椎動物的作用因濃度和物種而不同。過高的環境褪黑激素濃度可能具有毒性效應, 如: 當褪黑激素濃度超過100mg/L時, 線蟲Caenorhabditis elegans的壽命變短(Bakaevet al, 1997); 超過10mg/L時草履蟲Paramecium tertaurelia的壽命變短(Thomaset al,1997); 當褪黑激素濃度達到50mg/L時, 已研究的兩種紐蟲R. lacteus(Arnoultet al, 2001)和香港細首紐蟲(圖2)均出現死亡率上升、壽命變短現象。一些學者認為, 褪黑激素的抗衰老效果可能與其在細胞內清除自由基的能力有關(Anisimov, 2003)。然而, 在高濃度條件下, 褪黑激素可能成為助氧化劑(prooxidant), 進而影響動物的壽命(Anisimov, 2003; 張軍等, 2008)。
外源褪黑激素不但會影響紐蟲的壽命, 還會參與調節其它生理過程的節律, 如再生和繁殖(Arnoultet al, 1995, 1996)。對R. lacteus的研究顯示, 其體內褪黑激素含量在繁殖期顯著低于靜止期, 外源褪黑激素可延遲性成熟(Arnoultet al, 1994)。本文實驗中,外源褪黑激素沒有阻斷去頭對香港細首紐蟲性腺發育的誘導作用, 但明顯抑制了其性腺發育速度, 且長期暴露還導致了已發育的性腺退化(圖3)。這與Arnoult等(1996)的研究結果相似, 他們認為, 褪黑激素對性腺發育的抑制作用是間接的, 即通過影響GIH的分泌而影響性腺發育。
李經才, 王 芳, 霍 艷等, 2000. 從生物進化看褪黑素的功能意義. 生命科學, 12: 130—133
張 軍, 胡大海, 2008. 褪黑激素抗氧化作用的研究進展. 國際藥學研究雜志, 35: 189—192
Anctil M, Pani A K, Ali M A, 1991. Modulation of rhythmic contractions by melatonin via cyclic GMP in the coelenterateRenilla koellikeri. Journal of Comparative Physiology B, 161: 569—575
Anisimov V N, 2003. Effects of exogenous melatonin——a review. Toxicologic Pathology, 31: 589—603
Arnoult F, Vernet G, 1995. Inhibition of regeneration by melatonin in nemertean worms of the genusLineus.Comparative Biochemistry and Physiology Part A:Physiology, 110: 319—328
Arnoult F, Vernet G, 1996. Influence of melatonin on gonad maturation inLineus lacteus(Heteronemertini, Lineidae).Journal of Experimental Zoology, 274: 138—143
Arnoult F, Vernet G, 2001. Immunocytochemical localization of hydroxyindole-o-methyltransferase (HIOMT) in the brain ofMyoisophagos lacteus(Nemertea: Heteronemertea:Lineidae). Journal of Experimental Zoology, 290: 156—162
Arnoult F, Vivien-Roels B, Pévet Pet al, 1994. Melatonin in the nemertine wormLineus lacteus: identification and daily variations. Neurosignals, 3: 296—301
Bakaev V V, Efremov A V, Anisimov V N, 1997. An attempt to slow aging inC. elegans. 8. Melatonin reduces life span ofC.elegans. Worm Breeder's Gazette, 15: 36
Galano A, Tan D X, Reiter R J, 2011. Melatonin as a natural ally against oxidative stress: a physicochemical examination.Journal of Pineal Research, 51: 1—16
Golding D W, 1974. A survey of neuroendocrine phenomena in non-arthropod invertebrates. Biological Reviews, 49: 161—224
Gontcharoff M, Lechenault H, 1958. Sur le déterminisme de la ponte chezLineus lacteus. Comptes rendus hebdomadaires des séances de l'Académie des Sciences, 246: 1630—1632
Hardeland R, Fuhrberg B, 1996. Ubiquitous melatonin-presence and effects in unicells, plants and animals. Trends in Comparative Biochemistry and Physiology, 2: 25—45
Hardeland R, Poeggeler B, 2003. Non-vertebrate melatonin.Journal of Pineal Research, 34: 233—241
Hartenstein V, 2006. The neuroendocrine system of invertebrates:a developmental and evolutionary perspective. Journal of Endocrinology, 190: 555—570
Lerner A B, Case J D, Takahashi Yet al, 1958. Isolation of melatonin, the pineal gland factor that lightens melanocytes.Journal of the American Chemical Society, 80: 2587—2587
Mechawar N, Anctil M, 1997. Melatonin in a primitive metazoan:seasonal changes of levels and immunohistochemical visualization in neurons. The Journal of Comparative Neurology, 387: 243—254
Morita M, Best J B, 1984. Effects of photoperiods and melatonin on planarian asexual reproduction. Journal of Experimental Zoology, 231: 273—282
Morita M, Hall F, Best J Bet al, 1987. Photoperiodic modulation of cephalic melatonin in planarians. Journal of Experimental Zoology, 241: 383—388
Primavera J H, 1978. Induced maturation and spawning in five-month-oldPenaeus monodonFabricius by eyestalk ablation. Aquaculture, 13: 355—359
Roopin M, Levy O, 2012. Temporal and histological evaluation of melatonin patterns in a ‘basal’ metazoan. Journal of Pineal Research, 53: 259—269
Thomas J N, Smith-Sonneborn J, 1997. Supplemental melatonin increases clonal lifespan in the protozoanParamecium tetraurelia. Journal of Pineal Research, 23: 123—130
Vernet G, Bierne J, 1988. Neuroendocrine control of gonadogenesis in regeneratingLineus lacteus(Heteronemertea).Hydrobiologia, 156: 53—60
Vernet G, Bierne J, 1993. The influence of light and sea water temperature on the reproductive cycle ofLineus ruber(Heteronemertea). Hydrobiologia, 266: 267—271
Vivien-Roels B, Pévet P, 1986. Is melatonin an evolutionary conservative molecule involved in the transduction of photoperiodic information in all living organisms. Journal of Pineal Research, 1: 61—68
Vivien-Roels B, Pévet P, 1993. Melatonin: presence and formation in invertebrates. Experientia, 49: 642—647
Vivien-Roels B, Pevet P, Beck Oet al, 1984. Identification of melatonin in the compound eyes of an insect, the locust(Locusta migratoria), by radioimmunoassay and gas chromatography-mass spectrometry. Neuroscience Letters,49: 153—157
Yoshizawa Y, Wakabayashi K, Shinozawa T, 1991. Inhibition of planarian regeneration by melatonin. Hydrobiologia, 227: 31—40
- 海洋與湖沼的其它文章
- 大菱鲆(Scophthalmus maximus)、星斑川鰈(Platichthys stellatus)及其雜交種的形態學分析*
- 半滑舌鰨(Cynoglossus semilaevis Günther)生長激素體外重組表達及活性分析*
- 香港牡蠣(Crassostrea hongkongensis)與長牡蠣(Crassostrea gigas)種間雜種遺傳力評估*
- 三疣梭子蟹(Portunus trituberculatus)胞內氯離子通道蛋白基因克隆及其表達分析*
- 飼養空間大小對單體筐養養殖系統中三疣梭子蟹(Portunus trituberculatus)的攝食行為與生長特性的影響研究*
- 凡納濱對蝦(Litopenaeus vannamei)Runt轉錄因子的基因克隆及其功能分析*

