象山港大黃魚(Pseudosciaena crocea)網箱養殖區及鄰近海域沉積物中異養細菌生態分布*
廖紅芳 鄭忠明① 馮 堅 朱津永 丁露露 蔣珊娜
(1. 寧波大學海洋學院 教育部應用海洋生物技術重點實驗室 寧波 315211; 2. 舟山市普陀區海洋與漁業局 舟山 316100)
近幾年, 隨著海水網箱養殖業迅速發展, 養殖活動對周圍海域環境影響的問題日益凸顯。養殖過程中大量的殘餌、糞便等廢棄物沉積到沉積層, 導致沉積物有機污染并引發周圍海域水體富營養化(Karakassiset al, 2000; Grigorakiset al, 2011), 及引發養殖病害等生態環境問題(胡文佳等, 2007; Jianget al,2010)。因此, 網箱養殖區沉積環境的健康狀況逐漸受到重視。
20世紀70年代初, 人們就開始尋找評估沉積物質量的方法。目前已經發展出多種方法來評估沉積環境的健康狀況。細菌由于敏感性強(Gilleret al, 1998)能對周圍環境的早期變化做出迅速的反應, 且有很多分類群, 對不同的環境污染有不同的反應(Elliset al, 2001), 已成為評價沉積環境健康狀況的重要的指示生物。然而, 底泥細菌種類豐富, 細菌群落結構與周圍環境密切相關, 細菌作為指示生物的模式尚未成熟, 仍處在探索階段。Tamminen等(2011)比較研究了地中海四種不同規模類型的漁場, 發現不同規模的漁場沉積物中微生物群落結構顯著不同, 淺水中型水產養殖比開放水域養殖對沉積物細菌群落結構影響更大。Fodelianakis等(2014)認為養殖活動會改變底泥細菌群落結構, 群落結構的差異和該點與漁場的距離有關。
象山港是重要的水產養殖基地, 為半封閉型港灣,水體交換能力弱, 粉砂質黏土。大黃魚(Pseudosciaena crocea)是我國重要的經濟魚類, 近幾年養殖業取得了較好的經濟效益, 但與此同時, 由于養殖密度過高、餌料投喂不合理等因素, 加重了養殖環境尤其是沉積環境的負擔。有關近海養殖活動對沉積物中細菌的影響國內外已有一些報道, 如: Vezzulli等(2002)調查了利古里亞海(地中海北部的一個海域)一個建成的漁場表層底泥細菌群落結構與有機物的關系, 指出細菌群落的變動可以作為評估有機污染的工具。Bissett等(2007)對塔斯馬尼亞鮭魚養殖區及周圍鄰近區域沉積物中的細菌豐度、多樣性等進行了研究。國內有關報道相對較少, 關于大黃魚養殖對周圍環境的影響更為缺乏。本文調查了象山港大黃魚養殖區及鄰近海域沉積物中有機物含量和細菌生態分布特征,并與其它養殖區進行比較, 同時探討了細菌生態分布與沉積物有機物含量的關系。為近海養殖沉積環境質量監測及近海生態環境保護提供基礎理論依據。
1 材料與方法
1.1 樣品采集
采樣區位于象山西瀘港生態養殖基地, 共三個采樣點, 即大黃魚網箱養殖區(FS)、距離大黃魚網箱養殖區50m(C1)及100m(C2)。于大黃魚養殖投餌期(2013年8月)及越冬期(2013年11月)用無擾動沉積物采樣器(王友紹等, 2004)采集底泥, 每個點取3個以上重復樣。現場將底泥按原位分割為0—5cm、5—10cm層, 分裝到已滅菌的自封袋中, 然后放到冰盒中冷凍保存。用采水器采集水樣。用YSI Proplus型多參數測量儀現場測定水溫及水中溶解氧。樣品采好后1h內帶回實驗室。
1.2 理化因子的測定
1.3 菌株分離計數與純化
沉積物樣品帶回實驗室后, 立即培養。將10.0g左右的樣品放入盛有90mL無菌海水的錐形瓶中, 180 r/min振蕩30 min。靜置后取上清液, 按十倍稀釋法稀釋成10–1、10–2、10–3, 接種至營養瓊脂培養基(配培養基所用的水按陳海水︰蒸餾水1︰1配制)及TCBs培養基上。每個稀釋度接三個平板。待平板上長出明顯的菌落后計數。在營養瓊脂培養基平板上, 每個樣品隨機挑取20個左右的菌株分離純化直至得到純菌。
1.4 16S rDNA基因擴增及鑒定
選取純培養菌株, 用水煮法提取細菌DNA, 然后進行PCR擴增。擴增引物為細菌16S通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-TACGGTTACCTTGTTAC GACTT-3′)。PCR反應條件為94°C預變性2min, 94°C變性30s, 58°C退火30s,72°C延伸1min, 循環31次。72°C終延伸2min。PCR產物電泳檢測結果后, 送至英濰捷基(上海)貿易有限公司純化并進行DNA序列測定。
1.5 數據分析
用Shannon-Wiener多樣性指數(H’)(Hillet al,2003)衡量細菌的多樣性, 計算公式為:
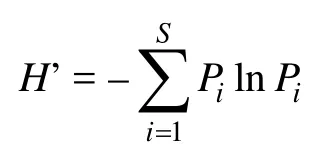
式中,Pi為第i屬細菌在群落中的相對豐度,S為群落中所含有的細菌屬數。
采用SPSS(17.0)進行統計分析, 沉積物中TON、TOC及TP含量先進行單因素方差分析, 然后用Duncan法進行多重比較。方差分析時, 部分數據先進行數據轉換(百分比數據: TOC和TON含量采用反正弦轉換, 細菌數量采用對數轉換), 然后再進行統計分析。采用斯皮爾曼等級相關法分析異養細菌數與沉積物中氮磷有機質含量的關系。用Origin 8.0作圖。將獲得的16S rDNA序列通過Blastn進行序列比對,獲取相似度較高的菌株信息及序列。用Cluster 1.81進行多序列比對, 然后采用Mega 5.0構建系統發育樹。
2 結果與分析
2.1 理化性質
同一時期采樣點海水中營養鹽、溶解氧濃度及水溫值相差不大, 不同時期則有一定差異(表1)。養殖區沉積物(0—5cm層)中總磷、總有機氮含量在投餌期和越冬期均顯著高于對照區的, 但是總有機碳含量只在投餌期時有顯著性差異(P<0.05)(圖1a, b, c); 5—10cm層沉積物中, 越冬期養殖區沉積物中的TP、TON含量顯著高于對照區(圖1d, e), 而在投餌期只觀察到養殖區的TP含量與對照區C1有顯著性差異(P<0.05)。
2.2 沉積物中細菌數量分布
養殖區沉積物中異養細菌數量分布在1.7×105—5.2×105CFU/g之間, 對照區(C1, C2)的異養細菌數量分布在3.2×104—3.4×105CFU/g之間(圖2)。同一采樣期, 養殖區沉積物中異養細菌數量顯著高于對照區C1 (P<0.05); 除了投餌期0—5cm沉積層外, 養殖區異養細菌數量顯著高于對照區C2 (P<0.05); 隨著深度的增加, 沉積物中的異養細菌數量減少。在時間分布上, 投餌期和越冬期表層沉積物(0—5cm層)中異養細菌數量差異不大, 但是5—10cm層沉積物中, 投餌期異養細菌數量要大于越冬期。異養細菌數量與沉積物中TON、TP含量有一定的線性相關性,相關系數分別為0.515 (n=12)、0.559 (n=12), 而與沉積物中TOC含量的相關性較弱(r=0.182,n=12)。沉積物中弧菌數量分布在2.2×103—1.7×105CFU/g之間(圖3)。投餌期, 養殖區沉積物中的弧菌數量顯著高于對照區C1 (P<0.05); 越冬期, 觀察到養殖區中的弧菌數量高于對照區C1、C2, 且有顯著性差異(P<0.05)。
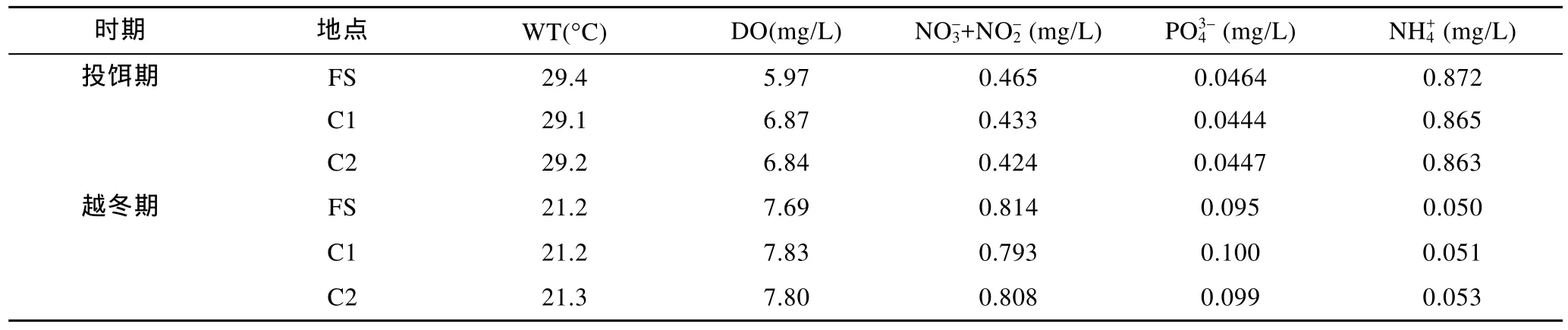
表1 養殖區(FS)及對照區(C1, C2)海水溫度(WT)、水中溶解氧(DO)、硝酸鹽+亞硝酸鹽、銨鹽濃度Tab.1 Water temperature (WT), concentrations of dissolved oxygen (DO), nitrate + nitrite, phosphorus, and ammonium in water in the fish farm (FS), the control station C1 and C2 in the feeding period (August) and wintering period (November)
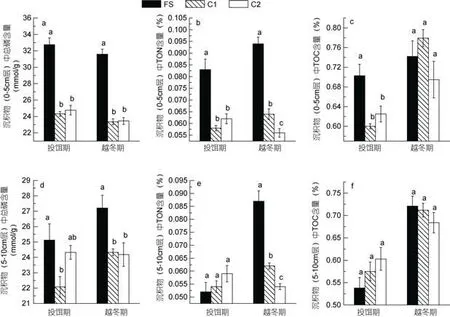
圖1 養殖區(FS)、對照區(C1, C2)在投餌期及越冬期兩個時期沉積物中總磷(TP)、總有機氮(TON)、總有機碳(TOC)含量Fig.1 The values of total phosphorous (TP), total organic nitrogen (TON) and total organic carbon (TOC) in sediment under the fish farm (FS), the control station C1 and C2 in feeding period and wintering period
2.3 異養細菌群落結構
分離純化后共得到151株細菌, 分屬于22個屬(表2)。養殖區投餌期的優勢屬為弧菌屬(占71.4%),但是越冬期芽孢桿菌屬成為了優勢屬(占38.2%), 其次為假單胞菌屬; 對照區投餌期的優勢屬為弧菌屬(占57.6%), 其次為假交替單胞菌屬, 越冬期的優勢屬為芽孢桿菌屬(占33.3%), 其次為假交替單胞菌屬、假單胞菌屬。各采樣區異養細菌的多樣性表現為養殖區小于對照區, 越冬期高于投餌期。
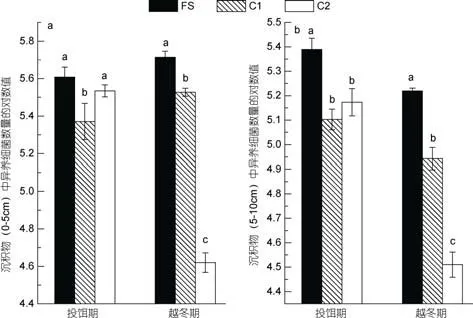
圖2 養殖區(FS)及對照區(C1, C2)沉積物中異養細菌分布圖Fig.2 Distribution of heterotrophic bacterial abundance in sediment of the farm site (FS) and control station (C1, C2)
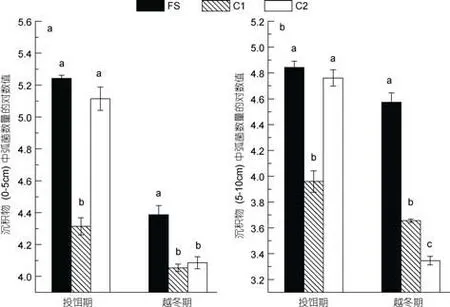
圖3 養殖區(FS)及對照區(C1, C2)沉積物中弧菌分布圖Fig.3 Distribution of Vibrio abundance in sediment in farm site (FS) and control station (C1, C2)
2.4 系統發育分析
將比對后的細菌16S rDNA序列用MEGA 5.0構建無根系統發育樹。養殖區沉積物中的異養細菌分屬于γ-變形菌綱、芽孢菌綱, 且γ-變形菌綱的種類比芽孢菌綱的種類豐富(圖4)。非養殖區沉積物細菌也有γ-變形菌綱、芽孢菌綱(圖5)。γ-變形菌綱中, 雖然養殖區和非養殖區均含有弧菌、希瓦氏菌、交替單胞菌等, 但是兩個研究區域沉積中細菌群落結構不一樣。前者分離到了耐鹽桿菌, 后者有海單胞菌、不動桿菌。對于芽孢菌綱, 除均含有芽孢桿菌等外, 養殖區還分離到了葡萄球菌, 而非養殖區中有動性球菌。在非養殖區中還分離到了屬于放線菌綱的細菌:鏈霉菌、棒狀桿菌、節細菌及考克氏菌。此外, 非養殖區中分離得到的某些細菌屬于α-變形菌綱, 如根瘤菌、副球菌。
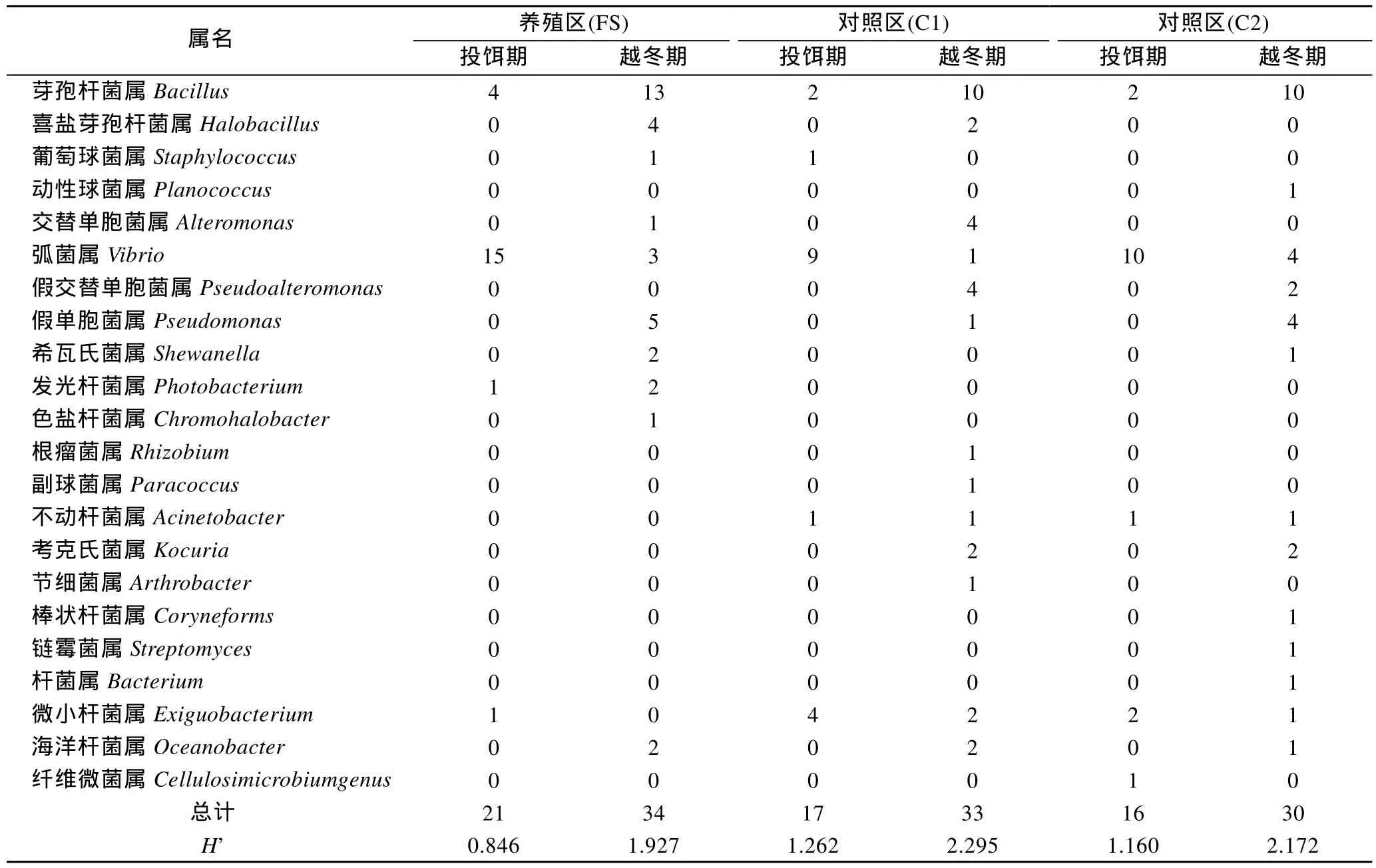
表2 養殖區(FS)、對照區(C1, C2)在投餌期(FP)及越冬期(WP)兩個時期沉積物中細菌菌群組成Tab.2 Composition of bacterial community in sediment under the fish farm (FS), the control station C1 and C2 in feeding period (FP) and wintering period (WP)

圖4 象山港大黃魚網箱養殖區沉積物中分離得到的細菌構建的系統發育樹Fig.4 Phylogenetic tree of bacteria isolated from cage culture sediment in the Xiangshan Bay
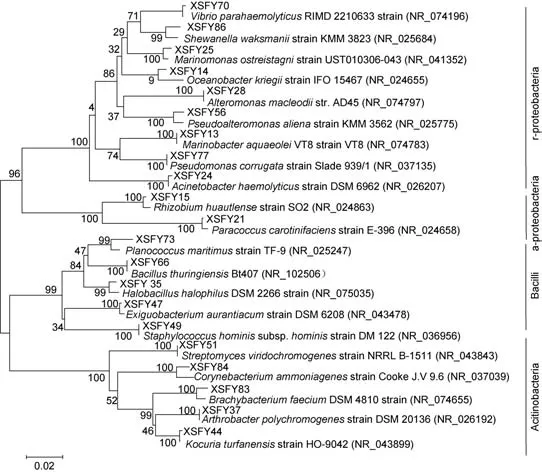
圖5 象山港大黃魚非養殖區沉積物中分離得到的細菌構建的系統發育樹Fig.5 Phylogenetic tree of bacteria isolated from sediment of non-culture area in the Xiangshan Bay
3 討論
海水養殖活動因殘餌和糞便等常會導致大量的有機物輸入到底部(Carrollet al, 2003), 使有機物在沉積物中堆積。本實驗中養殖區沉積物(0—5cm層)中總磷、總有機氮含量在投餌期和越冬期均顯著高于對照區, 表明養殖區沉積物積累了有機物。微生物是各種有機物質的分解者和轉化者, 初期有機物的增加會提高微生物的豐度, 但是大量有機物的存在導致生物分解加劇, 使沉積物中氧氣含量下降, 可能會抑制微生物的生長。本研究中, 養殖區沉積物中異養細菌數量均高于對照區的, 這可能是有機物的積累為細菌生長提供了合適的基質, 刺激細菌繁殖(Vezzulliet al, 2002)。這與Bissett等(2007)對塔斯馬尼亞鮭魚養殖區的研究結果一致。Vezzulli等(2002)對利古里亞海的金頭鯛網箱養殖區的研究也指出網箱養殖區沉積物由于有機物的積累促使異養細菌數量增加。本研究發現對照區沉積物中異養細菌數量與第勒尼安海剛建立半年的金頭鯛網箱養殖區下沉積物中異養細菌數類似(La Rosaet al, 2004), 這暗示著象山港大黃魚養殖活動對鄰近海域沉積物造成了一定的有機污染。相關性分析表明異養細菌數與沉積物中TON、TP含量呈顯著正相關(相關系數r分別為0.515, 0.559;n=12), 表明沉積物中可培養異養細菌數受有機氮含量和磷酸鹽含量的限制, 同時進一步說明了異養細菌數量與沉積環境有機污染程度密切相關。異養細菌的生長與繁殖需以有機物為原料獲得能量, 氮磷是細菌電子反應的主要基質, 這可能是異養細菌受氮鹽和磷酸鹽限制的一個重要原因。Thingstad等(2005)及Sebastián等(2012)的研究也指出沉積物中細菌數受磷酸鹽含量的限制。
細菌群落對環境的改變非常敏感, 有研究表明漁場輸入的有機物會改變沉積物中的細菌群落結構(Kawaharaet al, 2009; Fodelianakiset al, 2014), 甚至引起細菌群落結構持久性變化(Danovaroet al, 1999)。本研究中, 養殖區和對照區的異養細菌群落結構不一樣且同一地點不同時期群落結構也不同(表2), 支持了上述觀點, 即細菌群落結構對環境的改變非常敏感, 且受養殖活動的影響。養殖區沉積物中的可培養細菌絕大部分為兼性厭氧菌, 可能是因為有機物的積累使微生物大量繁殖導致氧氣迅速消耗, 在沉積物中形成亞氧化層甚至造成缺氧環境, 最終好氧細菌減少(Canfieldet al, 1993)。弧菌中的某些種類為重要的致病菌或條件致病菌, 弧菌大量增殖可能會引起養殖生物患病甚至死亡(Korsneset al, 2006)。西班牙養殖的鱸魚由于患弧菌病造成了巨大的經濟損失(Rodgerset al, 1998), 我國海南三亞網箱養殖的點石斑魚苗由于發生了弧菌病, 一周內魚苗全部死亡(陳曉燕等, 2003)。本實驗中, 投餌期的優勢屬為弧菌屬(表2)(占71.4%)且養殖區的弧菌數量顯著高于對照區C1, 這可能與有機物的大量輸入有關。有機物的富集刺激弧菌的繁殖(La Rosaet al, 2001), 導致最終弧菌密度增加。這也暗示著該養殖系統存在著患病的風險。在投餌量少甚至不投餌的越冬期, 在碳氮循環中扮演著重要角色的芽孢桿菌屬和假單胞菌屬成為優勢菌群。有小娟等(2013)及劉晶晶等(2010)對象山港養殖區沉積物的研究也表明假單胞菌屬是優勢菌群。
系統發育分析可知, 養殖區和對照區沉積物中主要為γ-變形菌綱和芽孢菌綱, Li等(2013)在秦皇島養殖區沉積物中細菌群落多樣性的測定中, 也發現γ-變形菌綱和芽孢菌綱占優勢。這表明γ-變形菌綱和芽孢菌綱適合在有機物富集的環境中生長。受漁場養殖活動影響的沉積物中α-變形桿菌數增加, 甚至成為優勢菌群(Bissettet al, 2006; Kunihiroet al,2008)。雖然本研究中對照區沉積物也發現了α-變形桿菌, 但是在養殖區并未檢測到α-變形桿菌, 可能是當有機物達到一定含量時不適合α-變形桿菌生長, 也可能是沉積物的α-變形桿菌絕大部分是不可培養的。這也反映出了可培養法的缺陷, 只能培養小部分細菌。
異養細菌群落多樣性與沉積物中有機物輸入量密切相關。養殖區沉積物異養細菌的多樣性小于對照區, 表明養殖活動可能會降低沉積物異養細菌多樣性。Luna等(2013)對地中海的四個漁場的研究結果也表明網箱養殖區沉積物中的細菌多樣性低于對照區。本研究中越冬期微生物的多樣性高于投餌期, 推測其原因為投餌期餌料投喂較多而越冬期投餌量少甚至不投餌。大量有機物輸入到沉積物中, 可能會使底質向缺氧環境轉變, 從而降低非厭氧菌群落結構的多樣性, 甚至造成毀滅性的破壞(Chivilevet al,1997)。可培養法能夠在一定程度上反映非厭氧菌群落結構多樣性的變化, 為初步鑒定有機污染情況提供有效數據。
王友紹, 徐繼榮, 2004. 一種無邊界擾動的單管沉積物采樣器.中國, 200410026847.3. 2004-04-13
有小娟, 李秋芬, 張 艷等, 2013. 象山港內西滬港海域沉積環境細菌群落結構的時空變化及其主要環境影響因子.應用與環境生物學報, 19(005): 742—749
劉晶晶, 曾江寧, 陳全震等, 2010. 象山港網箱養殖區水體和沉積物的細菌生態分布. 生態學報, 30(2): 377—388
陳曉燕, 胡超群, 陳 償等, 2003. 人工養殖點帶石斑魚弧菌病病原菌的分離及鑒定. 海洋科學, 27(6): 68—72
胡文佳, 楊圣云, 朱小明, 2007. 海水養殖對海域生態系統的影響及其生物修復. 廈門大學學報: 自然科學版, 46(A01):197—202
Bissett A, Bowman J, Burke C, 2006. Bacterial diversity in organically-enriched fish farm sediments. FEMS Microbiology Ecology, 55(1): 48—56
Bissett A, Burke C, Cook P L Met al, 2007. Bacterial community shifts in organically perturbed sediments. Environmental Microbiology, 9(1): 46—60
Canfield D E, J?rgensen B B, Fossing Het al, 1993. Pathways of organic carbon oxidation in three continental margin sediments. Marine Geology, 113(1): 27—40
Carroll M L, Cochrane S, Fieler Ret al, 2003. Organic enrichment of sediments from salmon farming in Norway:environmental factors, management practices, and monitoring techniques. Aquaculture, 226(1): 165—180
Chivilev S, Ivanov M, 1997. Response of the Arctic benthic community to excessive amounts of nontoxic organic matter.Marine Pollution Bulletin, 35(7): 280—286
Danovaro R, Pusceddu A, Harriague A Cet al, 1999. Community experiments using benthic chambers: microbial significance in highly organic enriched sediments. Chemistry and Ecology, 16(1): 7—30
Ellis R J, Neish B, Trett M Wet al, 2001. Comparison of microbial and meiofaunal community analyses for determining impact of heavy metal contamination. Journal of Microbiological Methods, 45(3): 171—185
Fodelianakis S, Papageorgiou N, Karakassis Iet al, 2014.Community structure changes in sediment bacterial communities along an organic enrichment gradient associated with fish farming. Annals of Microbiology, DOI 10.1007/s13213-014-0865-4 (online first)
Giller K E, Witter E, Mcgrath S P, 1998. Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils: a review. Soil Biology and Biochemistry, 30(10): 1389—1414
Grigorakis K, Rigos G, 2011. Aquaculture effects on environmental and public welfare ——the case of Mediterranean mariculture. Chemosphere, 85(6): 899—919
Hill T C J, Walsh K A, Harris J Aet al, 2003. Using ecological diversity measures with bacterial communities. FEMS Microbiology Ecology, 43(1): 1—11
Jiang Z J, Fang J G, Mao Y Zet al, 2010. Eutrophication assessment and bioremediation strategy in a marine fish cage culture area in Nansha Bay, China. Journal of Applied Phycology, 22(4): 421—426
Karakassis I, Tsapakis M, Hatziyanni Eet al, 2000. Impact of cage farming of fish on the seabed in three Mediterranean coastal areas. ICES Journal of Marine Science: Journal du Conseil, 57(5): 1462—1471
Kawahara N, Shigematsu K, Miyadai Tet al, 2009. Comparison of bacterial communities in fish farm sediments along an organic enrichment gradient. Aquaculture, 287(1): 107—113
Korsnes K, Nicolaisen O, Sk?r C Ket al, 2006. Bacteria in the gut of juvenile codGadus morhuafed live feed enriched with four different commercial diets. ICES Journal of Marine Science: Journal du Conseil, 63(2): 296—301
Kunihiro T, Miyazaki T, Uramoto Yet al, 2008. The succession of microbial community in the organic rich fish-farm sediment during bioremediation by introducing artificially mass-cultured colonies of a small polychaete,Capitellasp. I.Marine Pollution Bulletin, 57(1): 68—77
La Rosa T, Mirto S, Marino Aet al, 2001. Heterotrophic bacteria community and pollution indicators of mussel——farm impact in the Gulf of Gaeta (Tyrrhenian Sea). Marine Environmental Research, 52(4): 301—321
La Rosa T, Mirto S, Mazzola Aet al, 2004. Benthic microbial indicators of fish farm impact in a coastal area of the Tyrrhenian Sea. Aquaculture, 230(1): 153—167
Li J, Li F, Yu Set al, 2013. Impacts of mariculture on the diversity of bacterial communities within intertidal sediments in the Northeast of China. Microbial Ecology,66(4): 861—870
Luna G M, Corinaldesi C, Dell'Anno Aet al, 2013. Impact of aquaculture on benthic virus-prokaryote interactions in the Mediterranean Sea. Water Research, 47(3): 1156—1168
Mudroch A, Azcue J M, Mudroch P, 1996. Manual of physico-chemical analysis of aquatic sediments. CRC Press,Florida, USA, 123—124
Rodgers C J, Furones M D, 1998. Disease problems in cultured marine fish in the Mediterranean. Fish Pathology (Japan),33(4): 157—164
Sebastián M, Pitta P, GonzálezJ Met al, 2012. Bacterioplankton groups involved in the uptake of phosphate and dissolved organic phosphorus in a mesocosm experiment with P-starved Mediterranean waters. Environmental Microbiology,14(9): 2334—2347
Thingstad T F, Krom M D, Mantoura R F Cet al, 2005. Nature of phosphorus limitation in the ultraoligotrophic eastern Mediterranean. Science, 309(5737): 1068—1071
Vezzulli L, Chelossi E, Riccardi Get al, 2002. Bacterial community structure and activity in fish farm sediments of the Ligurian sea (Western Mediterranean). Aquaculture International, 10(2): 123—141
- 海洋與湖沼的其它文章
- 大菱鲆(Scophthalmus maximus)、星斑川鰈(Platichthys stellatus)及其雜交種的形態學分析*
- 半滑舌鰨(Cynoglossus semilaevis Günther)生長激素體外重組表達及活性分析*
- 香港牡蠣(Crassostrea hongkongensis)與長牡蠣(Crassostrea gigas)種間雜種遺傳力評估*
- 三疣梭子蟹(Portunus trituberculatus)胞內氯離子通道蛋白基因克隆及其表達分析*
- 褪黑激素對香港細首紐蟲(Cephalothrix hongkongiensis)性腺發育的影響及羥基吲哚-O-甲基轉移酶(HIOMT)的測定*
- 飼養空間大小對單體筐養養殖系統中三疣梭子蟹(Portunus trituberculatus)的攝食行為與生長特性的影響研究*

