激素誘導斜帶石斑魚(Epinephelus coioides)雄性化的研究*
黃 文 楊憲寬 徐 新 肖 玲 李水生 趙會宏 張海發 張 勇① 林浩然,
(1. 中山大學水生經濟動物研究所暨廣東省水生經濟動物良種繁育重點實驗室 廣州 510275; 2. 華南農業大學動物科學學院廣州 510642; 3. 廣東省海洋漁業試驗中心 惠州 516081; 4. 海南大學海洋學院 海口 570228)
石斑魚是我國重要的海水養殖魚類, 屬鱸形目(Perciformes)、科(Serranidae)、石斑魚亞科(Epinephelinae)。石斑魚肉質鮮美, 營養豐富, 為餐桌中的上等佳肴,深受各地消費者的喜愛, 在熱帶和亞熱帶地區的沿海漁業中占有重要地位(Pierreet al, 2008)。
我國大陸石斑魚人工養殖興起于20世紀80年代(馬榮和等, 1987)。隨后, 我國學者圍繞石斑魚人工繁育進行研究, 在親魚培育和產卵、苗種培育技術以及石斑魚的病害防治技術等方面取得突破, 促進了石斑魚養殖產業的社會化分工, 在我國南方形成了石斑魚苗種繁育和健康養殖產業(劉付永忠等, 2000; 陳國華等, 2001)。
由于石斑魚是典型的雌雄同體、雌性先熟種類,高齡魚才性轉變為雄魚。這種狀況造成了在人工繁育中往往存在雄魚缺乏或雌雄不同步的現象, 嚴重制約了石斑魚人工繁育工作的開展。在自然海域, 雌性斜帶石斑魚(Epinephelus coioides)的初次性成熟年齡為3—4齡, 人工培育條件下可提前至2.5齡, 其發生性轉變的年齡至少在4齡以上(趙會宏等, 2003)。已有研究表明, 應用外源激素可以誘導石斑魚雌魚提早發生性轉變為雄魚, 能夠滿足繁殖的需要(方永強等, 1992; 鄒記興等, 2000)。石斑魚性別控制技術的研究與推廣應用, 將為石斑魚類種苗的穩定大批量生產提供技術保證。
有些魚類如羅非魚(Oreochromis)和異育銀鯽(Allogynogenetic crucian carp,Carassius auratus gibelio)等, 在發育早期經一定劑量的雄激素處理后就能產生出功能性的雄魚(張甫英等, 2000; 王揚才等,2003)。石斑魚是典型的雌雄同體魚類, 其性腺中同時存在雌性和雄性生殖細胞, 如果受到雄激素的刺激,性腺就有可能朝著雄性化的方向發育。因此, 本文作者在研究斜帶石斑魚性腺發育過程的基礎上, 在性腺發育早期投喂甲基睪酮(MT)激素, 以誘導石斑魚幼魚雄性化。
1 材料與方法
1.1 樣品
斜帶石斑魚均養殖于廣東省海洋漁業試驗中心,分別選取3、6、9、12、18、24、30、36月齡的石斑魚, 解剖后取性腺, 用Bouin’s液固定。選取8月齡斜帶石斑魚幼魚用于雄激素誘導性分化實驗, 設1個對照組, 2個實驗組, 每組2個網箱, 分別養殖在6個網箱中(網箱大小: 1.5m×1.5m×1.5m), 每個網箱100尾, 共600尾魚, 在自然水溫(26—30°C) 條件下, 流水飼養到6個月。實驗重復1次。
1.2 方法和處理
1.2.1 不同年齡階段石斑魚性腺發育狀況 對不同年齡階段的斜帶石斑魚性腺, 經石蠟切片, H.E染色, 觀察和拍照, 確定斜帶石斑魚性腺分化和發育時期。
1.2.2 雄激素誘導性別分化 對實驗組的斜帶石斑魚幼魚, 投喂含有10mg/kg MT激素的配合飼料,誘導其往雄性方向發展; 對照組投喂正常飼料。喂料頻率為每天1次。利用魚肝油溶解MT激素, 與飼料攪拌均勻, 魚肝油與飼料的比例為: 10mL魚肝油比100g飼料, 攪拌后置于空氣中晾干30min再投喂。
每月對實驗組和對照組分別取8尾斜帶石斑魚,解剖后取性腺用Bouin’s液固定, 石蠟切片, H.E染色,拍照觀察性腺分化和發育情況。
1.2.3 中斷雄激素投喂后石斑魚性腺發育狀況雄激素投喂3個月后, 一個實驗組繼續投喂含MT激素的配合飼料, 為持續投喂組; 另一組中斷MT激素投喂, 改為正常飼料投喂, 為中斷投喂組; 對照組照常喂養。喂料頻率不變, 養殖方法不變。比較持續投喂組、中斷投喂組、對照組石斑魚性腺的發育狀況。
2 結果與分析
2.1 人工養殖條件下斜帶石斑魚性腺發育過程
斜帶石斑魚在人工養殖條件下不同年齡階段的性腺發育過程如圖1所示(時期劃分參照Chenet al,2011): 3月齡石斑魚幼魚性腺處于性原基形成時期,為未分化時期; 6月齡石斑魚幼魚性腺處于卵巢腔形成時期, 性腺已向雌性分化; 9月齡石斑魚幼魚性腺中形成大量的性原細胞, 卵巢腔已經形成, 還沒有開始發育, 尚未發現卵母細胞; 12月齡石斑魚性腺中開始形成初級卵母細胞(primary-growth stage oocyte,O1), 卵巢開始發育; 18月齡石斑魚性腺中出現大量的O1期卵母細胞, 但還未出現皮層小泡, 處在初級卵母細胞生長期; 24月齡石斑魚性腺的卵母細胞體積增大, 處于皮層小泡生成時期(cortical-alveolus stage oocyte, O2); 30月齡石斑魚性腺仍處于O2期, 卵母細胞中皮層小泡明顯增多, 但還未出現卵黃囊; 36月齡石斑魚處于卵母細胞卵黃形成時期(vitellogenic stage oocyte, O3), 卵母細胞中存在大量的卵黃囊, 此時斜帶石斑魚已經發育成熟。
2.2 MT激素誘導斜帶石斑魚性腺發育過程
對8月齡斜帶石斑魚幼魚投喂MT激素后, 其性腺發育如圖2, 詳細過程: 實驗開始階段, 對照組和實驗組斜帶石斑魚幼魚性腺細胞均為性原細胞, 石斑魚幼魚卵巢還未發育, 如圖2(A0)和圖2(B0)所示;投喂1個月后, 對照組性腺細胞所處時期不變, 仍為性原未分化細胞, 石斑魚卵巢還處在未發育狀態[圖2(A1)]; 實驗組石斑魚幼魚開始往雄性方向發育, 性腺切片中觀察到育精囊, 育精囊(SG)中有精原細胞(Sg)和初級精母細胞(PSc)出現, 如圖2(B1); 投喂2個月后, 對照組性腺細胞仍為性原細胞, 表明石斑魚卵巢發育還未啟動[圖2(A2)]; 實驗組石斑魚繼續往雄性方向發育, 性腺中開始出現了次級精母細胞(SSc),如圖2(B2); 投喂3個月后, 對照組性腺切片中開始出現了O1期細胞, 說明正常情況下斜帶石斑魚在11—12月齡左右, 卵巢發育開始啟動, 性腺往雌性方向發展; 相比之下, 實驗組石斑魚精巢繼續發育[圖2(B3)],性腺出現了精細胞(St), 甚至有少量的精子出現(Sz),可以確定斜帶石斑魚幼魚在MT激素的誘導下已經轉變為功能性雄魚[圖2(B3)]。
2.3 中斷投喂MT激素后的斜帶石斑魚性腺發育過程
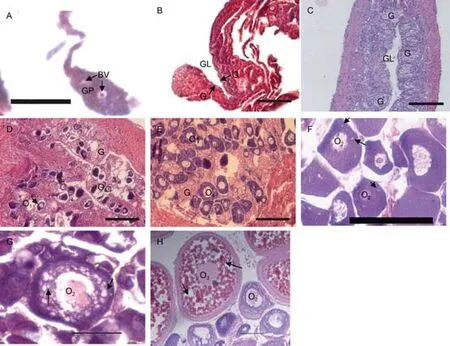
圖1 斜帶石斑魚性腺發育過程切片圖Fig.1 Gonad development sections of E. coioides
發現石斑魚幼魚轉化成雄性后, 對一個實驗組停止投喂含MT的配合飼料, 另一個實驗組持續投喂含MT的配合飼料, 跟蹤觀察性腺發育狀況, 見圖3。結果發現: 中斷投喂1個月后, 對照組性腺與上個月相比, 沒有明顯的變化[圖3(A4)]; 持續投喂組性腺繼續往雄性方向發展, 性腺中精子的數量開始增多[圖3(B4)];中斷投喂組性腺的雄性特征變得不明顯, 表現在性原細胞的比例顯著增大, 雄性相關的細胞數量大幅減少, 沒有發現有Sz的出現[圖3(C1)]; 中斷投喂2個月后, 對照組與上個月相比, 性腺中O1期卵母細胞數量有增多的趨勢, 表明斜帶石斑魚已向雌性卵巢發育[圖3(A5)]; 持續投喂組性腺繼續往雄性方向發展, 性腺精巢腔隙中出現大量的精子[圖3(B5)]; 而中斷投喂組性腺雄性特征持續退化, 性腺中St不再出現, SSc細胞在性腺中所占的比例比上個月更低,性腺中性原細胞占大部分比例[圖3(C2)]; 中斷投喂3個月后, 對照組與上個月相比, 性腺中O1期卵母細胞開始大量出現, 斜帶石斑魚雌性特征明顯[圖3(A6)]; 持續投喂組性腺雄性特征更加明顯, 性腺精巢腔隙中出現的精子密度更加濃密[圖3(B6)]; 中斷投喂組性腺則全部退化為性原細胞時期[圖3(C3)]。
3 討論
石斑魚屬于雌雄同體雌性先熟的種類, 對多種石斑魚類的染色體核型分析均未發現異型染色體(王世峰, 2007), 表明石斑魚的染色體遺傳無差異, 如Chan等(1981)的觀點: 動物中存在由環境影響及具有遺傳無差異特性的性別決定方式。本研究的斜帶石斑魚均養殖于廣東省海洋漁業試驗中心的循環水養殖系統中, 石斑魚幼魚卵巢腔形成于6—9月齡之間,之后卵巢開始發育, 以卵巢腔形成為石斑魚性別分化為雌性的標志(Ryosukeet al, 2012)。硬骨魚類的性別分化(性別決定或遺傳意義上的分化)一般在胚后發育的較早時期發生, 例如, 鯉科魚類在孵化后的4—6周性腺就開始分化, 此時就要開始投喂激素; 如果太晚投喂, 就有可能性逆轉效果很差, 或達不到永久性逆轉的效果(張甫英等, 2000; 岳敏娟等, 2009)。石斑魚是雌雄同體雌性先成熟魚類, 前人對石斑魚的性逆轉誘導在雌魚卵巢發育之后, 均能成功誘導成為雄性。如方永強等(1992)經過連續投喂含有MT的餌料, 成功的誘導2齡及以上的赤點石斑魚發生性逆轉; 鄒記興等(2000)采用埋植混合激素藥條的方法誘導3齡以上巨石斑魚提早性逆轉; 作者早期的研究表明投喂含有MT和ADSD的餌料, 均可誘導2齡斜帶石斑魚提前發生性轉化, MT可誘導實驗魚產生精液, ADSD可誘導實驗魚到雌雄同體階段(趙會宏,2003)。眾多激素處理均能成功誘導石斑魚性別轉變,表明石斑魚的性別決定屬類固醇激素依賴型, 即雄性類固醇激素達到一定量時, 抑制或關閉了雌性相關基因的表達, 而啟動了雄性相關基因, 導致一系列生理變化, 促進卵巢退化和吸收、性腺組織結構的重組, 以及雄性配子細胞的增殖(桂建芳, 2007)。
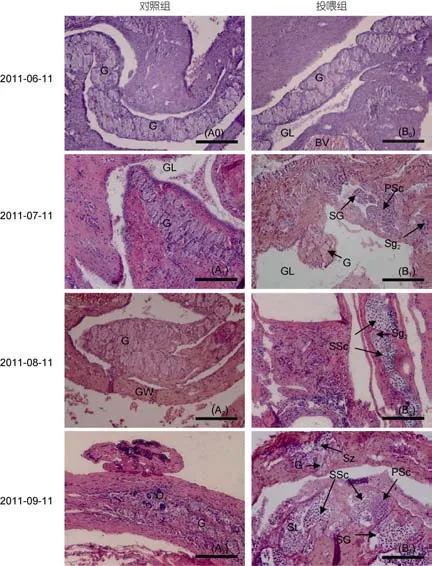
圖2 投喂MT激素誘導斜帶石斑魚幼魚轉雄性腺切片圖Fig.2 Gonad sections of juvenile E. coioides sex-change to male by MT food
作者在石斑魚性別分化為卵巢發育之前, 選取斜帶石斑魚幼魚進行雄激素誘導, 以誘導其性別往雄性方向發展。由于斜帶石斑魚幼魚馴料時間較長,而6月齡的幼魚配合飼料進食不夠均勻, 個體差異較大。因此作者選取8月齡的斜帶石斑魚幼魚進行投喂實驗, 以期獲得比較均一的結果。本研究中, 斜帶石斑魚幼魚在8月齡的時候卵巢還未開始發育; 投喂激素一個月后, 性腺開始往雄性方向發展, 性腺中出現了雄性的生殖細胞; 保持相同的激素量, 在連續投喂三個月后, 石斑魚性腺中開始出現精子, 在雄激素的持續作用下, 性腺中雄性生殖細胞也持續地往后期發展, 最后精子的出現證明石斑魚已經發育成為雄魚。相似的投喂誘導效果還見于東大西洋石斑魚(Glamuzinaet al, 1998)、青銅石斑魚(Hasssinet al,1997)、七帶石斑魚(Tanakaet al, 1999)、蜂巢石斑魚(Kobayashiet al, 1999)等的研究。
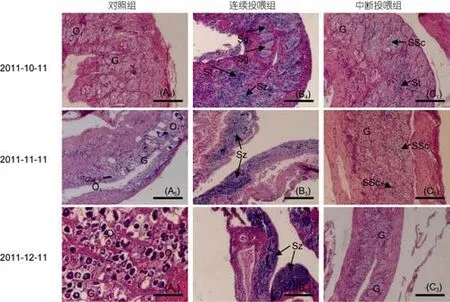
圖3 中斷MT激素投喂后各實驗組性腺切片圖Fig.3 Gonad sections of E. coioides while stopping MT food
中斷激素投喂后, 雄性斜帶石斑魚性腺發生退化, 斜帶石斑魚幼魚性腺中本來存在的精子、精細胞等退化消失了, 出現更為原始的精母細胞; 三個月后,性腺中不再存在雄性的細胞結構, 都退化為性原細胞, 呈現出未分化的狀態。表明沒有了外源雄激素的刺激, 斜帶石斑魚幼魚不能繼續往雄性方向發育。外源雄激素誘導魚類性逆轉的機制研究發現: 17α-MT主要是通過直接作用于性腺或者影響與性腺發育有關的生理過程起作用的(Leeet al, 1995; Kitanoet al, 2000; 李廣麗等, 2006)。本文中, 石斑魚幼魚雖然被誘導往雄性方向發展, 卻不能啟動石斑魚自身的雄性發育機制, 這種外源性的雄激素一旦消失,石斑魚幼魚就按照自身遺傳基因控制的方向朝雌性發育。
綜合前人的研究結果, 作者認為雌雄同體魚類的性別決定過程可分為生殖腺分化時的初級性別決定和分化后完成生殖腺發育時(雌或雄)的次級性別決定。雌雄同體魚類的初級性別決定調控與其他魚類高度相似, 受遺傳因子的調控; 但次級性別決定過程則受到年齡、體型和社會因子的影響。Fishelson(1970)對長棘花鰭(Anthias squamipinnis)的研究發現, 雄魚的存在與否會影響雌性的性轉變過程。Liu等 (2004)對黑鲙(Cephalopholis boenak)的研究認為: 體型小的雌魚比體型大的雌魚更容易發生性轉變。石斑魚是典型的雌雄同體雌性先熟的魚類, 初級性別決定其在早期性分化為雌性, 如不受外源激素影響, 正常發育為雌魚。卵巢未發育的雌魚經雄激素誘導性轉變為雄性, 停止藥物處理后會再度性轉變為雌性, 表明石斑魚次級性別決定可能受到時間軸因子和社會因子的強烈影響。Chan等(1981)認為, “社會學因素”主要是通過神經內分泌途徑來溝通外部刺激與性轉變的,有關石斑魚性轉變的整個過程可能涉及到中樞神經系統、下丘腦—垂體—性腺軸等內分泌器官的一系列變化。
馬榮和, 李加爾, 周宏團等, 1987. 赤點石斑魚人工育苗的初步研究. 海洋漁業, (4): 158—160
王世峰, 2007. 六種石斑魚核型特征比較和染色體進化研究.廈門: 廈門大學博士學位論文, 1—116
王揚才, 陸開宏, 2003. 羅非魚的性別決定與控制. 水產科技,(3): 17—20
方永強, 林秋明, 齊 襄等, 1992. 17α-甲基睪酮對赤點石斑魚性逆轉的影響. 水產學報, 16(2): 171—174
劉付永忠, 王云新, 黃國光等, 2000. 斜帶石斑魚親魚強化培育及自然產卵研究. 中山大學學報, 39(6): 81—85
李廣麗, 劉曉春, 林浩然, 2006. 17α-甲基睪酮對赤點石斑魚性逆轉的影響. 水產學報, 30(2): 145—150
鄒記興, 胡超群, 黃增岳等, 2000. 外援混合激素誘導巨石斑魚性逆轉的研究. 高技術通訊, 1: 5—9
張甫英, 胡 煒, 汪亞平等, 2000. 應用雄性激素誘導異育銀鯽性轉化的研究. 遺傳, 22(1): 25—27
陳國華, 張 本, 2001. 點帶石斑魚親魚培育、產卵和孵化的試驗研究. 海洋與湖沼, 32(4): 428—435
岳敏娟, 尤永隆, 林丹軍, 2009. 溫度對鯽魚性腺分化的影響.動物學雜志, 44(1): 9—16
趙會宏, 2003. 斜帶石斑魚性腺發育和性別轉變的神經內分泌研究. 廣州: 中山大學博士學位論文, 1—100
趙會宏, 劉曉春, 劉付永忠等, 2003. 斜帶石斑魚雌魚卵巢發育與血清類固醇激素的生殖周期變化. 中山大學學報,42(6): 56—63
桂建芳, 2007. 魚類性別和生殖的遺傳基礎及其人工控制. 北京: 科學出版社, 1—247
Chan S T H, O Wai-sum, 1981. Environmental and Non-genetic Mechanisms in Sex Determination. In: Austin C R, Edwards R G ed. Mechanisms of Sex Differentiation in Animal and Man. New York: Academic Press, 55—111
Chen Huapu, Zhang Yong, Li Shuishenget al, 2011. Molecular cloning, characterization and expression profiles of three estrogen receptors in protogynous hermaphroditic orange-spotted grouper (Epinephelus coioides). General and Comparative Endocrinology, 172: 371—381
Fishelson L, 1970. Protogynous sex reversal in the fishAnthias squamipinnis(Teleostei, Anthiidae) regulated by the presence or absence of a male fish. Nature, 227: 90
Glamuzina B, Glavi? N, Skaramuca Bet al, 1998. Induced sex reversal of dusky grouper,Epinephelus marginatus(Lowe).Aquaculture Research, 29: 563—567
Hasssin S, Monbrison D, Hanin Yet al, 1997. Domestication of the white grouper,Epinephelus aneus. 1. Growth and reproduction. Aquaculture, 156: 305—316
Kitano T, Takamune K, Nagahama Yet al, 2000. Aromatase inhibitor and 17α-methyltestosterone cause sex-reversal from genetical females to phenotypic males and suppression of P450 aromatase gene expression in Japanese flounder(Paralichthys olivaceus). Molecular Reproduction and Development, 56: 1—5
Kobayashi Y, Lee Y D, Takemura Aet al, 1999. Histological Observation of Sex Change in Honey Comb Grouper,Epinephelus merra. In: Proceeding of the 6thInternational Symposium on the Reproductive Physiology of Fish. Bergen,Norway, 269—267
Lee S T L, Kime D E, Chao T Met al, 1995. In vitro metabolism of testosterone by gonads of grouper (Epinephelus tauvina)before and after sex inversion with 17α-methyltestosterone.General and Comparative Endocrinology, 99: 41—49
Liu M, Sadovy Y, 2004. The influence of social factors on adult sex change and juvenile sexual differentiation in a diandric,protogynous epinepheline,Cephalopholis boenak(Pisces,Serranidae). The Zoological Society of London, 264: 239—248
Pierre Stéphanie, Gaillard Sandrine, Prévot-D'Alvise Nathalieet al, 2008. Grouper aquaculture: Asian success and Mediterranean trials. Aquatic Conservation: Marine and Freshwater Ecosystems, 18: 297—308
Ryosuke Murata, Yasuhisa Kobayashi, Hirofumi Karimataet al,2012. The role of pituitary gonadotropins in gonadal sex differentiation in the protogynous Malabar grouper,Epinephelus malabaricus. General and Comparative Endocrinology, 178(3): 587—592
Tanaka H, Tsuchihashi Y, Kuromiya Y, 1999. Induction of Sex Reversal in the Sevenband Grouper,Epinephelus septemfasciatus. In: Proceeding of the 6thInternational Symposium on the Reproductive Physiology of Fish. Bergen,Norway, 423
- 海洋與湖沼的其它文章
- 大菱鲆(Scophthalmus maximus)、星斑川鰈(Platichthys stellatus)及其雜交種的形態學分析*
- 半滑舌鰨(Cynoglossus semilaevis Günther)生長激素體外重組表達及活性分析*
- 香港牡蠣(Crassostrea hongkongensis)與長牡蠣(Crassostrea gigas)種間雜種遺傳力評估*
- 三疣梭子蟹(Portunus trituberculatus)胞內氯離子通道蛋白基因克隆及其表達分析*
- 褪黑激素對香港細首紐蟲(Cephalothrix hongkongiensis)性腺發育的影響及羥基吲哚-O-甲基轉移酶(HIOMT)的測定*
- 飼養空間大小對單體筐養養殖系統中三疣梭子蟹(Portunus trituberculatus)的攝食行為與生長特性的影響研究*

