替米考星對機體免疫系統調節的研究進展
田 丹 楊元信
浙江康德權科技有公司,杭州 311107
替米考星對機體免疫系統調節的研究進展
田 丹 楊元信
浙江康德權科技有公司,杭州 311107
替米考星是動物專用的新一代大環內酯類抗生素,近年來廣泛應用于畜禽養殖中,用于呼吸系統疾病的防控。有學者提出替米考星對免疫系統的調節作用在疾病治療過程中起著重要作用,本文闡述了近年來替米考星在促進機體防御功能方面所取得的最新進展。
替米考星;免疫調節;巨噬細胞;中性粒細胞;研究進展
替米考星是新型的動物專用的抗生素,屬于半合成大環內酯類抗生素,由美國禮來公司于20世紀80年代研發。因其抗菌活性強,組織滲透能力強,耐藥性低,毒副作用小,多用于防治家畜肺炎(胸膜肺炎放線桿菌、巴氏桿菌、霉形體等感染)、家禽支原體病以及泌乳動物乳房炎等。近年來研究表明,與其他多數抗生素對機體免疫系統產生抑制作用不同,替米考星能刺激動物體免疫功能,促進機體自身防御。Retuter等指出替米考星在治療疾病的機制中對免疫系統的調節作用做出的貢獻比對細菌的直接抑殺作用要大[1]。
1協同巨噬細胞產生殺菌作用
巨噬細胞是機體先天性免疫的重要執行者,是所謂的“專職性組織吞噬細胞”。在非特異性免疫中,巨噬細胞被稱為機體“清道夫”,主要通過吞噬作用殺滅和清除病原體及異物,并介導炎癥反應。在特異性免疫方面,巨噬細胞主要發揮免疫調節功能,包括對抗原遞呈進行調節,活化后分泌各種細胞因子,發揮免疫調節作用。
在正常狀態時,巨噬細胞能將集聚在感染部位的病原體和自身凋亡的細胞吞入,然后利用自身的消化酶(溶酶體分泌)將吞入的病原體等殺滅,再釋放出相應的抗原免疫成分,遞呈給下一級免疫系統,促進抗體的產生。但實際上,并非所有的病原體都能被殺滅,當病原體的數量超過巨噬細胞的吞噬消滅能力時,機體就會表現出發病狀態。替米考星能協同巨噬細胞殺滅病原菌。Chin等將從雞體內分離到的吞噬細胞與替米考星共同培養,結果發現替米考星能聚集在吞噬細胞內(包括巨噬細胞和異嗜細胞),細胞內外濃度比高達50%~75%。替米考星的這種特性可能與其本身的親油性有關[2]。積聚在巨噬細胞內的替米考星51%~85%的亞細胞分布是定位于溶酶體中[3]。而溶酶體是巨噬細胞內消化酶的“生產器”,溶酶體酶的活性直接影響著巨噬細胞的殺菌活性。研究證實進入巨噬細胞的替米考星能顯著增加溶酶體酶的分泌量并增強其活性[4],這將有助于替米考星協助巨噬細胞共同殺滅病原體。除此之外,進入巨噬細胞內的替米考星代謝比細胞外緩慢,當細胞外的替米考星已代謝完時,嗜中性粒細胞和巨噬細胞中的替米考星至少還能維持4 h[4]。也就是說,當血液中的替米考星清除到最小抑菌濃度(MIC)下時,吞噬細胞內的替米考星仍可保持較高濃度,并對病原菌起作用。
眾所周知,PRRSV主要侵害機體的巨噬細胞,包括肺泡巨噬細胞、卵巢卵泡中的巨噬細胞和生精小管間質內巨噬細胞等。PRRSV進入機體后首先攻擊肺泡巨噬細胞,并在肺泡巨噬細胞內增殖,然后再擴散至全身各組織的巨噬細胞中,破壞機體防御系統,導致嚴重的繼發感染。所以控制PRRS的關鍵是“搶救”巨噬細胞。Molitor[5]將替米考星和肺泡巨噬細胞放在一起培養,以PRRSV攻毒,發現PRRSV的復制受到抑制,而且這一抑制作用隨替米考星濃度增加而增強,說明替米考星可以協助肺泡巨噬細胞抑制PRRSV復制。正是由于替米考星的這一特性使其成為防控豬PRRS的首選藥物。國內外已經有許多用替米考星成功治療PRRS的案例報道[6]。
2 促使中性粒細胞凋亡
中性粒細胞(PMN)是體內數量最多的致炎性白細胞,對機體免疫防衛起至關重要作用,然而其對機體正常組織也有強大損傷作用。正常情況下當細菌進入體內,PMN被激活、聚集、吞噬細菌,再將吞入的細菌殺死后會自動凋亡,形成一個含有細菌殘骸的膿球,隨后巨噬細胞將這個膿球吞噬,從細菌殘骸中釋放抗原成分呈遞給機體,刺激抗體產生。但是當PMN凋亡出現異常的時候就會釋放毒性內容物,損害組織和導致器官功能不全。引起PMN異常凋亡的因素很多,如IL-1、IL-2等細胞因子,黏附分子,地塞米松、氫化可的松等糖皮質激素類藥物,氧化劑,細菌內毒素。其中最常見的為細菌內毒素,如胸膜肺炎放線桿菌釋放出的毒素能使PMN喪失凋亡功能,內毒素還可致PMN破裂壞死,當攜帶有大量消化酶的PMN壞死崩解后,消化酶向周圍擴散,組織破壞范圍會繼而擴大,使炎癥加劇。因此,炎癥部位PMN的結局如何將關系到許多疾病的發生、發展和轉歸,而該部位PMN的清除是炎癥反應消退的必要條件。
體內研究表明,替米考星可以促使感染胸膜肺炎放線桿菌豬PMN凋亡,表現出抗炎特性[7]。此外,替米考星能誘導牛感染溶血曼海姆菌引起炎癥的PMN凋亡。小牛接種活菌后用替米考星治療,3 h后就能檢測到較高水平的PMN凋亡,而未經替米考星治療組的感染肺組織中的炎性因子白細胞三烯B4積聚,炎癥加重[8]。說明替米考星的治療作用與抑制白細胞三烯B4合成有關。PMN體外循環試驗證實,替米考星的這種直接促凋亡的特性與細菌的存在與否不相關,屬于一種獨立特性[2]。也就是說,不管機體有沒有感染病原微生物,只要有替米考星存在就會誘導中性粒細胞程序性死亡,這對于無菌炎癥的治療意義重大。另外,體外培養試驗發現替米考星可以增加巨噬細胞對凋亡PMN的吞噬作用(圖1)。最重要的是,替米考星這一誘導作用并不改變PMN的特性,包括細胞的趨化、化學、氧化爆裂、吞噬活性[7]。總之通過誘導中性粒細胞凋亡,替米考星可以防止白細胞壞死繼發引起的嚴重的組織損傷,具有重要的臨床意義(圖2)。
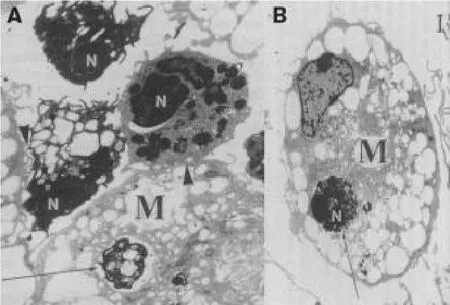
圖1替米考星誘導中性粒細胞凋亡并增加巨噬細胞的吞噬能力
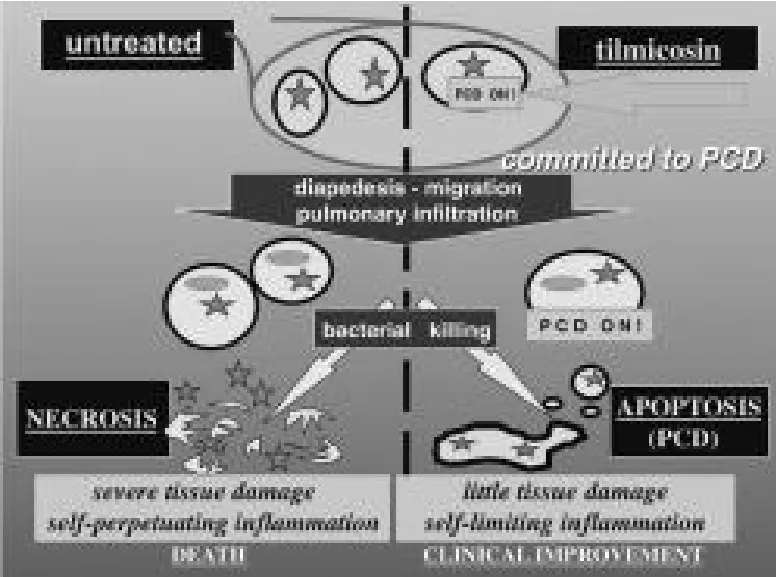
圖2替米考星促進中性粒細胞凋亡的過程,又稱程序性細胞死亡(PCD),以及可能會產生臨床獲益[9]
3調節機體免疫功能,減少炎癥反應
免疫反應是機體防御機制中必不可少的部分,但是過度的免疫反應,卻會對整個機體的代謝產生負面影響,如過度的炎癥反應。炎癥和炎性介質在食品動物上產生負面影響包括采食量減少,生長遲緩,繁殖障礙,產奶量降低,以及代謝障礙。所以機體免疫反應正常有序地進行是保持健康的必要前提。
替米考星在雞上對免疫的調節表現為降低體液免疫反應,增強細胞免疫反應[10],卻可以從體液免疫和細胞免疫水平調節小鼠的炎癥反應[11]。細胞免疫的增強對于病毒性疾病來說很重要,因為病毒的發病機制在細胞,所以細胞免疫在對抗病毒感染時就顯得尤為重要,同時對于病毒性疫苗免疫起積極作用,疫苗免疫的同時加入替米考星可以一定程度提高抗體水平[10]。替米考星降低了雞輔助性T2細胞IL-4的表達量,增加IFN-γ的分泌量[10],其對IFN-γ的促釋放作用提示其對其它細胞因子的釋放同樣具有促進作用[12]。但是在小鼠上替米考星對細胞因子的作用與雞上稍有差異,高濃度時能降低伴刀斗豆瓣A和LPS引起的脾細胞增殖,降低IL-2、IL-4 和 IFN-γ的分泌量,減少卵清蛋白誘導炎癥大鼠IgG、IgG1和IgG2b的表達[11]。Cao等[13]利用脂多糖(LPS)誘導的小鼠巨噬細胞和外周血單核細胞,研究了體外替米考星在炎性過程對一氧化氮(NO)、前列腺素E2(PGE2)和一些LPS誘導產生的細胞因子的影響,結果顯示10 mg/mL和20 mg/mL的替米考星能顯著降低前列腺環素F1A(6-Keto-PGF1A,F1A)、PGE(2),NO、TNF,IL-1,IL-6含量,減少環氧合酶-2(COX-2)和NO合成的基因表達,同時增加IL-10的表達,從而抑制了LPS誘導NO和PGE2產生的活性。其中COX-2活化是強大的炎癥介質,IL-10屬于抗炎因子,IL-4是一個介導體液免疫的重要細胞因子,IFN-γ是由輔助T1細胞分泌的細胞因子,是用來評判細胞免疫的重要因子。以上結果提示替米考星通過調節某些遞質和細胞因子的合成來起到抗炎的作用。雖然不同種屬間替米考星對于細胞因子的調節不盡相同,但是仍可以推斷出其對免疫系統具有正向調節作用。
目前豬場里由各種因素造成的豬群免疫抑制現象普遍存在,而且疾病趨于復雜化、非典型化,替米考星作為動物專用的抗生素,不僅抗菌活性強,而且最新研究顯示出的替米考星在抗病毒和提高機體免疫力方面有積極的作用,在殺滅敏感菌的同時還能調動機體免疫,為臨床用藥帶來了新的思路和方法。因此,替米考星在未來控制畜禽疾病中將發揮更重要的作用。
[1]RETUTER R R,CARROLL J A,DAILEY J W,et al.Effctes of dietary energy source and leveland injection oftimicosin phosphate on immune function in lipopolysaccharide challenged beef steers[J].J.Anim.Sci,2008(86):1963-1976.
[2] CHIN A C,LEE W D,MURRIN K A,et al.Tilmicosin induces apoptosis in bovine peripheral neutrophils in the presence or in the absence ofand promotes neutrophil phagocytosis by macrophages[J].Antimicrob Agents Chemother,2000(44):2465-2470.
[3] 張繼瑜,王連娣.動物專用抗菌新藥替米考星[J].飼料研究,2003 (6):36-38.
[4] SCORNEAUX B,SHRYOCK TR.Intracellularaccumulation,subcellulardistribution,and efflux oftilmicosin in chicken phagocytes[J].Poult.Sci,1998(77):1510-1521.
[5] MOLITOR T W,BAUTISTA E,SHIN J,et al.Tilmicosin affects porcine reproductive and respiratory syndrome virus replication [C]LemanSwine Conference.2001:31.
[6]MISENER M,PARADIS M A,WILLIAMS L.Preliminary evaluationof clinical effects and cost-effectiveness of in-feed Pulmotil(tilmicosin)and serum inoculation in an outbreak of PRRS[C]Proceedings of the 19th IPVS Congress.2006(2):13.
[7] NERLAND E M,LEBLANC J M,FEDWICK J P,et al.Oral tilmicosin induces leukocyte apoptosis,reduces leukotriene B4,and attenuates inflammation in the actinobacillus pleuropneumoniae-infected porcine lung[J].Am J Vet Res,2005(66):100-107.
[8]CHIN A,MORCK D W,MERRILL J K,et al.Anti-inflammatory benefits of tilmicosin in calves with-infected lungs[J].Am J Vet Res,1998,59:765-771.
[9] ANDRé G.BURET.Immuno-modulation and anti-inflammatory benefits of antibiotics:The example of tilmicosin[J].The Canadian Journal of Veterinary Research,2010(74):1-10.
[10]KHALIFEH M S,AMAWI M M,ABU-BASHA E A,et al.Assessment of humoral and cellular-mediated immune response in chickens treated with tilmicosin,florfenicol,or enrofloxacin at the time ofdisease vaccination[J].Poultry Science,2009(88):2118-2124.
[11]GUAN S,SONG Y,GUO W,et al.Immunosuppressive activity of tilmicosin on the immune responses in mice[J].Immunopharmacol Immunotoxicol,2011 Jun,33(2):323-328.
[12]DALHOFF,A,SHALIT I.Immunomodulatory effects of quinolones [J].Lancet Infect Dis,2003(3):359-371.
[13]CAO X Y,DONG M,SHEN J Z,et al.Tilmicosin and tylosin have anti-inflammatory properties via modulation of COX-2 and iNOS gene expression and production of cytokines in LPSinduced macrophages and monocytes[J].Int J Antimicrob Ag,2006 (27):431-438.
2014-11-14
田丹,女,碩士生,執業獸醫師。

