GC-MS結合嗅辨儀鑒定不同酒齡黃酒中的關鍵揮發性風味物質
王 旭, 馮 濤, 莊海寧
(1.上海應用技術學院 香料香精技術與工程學院,上海 201418;2.上海市農業科學院食用菌研究所,國家食用菌工程技術研究中心,上海 201403)
黃酒是我國的傳統釀造酒,至今已有四千多年的歷史[1].它是以大米為主要原料,利用酒藥、麥曲或米曲所含的多種微生物的共同作用,釀造而成的發酵原酒.黃酒釀造過程分為制曲、浸米、蒸飯、發酵、榨酒、勾兌、煎酒、貯存、過濾、灌瓶、滅菌等工序[2].一般情況下,黃酒在上市前密封存儲在瓦罐中陳化至少一年.在這期間,黃酒內部發生多種物理化學變化,酒精、游離氨基氮含量下降,而酸類、酯類、總固形物等含量緩慢增加.正是在陳化期間的這些變化才使得黃酒具有柔和圓潤的口感[3].
目前,對于黃酒中揮發性風味物質的研究,較常用的方法是頂空固相微萃取結合GC-MS分析.Luo[4]和Cao[5]都分別使用SPME-GC-MS分析了不同品牌黃酒的揮發性風味物質,結果表明醇類和酯類在黃酒的揮發性風味物質的種類和含量上占據大部分.Fan[1]利用GC-MS和GC-O得出2-甲基丁醇、3-甲基丁醇、丁酸、3-甲基丁酸、苯乙醇、γ-壬內酯具有最強的風味強度,而二甲基三硫醚、辛酸乙酯、丁酸乙酯、γ-壬內酯有較高的香氣活力值(OAV).
嗅覺閾值是對揮發性風味物質進行評估的一個重要參數.一般嗅覺閾值分為兩類:察覺閾值(detection threshold,DT)、識別閾值(recognition threshold,RT)[6].察覺閾值是指能察覺或者辨別出存在嗅覺刺激時香氣物質的最低濃度;識別閾值是指香氣物質可以被識別香氣特征或可以與其他香氣物質區別開時的最低濃度.近來,符合ASTM E679-04 標準的儀器——AC′Scent嗅辨儀被廣泛地應用于風味物質閾值測定和感官評價員的培訓方面.McGinley[7]和Johnston[8]都利用AC′Scent嗅辨儀對感官評價員進行培訓與篩選,而且Johnston還測定了多種揮發性物質混合后形成的混合物閾值.這都表明AC′Scent嗅辨儀的實際應用能力,為其在測定黃酒中揮發性物質的閾值提供了有用的參考.
本研究主要內容有:①利用固相微萃取結合GC-MS分析金色年華揮發性風味物質;②利用AC′Scent嗅辨儀測定揮發性風味物質閾值;③利用香氣活力值(OAV)判斷黃酒中主要呈香物質.
1 材料與方法
1.1 材 料
1.1.1 試劑及酒樣
2-辛醇(色譜純)和正構烷烴混標(C7-C30)購自Sigma-Aldrich公司(上海).氯化鈉、異丁酸、異丁醇、苯甲醛、乙酸乙酯、己酸、丁醇、丁酸乙酯、乙酸、糠醛、己酸乙酯、苯乙醇、丙醇、己醇、正壬醇、異戊酸、辛酸、乙酸異戊酯、辛酸乙酯、苯甲酸乙酯、苯乙酸乙酯均購自國藥集團化學試劑有限公司(上海),均為分析純.
黃酒樣品:金色年華3年陳(JN3)、5年陳(JN5)和8年陳(JN8).均從上海金楓酒業股份有限公司購買.
1.1.2 儀器設備
SPME進樣手柄、85 μm PA萃取頭,美國Supelco公司;7890-5975C氣相色譜質譜聯用儀,裝配HP-INNOWAX (60 m×0.25 mm i.d.×0.25 μm)色譜柱,美國安捷倫公司;AC′Scent嗅辨儀,St.Croix sensory公司(美國);15 mL頂空瓶,上海安譜科學儀器有限公司.
1.2 試驗方法
1.2.1 酒樣預處理
將所有酒樣用蒸餾水稀釋至6%(v/v)的酒精濃度.然后取稀釋后的酒樣5 mL放入頂空瓶中,同時加入1.25 g氯化鈉和10 μL 2-辛醇(內標物,262 mg/L,溶于超純水).將頂空瓶放入45℃水浴鍋中保溫10 min.
1.2.2 SPME-GC-MS
頂空固相微萃取條件設定為45℃、40 min.氣相色譜條件:進樣口溫度250℃,解析4 min,不分流進樣,載氣氦氣(99.99%),流速2 mL/min.柱箱溫度35℃保持3 min,然后以2℃/min升至60℃,然后以3℃/min升至230℃,最后保持5 min.質譜條件:電離方式EI,離子源溫度230℃,掃描范圍30~350 u.每個酒樣檢測3次.根據正構烷烴計算出保留指數(RI),計算公式見文獻[9].
通過與NIST05a.L數據庫和保留指數對比對香氣物質進行定性鑒別.香氣物質的定量見文獻[9].
1.2.3 嗅覺閾值的測定
測定閾值是根據美國材料試驗學會(ASTM)制定的標準——ASTM E679-04.它包括一系列的三點強制選擇(3-AFC)測試.每次測試包括3個樣品:兩個空白樣品、一個測試樣品.具體操作過程如下.
① 準備樣品袋
將待測物品與樣品袋依次編號,在各樣品袋中通入AC′Scent 嗅辨儀中的氣流速度為19 L/min的零級空氣(經活性碳和分子篩過濾后的空氣),通入時間各為30 s.取相應編號的待測物品10 μL裝入樣品袋中,密封,放置4~5 h,使樣品袋中的樣品與空氣達到平衡狀態.
② 嗅辨員的選擇
以正丁醇作為標準物,對嗅辨員進行篩選.要求:經20次測試,嗅辨員對正丁醇的識別閾值在2×10-8~8×10-8之間.最后確定一個70人左右的感官評定小組.
③ 測定閾值
利用AC′Scent嗅辨儀,采用ASTM E-679中的三點強制選擇法,讓篩選后的嗅辨員對黃酒中檢測到各種揮發性風味物質單體的嗅覺閾值進行測定,該物質是以零級空氣為媒介進行稀釋的,需要記錄樣品被嗅聞到時的稀釋倍數.并以此計算出各揮發性風味物質單體的閾值,閾值的計算公式如下:
T—風味物質閾值,(mg/L);
C—風味物質濃度,(mg/L);
D—樣品稀釋倍數.
1.2.4 香氣活力值的計算
香氣活力值(OAV)是香氣物質的濃度與其嗅覺閾值的比值.根據下面公式計算香氣活力值:
OAV=F/T.
F—樣品中揮發性物質濃度,(mg/L);
T—揮發性物質閾值,(mg/L).
1.3 數據處理
單因素方差分析(ANOVA)使用SPSS11.5軟件進行.
2 結果與分析
2.1 不同酒齡黃酒中的揮發性風味物質及含量
共檢測出41種物質,見表1.其中包括17種酯類、10種醇類、6種酸類、2種內酯、酮類和酚類各1種.香氣物質種類和已報道的相符合[2,10].這可以表明黃酒的揮發性風味物質在種類上基本是相同的,只是在含量上會因不同年份而產生差異.
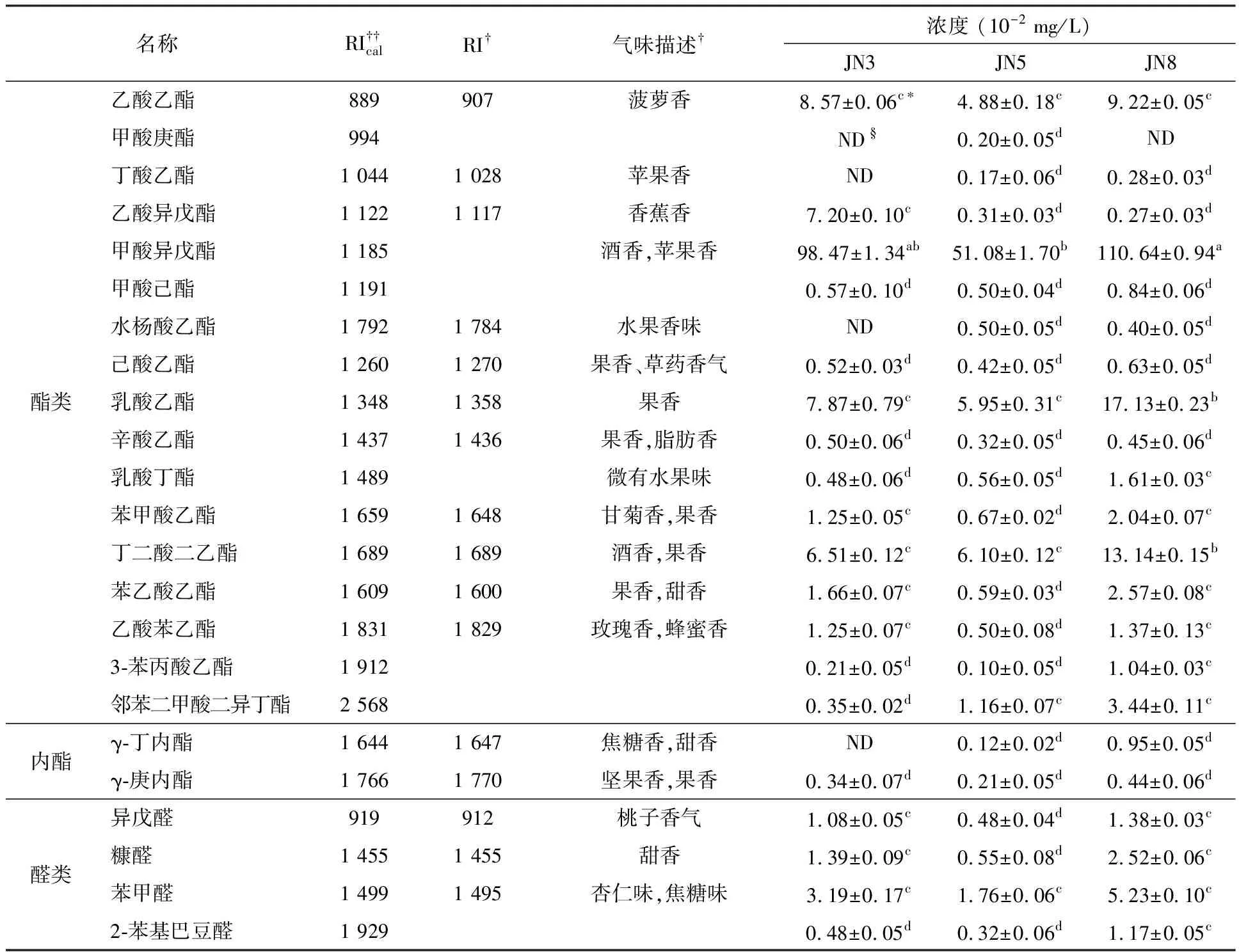
表1 不同酒齡黃酒中揮發性風味物質含量
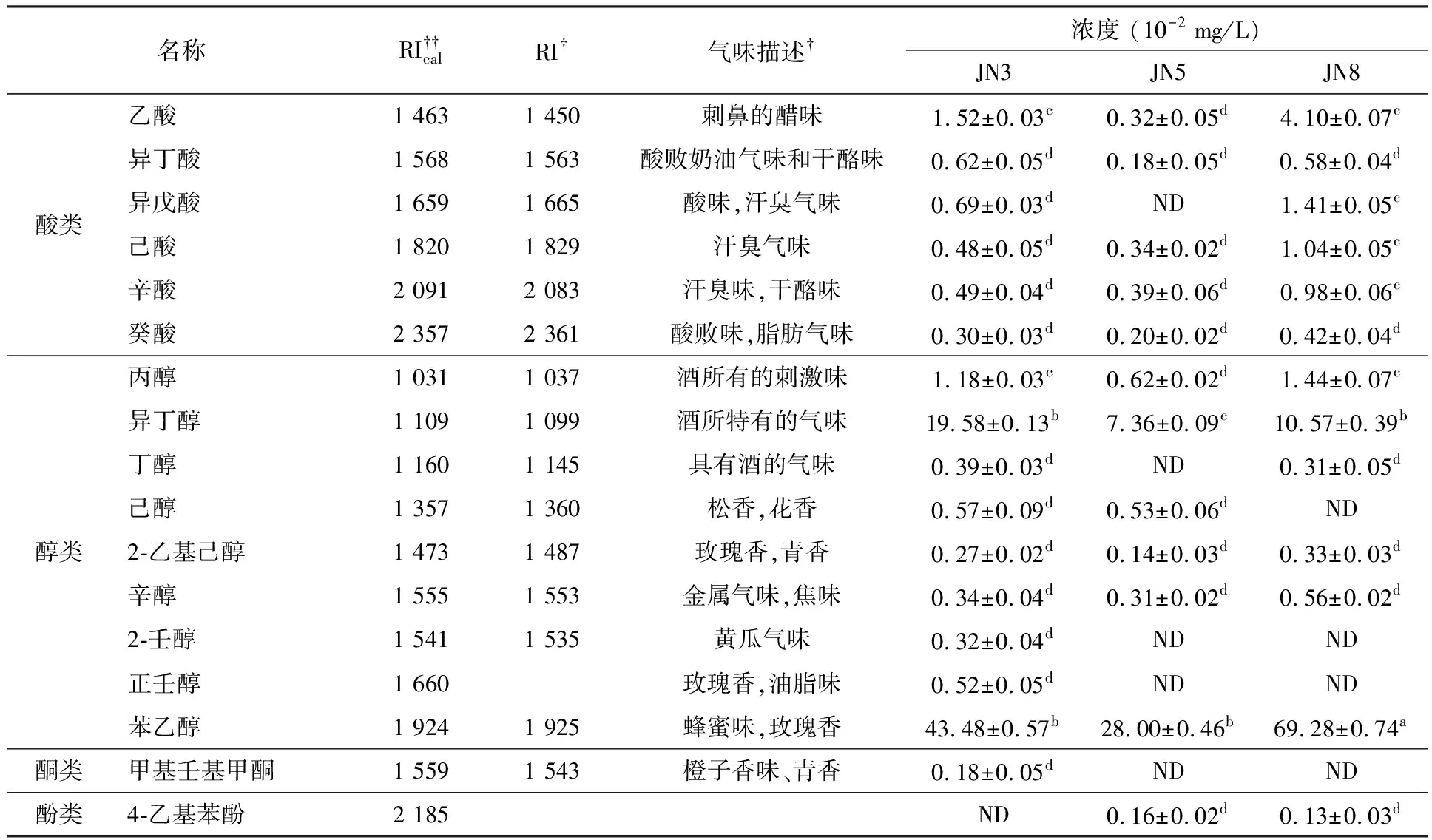
(續)表1
??RIcal是根據正構烷烴混標(C7-C30)計算得出.
?來自http://www.flavornet.org/flavornet.html,及參考文獻[11],保留指數(RI)根據C20M柱查得.
*不同的小寫字母表示具有顯著性差異(p< 0.05).
§未檢測出.
3種酒齡黃酒共鑒定出17種酯類物質.酯類物質一般都能提供花香和水果香韻.在所有酯類中甲酸異戊酯含量最高,各占據著對應酒齡黃酒總酯類物質含量的72.72%、69.02%和67.03%.JN3中其他含量較高的酯類有乙酸乙酯、乳酸乙酯、乙酸異戊酯和丁二酸二乙酯.JN5中17種酯類都有檢測到,除甲酸異戊酯外,丁二酸二乙酯、乳酸乙酯和乙酸乙酯含量比較高.JN8中其他主要酯類有乳酸乙酯、丁二酸二乙酯和乙酸乙酯.有研究表明酯類物質主要是由酒中的酸類物質與醇發生酯化反應生產的[12-13],這可能也是3種黃酒中乙酯類物質種類眾多的原因.當然酵母菌和其他微生物在發酵過程中也會產生酯類物質[14].
醛類在低濃度時會有果香味,但是當在高濃度時(>200 mg/L)[15]會使酒變的“平淡(flatness)”.3種酒齡黃酒中共檢測到4種醛類化合物:異戊醛、糠醛、苯甲醛和2-苯基巴豆醛.其中苯甲醛含量最高,分別占JN3、JN5、JN8中總醛類含量的51.95%、56.95%、50.78%.苯甲醛是一種具有令人愉悅的杏仁氣味的物質.目前認為醛類一般來自釀酒微生物的代謝作用,前體物質可能是不飽和脂肪酸和氨基酸[9,14].
JN3和JN8中都檢測出6種酸,JN5中檢測出5種酸.JN8的酸類物質濃度最高,達到8.53×10-2mg/L,而在JN5中最低,為1.43×10-2mg/L.在JN3和JN8中乙酸的濃度相對較高,分別為1.52×10-2mg/L和4.10×10-2mg/L,與其他酸類具有顯著性差異(p< 0.05),而JN5中各種酸類的濃度沒有顯著性差異(p< 0.05).短鏈酸在適當的濃度時可以為黃酒提供良好的氣味,但是濃度過高時則可能產生不良風味,是黃酒出現類似酸敗的氣味,降低黃酒品質.
醇類物質是黃酒中一類非常重要的揮發性成分,共有10種醇類被檢測到.醇類物質中苯乙醇和異丁醇有很高的含量,這兩種物質能為黃酒帶來花香和酒的特有香味.在JN5酒樣中沒有檢測到丁醇、2-壬醇和正壬醇,在JN8酒樣中沒有檢測到己醇、2-壬醇及正壬醇,而在JN3樣品中10種醇類均有檢測到,這可能是因為黃酒的陳化過程中醇類物質參與多種化學反應使其種類及含量發生變化.醇類物質主要來自釀酒過程中的酒精發酵[9].醇類物質對黃酒的風味的影響主要取決于其種類和含量.并且醇類的濃度低于300 mg/L時可以對酒體風味產生較好的影響[16].
內酯、酮類和酚類檢測到的物質種類較少,各有2種、1種和1種,其相對含量也比較低.其中甲基壬基甲酮與酒的溫潤細膩感,特別是在香味持久感方面有重要作用[9].
2.2 嗅覺閾值及OAV值
閾值的測定是由經過篩選的嗅辨員使用AC′Scent嗅辨儀測得,再根據黃酒中揮發性物質含量即可得到它們的OAV值,結果見表2.
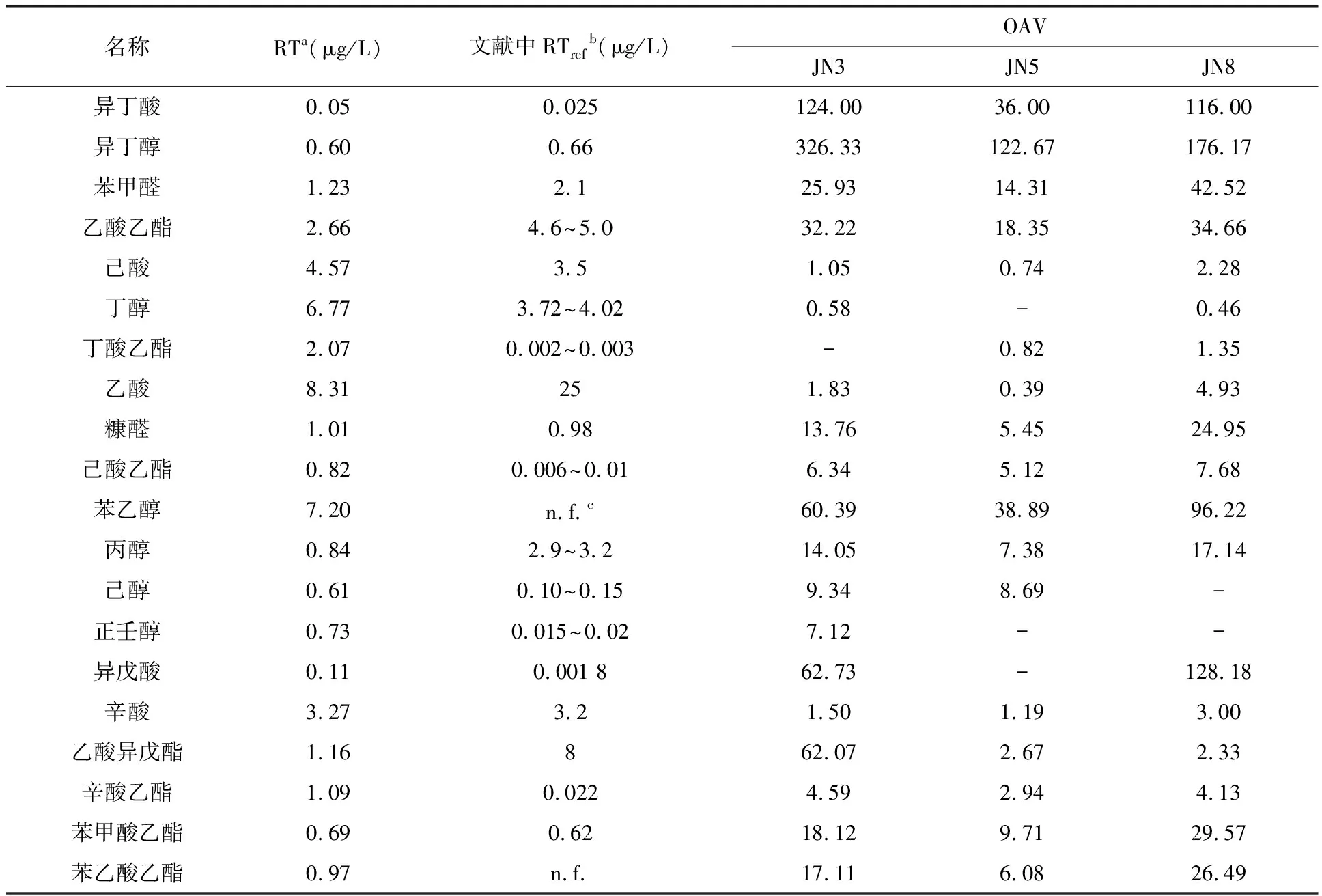
表2 揮發性風味物質嗅覺閾值和其香氣活力值
a.識別閾值(RT); b.見文獻[17]; c.未找到
表2中列出了文獻中報道的識別閾值.通過將本實驗測得閾值與以前報道閾值對比可以發現,有些物質的測定識別閾值與文獻中比較一致,比如糠醛、異丁醇,它們測定的識別閾值分別為1.01 μg/L、0.60 μg/L,文獻中的閾值分別為0.98 μg/L和0.66 μg/L;但是大部分物質的識別閾值與文獻報道值存在較大差別.這種差別可能是因為不同的分析方法導致的.
從表2的結果可以看出,只有JN3、JN8中的丁醇和JN5中的己酸、丁酸乙酯、乙酸的OAV值小于1,其他揮發性風味物質OAV值是大于1的,這表明它們可以被人們嗅聞到,而且OAV值越大,其對嗅覺產生的刺激越強烈.這也是金色年華能呈現強烈香韻的原因之一.在3種酒齡的金色年華中異丁醇都具有最高的OAV值,分別達到326.33、122.67和176.17,可以推斷異丁醇為金色年華基本香韻物質之一.但是,并不是OAV值低于1的揮發性風味物質就對黃酒香韻完全沒有影響,它們也可以有一些比較弱的作用.總體來說,JN3中主要揮發性風味物質:異丁醇(326.33)、異丁酸(124.00)、異戊酸(62.73)、乙酸異戊酯(62.07)、苯乙醇(60.39)、乙酸乙酯(32.22);JN5中主要揮發性風味物質:異丁醇(122.67)、苯乙醇(38.89)、異丁酸(36.00)、乙酸乙酯(18.35)、苯甲醛(14.31)、苯甲酸乙酯(9.71);JN8中主要揮發性風味物質:異丁醇(176.17)、異戊酸(128.18)、異丁酸(116.00)、苯乙醇(96.22)、苯甲醛(42.52)、乙酸乙酯(34.66).從表2中可以發現雖然3種酒齡黃酒的主要揮發性風味物質種類上沒有太大區別,但是各種物質的OAV值相差較大,通過這些物質的相互作用,勢必會對不同酒齡黃酒的基本香味產生重要影響.
3 討 論
對酒類揮發性風味物質的提取方法有很多種:同時蒸餾萃取、固相微萃取、溶劑萃取等,但頂空固相微萃取(HS-SPME)無疑是操作最簡單、樣品用量最少的一種.通過SPME-GC-MS分析檢測了3種酒齡的金色年華黃酒,共檢測出41種物質.從GC-MS的結果來看3種酒齡黃酒在揮發性風味物質的種類方面沒有太大區別,都是以酯類、醇類、酸類為主.
AC′Scent嗅辨儀在近些年來被用于測定揮發性風味物質的嗅覺閾值,在本研究中測定的閾值和文獻中有所差別的主要原因是使用了不同方法和設備.結合揮發性風味物質的濃度和閾值計算出每個香味物質的香氣活力值,這樣就可以更加準確地判斷出不同酒齡的金色年華中主要呈香物質,而且可以發現3種酒齡的金色年華在關鍵呈香物質上有差別.但是,值得注意的是,目前測定香味物質的嗅覺閾值都是在單一物質存在的情況下進行,而實際情況是每種樣品中都存在著數量眾多的香味物質,這些物質會彼此影響,使得它們的閾值與單獨測定時可能不同.
參考文獻:
[1] FAN W,XU Y.Characteristic Aroma Compounds of Chinese Dry Rice Wine by Gas Chromatography-Olfactometry and Gas Chromatography-Mass Spectrometry[C].Washington,DC,American Chemical Society,2012:277-301.
[2] MO X,XU Y,FAN W.Characterization of aroma compounds in Chinese rice wine Qu by solvent-assisted flavor evaporation and headspace solid-phase microextraction[J].Journal of agricultural and food chemistry,2010,58(4):2462-2469.
[3] SHEN F,YING Y,LI B,et al.Multivariate classification of rice wines according to ageing time and brand based on amino acid profiles[J].Food Chemistry,2011,129(2):565-569.
[4] LUO T,FAN W,XU Y.Characterization of Volatile and Semi-Volatile Compounds in Chinese Rice Wines by Headspace Solid Phase Microextraction Followed by Gas Chromatography-Mass Spectrometry[J].Journal of the Institute of Brewing,2008,114(2):172-179.
[5] CAO Y,XIE G,WU C,et al.A Study on Characteristic Flavor Compounds in Traditional Chinese Rice Wine — Guyue Longshan Rice Wine[J].Journal of the Institute of Brewing,2010,116(2):182-189.
[6] LASKA M,RINGH A.How big is the gap between olfactory detection and recognition of aliphatic aldehydes?[J].Attention,Perception,& Psychophysics,2010,72(3):806-812.
[7] MCGINLEY M A,MCGINLEY C M.Odor assessor performance to reference and non-reference odorants[C].Charlotte,NC,Water Environment Federation,2010:240-251.
[8] JOHNSTON T,HIGGINS M,BRANDT R,et al.,Effect of Amendment Addition on Biosolids Odors based on Gas Chromatography Analysis and Odor Panel Observations[C].Chicago,Water Environment Federation,2009:607-626.
[9] XIAO Z,YU D,NIU Y,et al.Characterization of aroma compounds of Chinese famous liquors by gas chromatography-mass spectrometry and flash GC electronic-nose[J].Journal of Chromatography B,2014,945:92-100.
[10] SHEN F,LI F Z ,LIU D L,et al.Ageing status characterization of Chinese rice wines using chemical descriptors combined with multivariate data analysis[J].Food Control,2012,25(2):458-463.
[11] 孫寶國.食用調香術[M].2版,北京:化學工業出版社,2010.
[12] ERTEN H,TANGULER H,CAKIROZ H.The Effect of Pitching Rate on Fermentation and Flavour Compounds in High Gravity Brewing[J].Journal of the Institute of Brewing,2007,113(1):75-79.
[13] FAN W,QIAN M C.Headspace Solid Phase Microextraction and Gas Chromatography?Olfactometry Dilution Analysis of Young and Aged Chinese ″Yanghe Daqu″ Liquors[J].Journal of Agricultural and Food Chemistry,2005,53(20):7931-7938.
[14] 羅濤,范文來,徐巖,等.我國江浙滬黃酒中特征揮發性物質香氣活力研究[J].中國釀造,2009,28(2):14-19.
[15] GIL M,CABELLOS J M,ARROYO T,et al.Characterization of the volatile fraction of young wines from the Denomination of Origin ″Vinos de Madrid″(Spain)[J].Analytica Chimica Acta,2006,563(1):145-153.
[16] NOGUEROL-PATO R,GONZLEZ-RODRGUEZ R,GONZLEZ-BARREIRO C,et al.Influence of tebuconazole residues on the aroma composition of Mencía red wines[J].Food Chemistry,2011,124(4):1525-1532.
[17] L J VAN GEMERT Z.Odour Thresholds:Compilations of odour threshold values in air,water and other media (Edition 2003)[M].Utrecht,the Netherlands:Oliemans Punter & Partners BV,2003.

