哺乳動物中RNA干擾沉默基因表達的研究進展
曹騰威谷凌云黃和,3高振酈明芳
(1.南京工業大學生物與制藥工程學院,南京 211816;2.東南大學附屬江陰醫院,江陰 214400;3.材料化學工程國家重點實驗室,南京 210009;4.南京醫科大學第一附屬醫院,南京 210029)
哺乳動物中RNA干擾沉默基因表達的研究進展
曹騰威1谷凌云2黃和1,3高振1酈明芳4
(1.南京工業大學生物與制藥工程學院,南京 211816;2.東南大學附屬江陰醫院,江陰 214400;3.材料化學工程國家重點實驗室,南京 210009;4.南京醫科大學第一附屬醫院,南京 210029)
RNA干擾及相關基因沉默導致的代謝通路變化已經徹底改變了人們對基因調控的理解。基因沉默技術已經被用來作為一種研究工具來控制某些細胞基因的表達,特異的siRNA導入不同的細胞需要不同的轉染載體才能達到最大的轉染效率,并且不會產生較大的細胞毒性。近年來尤其是碳納米管等新型納米材料載體的應用拓展了人們對傳統脂質體和病毒載體的認識。首先介紹RNA干擾技術及其發展歷程,隨后對利用幾種不同的載體來設計和進行RNA干擾試驗進行了比較,最后對最初的脂質體到生物病毒再到高分子納米材料介導的RNA干擾在疾病的治療和臨床診斷進行了展望。
RNA干擾 小干擾RNA 基因沉默 轉染 碳納米管
隨著人類基因組計劃的完成,越來越多生物的全基因組被測序,人們對功能基因組學的研究越來越深入。研究思路通常從兩個方面展開,一是增強某種基因表達,研究過表達后引起的一系列機理;二是減弱或者終止其表達,進而推測該基因相應的生理功能。基于后者針對性很強的特點,逐漸發展成一種新技術——基因沉默(Gene silencing)。
從低等原核生物到高等真核生物,基因沉默技術的廣泛應用推動了基因組學研究的革命化進程。在微生物代謝工程中,提高目標產物的產量、純度以及誘導出新的有價值產物都是人們亟待解決的問題,特定基因的敲除技術的應用給人們帶來了解決問題的希望。人們通過不斷改造工程菌株,改變其代謝途徑,阻斷其代謝旁路,使其利于向目標產物
積累的方向進行,以獲得的大量的代謝產物。因此可以利用轉座子突變系統、同源重組系統或者自殺載體[1]進行基因位點的定向敲除。在真核生物中,RNA干擾(RNA interference)作為基因沉默的另一種途徑操縱著許多細胞功能。尤其在哺乳動物中它能夠調控基因的表達,分析信號傳導基因間相互作用,阻斷病變基因信號通路。本研究就通過多種方法進行RNA干擾細胞引起基因沉默展開綜述,并且重點闡述了新型高分子材料可以作為一種高效載體攜帶小核酸分子進入細胞,為RNA干擾的研究提供了新的研究思路。
1 RNA干擾
1995年,Guo和Kemphues[2]在秀麗隱桿線蟲Caenorhabditis elegans中發現了RNA干擾現象。直到1998年,Fire和Mello等[3]通過注射與秀麗隱桿線蟲機體同源基因(靶基因)的雙鏈RNA,阻斷了靶基因的表達,并將其命名為RNA干擾。隨后關于RNA干擾現象的研究表明,在植物、果蠅、錐蟲、渦蟲等許多生物中都存在此種現象。1999年,Tuschl等[4]報道了在哺乳動物中也存在RNA干擾現象。2001年,Ketting等[5]研究人員提出,只有22個核苷酸的siRNA才能特異性的阻斷dsRNA(double-strand RNA)并在體內發現了一個將dsRNA分解為siRNA的酶(DICER)。
RNA干擾技術已經成功的從植物研究發展到哺乳動物的相關研究,并且逐步被應用到醫學上一些頑疾的治療研究。Lee等[6]用siRNA抑制艾滋病病毒HIV的一些基因,如p24、vif、nef抑制和HIV特異結合的細胞表面受體CD4和CD8a或輔助受體CXCR4/CCR5或病毒結構Gag蛋白的表達,阻礙HIV感染細胞。Weber等[7]利用聚乙亞胺和聚乙二醇融合后可提高siRNA的穩定性和減少其毒性,證明其可作為藥物作用淋巴細胞,并最終測定該共聚物的生物學效果:靶向干擾了HIV的nef。
對于RNA干擾的作用機制目前認為有兩種:一種是存在于線蟲、真菌和植物中依賴RNA聚合酶(RNA dependent RNA polymerase,RdRP)的干擾途徑;另一種是存在于果蠅和哺乳動物中不依賴RdRP的干擾途徑[8]。RNA干擾具有4個分子生物學特征:典型的轉錄后基因沉默;高效沉默目的基因表達;高度序列特異性;dsRNA具有擴散性。只要在生物細胞內產生dsRNA,就可以對特定的基因實施轉錄后基因表達的沉默。生化和遺傳研究表明,RNA干擾包括起始階段、效應階段和擴增階段。在起始階段,小分子RNA被Dicer酶切割成21-23 bp長的siRNA。研究表明,該Dicer酶是RNase III家族中特異識別雙鏈RNA的一員,它能以一種依賴ATP的方式逐步切割由外源導入或者由轉基因、病毒感染等各種方式引入的雙鏈RNA,將RNA降解為19-21 bp的雙鏈RNA。在效應階段,siRNA和一個核蛋白粒子(RNPs)結合,分別形成siRNA核蛋白復合物和miRNA核蛋白復合物,然后重排為RNA誘導沉默復合物(RNA-induced silencing complex,RISC)。激活RISC是一個依賴ATP siRNA解鏈的過程。RISC中的siRNA引導沉默復合物識別同源靶mRNA,然后RNA解旋酶使靶向mRNA與siRNA正義鏈換位,在ATP的參與下,RNase在距離siRNA 3'端12個堿基的位置切割mRNA,并使其降解,從而達到轉錄后基因沉默的結果。在擴增階段,由于線蟲、真菌和植物以及果蠅和哺乳動物各自的RdRP的干擾途徑不同,在大部分真菌、線蟲和植物中主要以siRNA為引物,目的mRNA為模板合成大量的dsRNA,后者又可作為RISC的底物而被降解形成新的siRNA,新siRNA又可以進入上述循環,使信號放大(圖1)[9]。
2 siRNA的設計與制備
siRNA的結構和功能之間存在相關性。在哺乳動物細胞中,RNA干擾是以21-23 nt的siRNA為媒介的,這種siRNA具有5'末端的磷酸基,3'末端的羥基和2個突出的單鏈核苷酸[10,11]。這種特殊的3'端有突出的非配對堿基結構有利于提高siRNA的穩定性,使其在細胞內可穩定存在3-4 d[12]。有許多方法可以提高制備高效siRNA的可能性,其中關鍵的方法就是靶基因的位點的選取。在基因庫中尋找靶向基因的mRNA序列,并從開放閱讀框ORF起始密碼AUG后的第100-200 nt開始尋找AA(N19)UU序列,其中N19為任意19 nt的mRNA核苷酸序列,然后設置選定序列中的G+C比例為30%-60%,
對確定的序列用NCBI的Blast(www.ncbi.nlm.nih. gov/BLAST)搜索。搜索結果中和其他基因有16個以上堿基同源序列的要被篩除,以確定所作用靶基因是唯一的[13]。這樣得到的siRNA特異性很高,能特異結合目的mRNA,誘使轉錄后基因沉默。

圖1 RNA干擾機理模式圖[9]
以往傳統的siRNA設計原則包括:序列中G+C所占比例;siRNA雙螺旋與靶基因的熱力學參數等。隨著研究的深入,siRNA設計原則逐漸規范化。Ui-Tei等[14]提出4個設計高效siRNA指標:反義鏈的5'末端是A/U;正義鏈的5'末端是G/C;反義鏈5'末端的1/3富含AU;不含GC序列長度超過9個bp。最近El-Lakkani等[15]研究如何從哺乳動物基因篩選出高效的siRNA位點。他們把3 734個siRNA按照高、中、低效率分成3組,運用在線數據庫分析設計出更高效率的siRNA方法。堿基的位置和熱力學穩定性關系到高效率siRNA的設計過程,El-Lakkani通過13種設計原則(A/U和C/G位置、ΔG)發現設計出高效率siRNA最關鍵是反義鏈5'和3'末端結合能的大小。由于siRNA設計方法的逐步完善,生物學家們已經開發出許多針對性的算法和在線軟件。其中siDirect(http://design. RNAi.jp/)就是一款設計最大靶向特異性siRNA的在線軟件,它利用BLAST篩除掉交叉雜合子來避免產生有脫靶效應的siRNA。然而與其他在線設計軟件一樣(siRNA target finder, siDEDIGN center)siDirect也不能避免BLAST搜索的局限性,所以更精確軟件有待開發來確保靶向干擾的高效特異性[16]。2013年,Boudreau等[17]介紹了一個新的siRNA設計工具siSPOTR。利用公認的siRNA數據完成超過50個微陣列芯片試驗,在此基礎上建立了預測潛在脫靶效應的生物信息學方法,并基于此種方法開發出具有特異的siRNA設計算法和在線軟件。脫靶效應(假陽性率和毒性反應)是基因沉默技術的一大難題,尤其在RNA干擾基因治療中。與其他的設計軟件不同,siSPOTR可以生成很多的低脫靶概率的序列,提供了更寬的平臺來讓用戶篩選。與其他的軟件相比,Boudreau等證明了這種方法設計的序列能降低脫靶概率5%-10%。
3 siRNA的傳遞載體
siRNA是RNA干擾作用細胞的最終形式與載體,所以各種方法的最終目的就是獲得高效特異的siRNA,并且成功使其在細胞內發揮作用,使靶基因沉默。目前可通過5種方法獲得siRNA:化學合成、體外轉錄、RNA酶類物質(RNaseⅢ和Dicer)降解dsRNA、siRNA表達載體或者病毒載體、siRNA表達框架。前3種是通過體外制備然后再導入到靶細胞中,后2種是基于具有合適啟動子的載體或轉錄元件在哺乳動物或細胞中轉錄生成siRNA。獲得特異性的目標siRNA后,無論通過哪種傳遞載體,最終的目的是使siRNA作用于靶基因。由于轉染效率與轉染試劑、細胞種類、細胞生長狀態、轉染方法及siRNA濃度等條件密切相關[18]。所以把siRNA高效地導入受體細胞是RNA干擾作用的瓶頸步驟。另外RNA作為生物大分子一般不容易透過細胞膜進入胞內,尤其是一些非分化細胞、原代細胞和干細胞,所以尋找一種合適的轉染方式極為關鍵。
谷凌云等[19]的研究是從細胞水平上特異沉默靶基因后探究心房結構重構與房顫的關系。以新生原代大鼠心房肌細胞為模型,對于原代這類難轉染的細胞有文獻報道用化學合成的方法獲得siRNA,并和轉染試劑TransIT-TKO以及Opti-MEM無血清培養基共孵育轉染原代心房肌細胞,siRNA轉染濃度隨著細胞密度大小從50 nmol/L升高到250 nmol/L不等。我們采用100 nmol/L的siRNA并按照圖2的流
在給排水工程施工過程中經常會出現各種不同類型的問題,這會對給排水工程的質量造成不良影響,進而都會其應用性能產生影響,可見,在給排水工程施工中,做好像施工管理意義重大。
程成功達到了較高的轉染效率[20]。
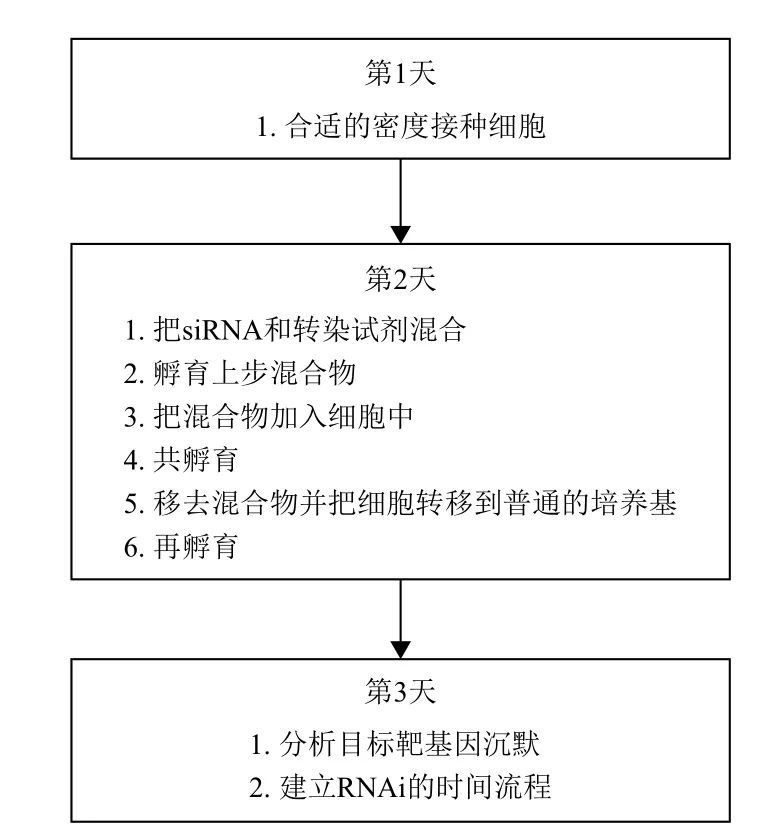
圖2 用化學合成siRNA進行的典型RNAi試驗示意圖[20]
3.1 脂質體和病毒
由于siRNA相對分子質量較大(14 000以上)和帶有較高的負電荷,不能自發穿過細胞膜進入細胞內[21]。脂質體帶正電,可以靠靜電作用結合到DNA的磷酸骨架上以及帶負電的細胞膜表面。因此帶負電的DNA自動結合到帶正電的脂質體上,形成DNA-陽離子脂質體復合物。例如,一個約5 kb的質粒可以結合2-4個脂質體,被俘獲的DNA就會隨著質粒載體導入培養的細胞。
文獻報道陽離子脂質體有Invitrogen公司的Lipfectamine 2000,Oligofectamine和 Lipofectamine RNAiMAX[22]。比較了這3種陽離子脂質體在間充質干細胞和新生干細胞中轉染Oct4的siRNA時的效率。結果顯示,Lipofectamine RNAiMAX是一種將siRNA傳遞到人胚胎干細胞中完美的轉染試劑,并且它較低的細胞毒性不會影響到干細胞的全能性。李杰等[23]應用脂質體siPORT NeoFX介導從5-30 nmol/L,4個梯度濃度的CY-Negative siRNA轉染心肌細胞。轉染24 h后檢測轉染效率和細胞凋亡率,測得siRNA在30 nmol/L時平均轉染率達76.67%,故siPORT NeoFX轉染原代心肌細胞在siRNA濃度30 nmol/L時達到最佳效果。同樣,王玉潔等[24]也應用Lipofectamine RNAiMAX,Lipofectamine 2000和DharmaFECT1轉染試劑介導siRNA轉染原代肝癌細胞篩選最佳的轉染試劑,DharmaFECT1為Thermo Scientific公司的一種全新的轉染試劑。通過Realtime PCR檢測出RNAiMAX轉染效率最高,并用細胞增殖(MTT法)檢測結果表明RNAiMAX對原代肝癌細胞沒有表現出細胞毒性(表1)。

表1 不同的靶細胞和轉染試劑間比較
雖然對于大部分真核細胞,脂質體介導的siRNA的轉染優點很多,但轉染多以瞬間表達為主,最長也不過幾天。并且在某些種類的細胞轉染率很低,即使在同種細胞中,轉染率也大不相同。然而病毒可以攜帶一些大的片段DNA。如腺病毒構建系統[27]AdEasy system載體可以容納7.5 kb外源DNA。所以病毒被廣泛用于轉染原代細胞,干細胞和非分化細胞。
腺病毒(Adenovirus)是一種沒有包膜的線狀雙鏈DNA,它在核內以神經元細胞的形式復制,存在多種AV血清型。目前構建的絕大多數是基于血清型2和5,通過轉基因的方法取代E1或E3基因,降低病毒的復制能力。腺病毒載體能夠在增殖和非增殖細胞中高效傳遞和表達基因[28]。神經膠質瘤在成年人神經系統中是一種最常見的腫瘤,多形性成膠質細胞瘤屬于甲等4級,一種公認的致病原因是體內過表達堿性成纖維生長因子(Fibroblast growth factor,bFGF)。Liu等[29]用腺病毒載體攜帶bFGF siRNA(Ad-bFGF-siRNA)作用于神經膠質瘤細胞阻斷bFGF的表達,從而抑制腫瘤增殖。慢病毒
基因異常表達是導致許多疾病的主要原因。RNA干擾技術的終極目標之一就是開發新一代的藥物,使之靶向作用相關疾病的異常mRNA。目前,許多利用RNA干擾的基因治療正在進行臨床試驗。例如,抗病毒、抗腫瘤和遺傳性疾病。近來,Sakurai等[30]運用一種對PH敏感由陽離子脂質YSK05構成的脂質體MEND(Multifunctional envelope-type nanodevice)傳遞siRNA進入腫瘤組織中。腫瘤組織中聚乙二醇化的YSK-MEND可以將siRNA濃度從0.007 9%提高到1.9% ID/g,從而使目標基因表達降低了50%。他們在褐瘤小鼠體內通過瘤內注射試驗證實了包含YSK05的MEND比普通的商業化轉染試劑(Lipo2000)具有更好的基因沉默能力。此外,由于具有合適的PKa,YSK05在血液呈中性狀態,所以MEND-YSK05僅需要少量的聚乙二醇修飾就可以充分發揮效應,并且非常適合在腫瘤組織中傳遞siRNA。
3.2 碳納米管
在很長一段時間內,陽離子脂質體、病毒一直是人們使用的最普遍的siRNA轉運載體。但是在基因治療和RNA干擾靶向藥物的應用中仍然存在缺陷。對于原代細胞、免疫細胞脂質體的轉染效率還是不夠高[31]。雖然病毒載體具有轉染效率高的優點,但是過程復雜,周期比較長,還可能引發細胞發生突變及免疫反應。另外,由于siRNA在體內穩定性差容易被核酸酶降解、難以穿過由磷脂雙分子層構成的細胞膜等問題[32]。因此,一個更合理的運載系統便成為人們研究的熱點(表2)。

表2 非脂質體轉染途徑比較
在過去的二十幾年里見證了納米科技在基因治療領域的飛速發展,與此同時更多的載體被用來提高基因轉運的效率。包括陽離子脂質體、高分子聚合物、樹突狀高分子、多肽類和碳納米管被開發作為基因治療的載體[33]。Wang等[34]闡述了石墨烯和氧化石墨烯的生物學功能以及在生物工程上的應用。碳納米管(Carbon nanotubes,CNT)屬于碳同素異形體的富勒烯家族,是由一系列碳原子經sp2雜化形成的同軸中空管狀結構,碳納米管按石墨烯片的層數可分為:單壁碳納米管(SWNTs)和多壁碳納米管(MWNTs)。由于其鈉針狀結構使之更容易直接穿過質膜就像獨立的內吞作用一樣,并且穿膜后不會誘導細胞凋亡,此外,碳納米管結構具有非常大的比表面積,使之很容易與配體結合修飾功能化。可以在紅外光區監測到碳納米管的拉曼光譜和熒光信號,因此可以利用這種特性追蹤碳納米管攜帶的藥物在體內代謝情況。近年來,碳納米管在分子生物學、生物醫學、細胞生物學領域的研究日益增多,已經廣泛被用于體內外的藥物、抗原和核酸的傳遞。
Bianco等[35]首先運用碳納米管這一新的基因傳遞載體系統,并用Prato反應共價修飾碳納米管。他們還發現DNA-CNT復合物不會對那些被激活或未被激活的淋巴細胞表現出促有絲分裂和毒性,而這與其他非病毒基因載體相比有較大的不同。Kam等[36]把聚乙二醇化的磷脂分子與二硫鍵相連,磷脂分子的尾部非特異性吸附結合于碳納米管表面。當用這種方法構建的復合物進入溶酶體后促使酶解從而釋放siRNA,進而有效地干擾目的基因的表達,而且沉默效率比陽離子脂質體引起的沉默效率還高。Yang等[37]利用陽離子輔助聚合納米粒子包裝siRNA,使其能進行高效傳遞,進而抑制肝癌細胞中PLK1的表達,并且還能顯著誘導肝癌細胞的凋亡。Podesta等[38]通過氨基加成的方法功能化多壁碳納米管(MWNT-NH3+),使之復合siTOX siRNA
干擾癌基因的表達。他們用陽離子脂質體傳遞系統(DOTAP)和功能化的多壁碳納米管(f-MWNTs)建立人的肺癌移植瘤小鼠模型。試驗結果顯示,試驗組小鼠的腫瘤生長得到有效抑制,且小鼠存活期得到明顯延長。他們也是首次在體內試驗中把碳納米管與陽離子脂質體兩種轉運siRNA載體的轉運效率進行對比,相比于脂質體碳納米管攜帶siRNA更能溫和地進入腫瘤細胞。Al-Jamal等[39]把攜帶caspase-3 siRNA化學功能化的碳納米管通過三維定位注射方法導入到大腦基因區,然后在ET-1誘導的中風嚙齒動物大腦皮質區發現神經退變的緩解和功能性恢復。這是第一次利用碳納米管把siRNA導入中樞神經系統。所以碳納米管作為siRNA轉運載體在基因治療領域的研究逐步被人們所認識。
碳納米管介導的基因傳遞在體內治療仍處于初始階段,目前所有的體內試驗報道都是關于局部瘤內注射。此外,對環境和健康潛在的毒性已經成為一個亟待解決的問題。系統地研究DNA/siRNA-CNT復合物的穩定性、血循環和藥代動力學,對碳納米管藥物在體內吸收、沉積、代謝和排泄一系列路徑作一個長遠研究,只有解決這些問題,才可能建立一個關于碳納米管藥物的GMP規范,使之更廣泛的運用于臨床治療研究[40]。
4 結語
在過去的多年中,細胞通過沉默同源基因來應答dsRNA這種方式揭示了一種新的生物學管理范式。隨著RNA干擾途徑的闡明,人們把RNA干擾作為生物新技術應用到基礎和臨床研究。siRNA、質粒、病毒編碼的shRNA作為一種常規化的試劑已經被納入生物學家的“工具箱”中,用以下調目的基因轉錄后的表達。早前成功的報道在小鼠模型中體內RNA干擾人的致病基因[43]。未來RNA干擾技術應用將會使高通量篩選多重siRNAs成為可能。
從最初的脂質體到生物病毒再到高分子納米材料,我們闡述了不同的RNA干擾載體的特性。尤其是碳納米管、硅納米管,不僅可以作為核酸的轉運載體甚至可以攜帶藥物用于疾病治療,然而這些納米材料的生物相容性是亟待解決的問題。人們通過偶聯不同的生物活性分子或功能化修飾使碳納米管微觀結構、溶解性、穿透力及生物相容性得到很大的改善。
RNA干擾不僅推動了后基因組時代的發展,在發現疾病相關基因、疾病治療和藥物篩選研發方面也起到了積極的作用。用RNA干擾制備藥物,其思路是根據病原體如病毒、細菌等的致病基因序列,以及生物體內與疾病發生相關的基因序列,設計和制備與這些基因序列同源的雙鏈RNA。再將這些RNA轉入動植物內使有關的疾病基因靶向“沉默”,從而達到治療疾病的效果。目前的主要問題是找到一種高效低毒用于人體的轉運載體,它既能攜帶靶基因siRNA,又不引起人體免疫反應。盡管如此,人們依然可以預測與其他基因技術一樣,siRNA與RNA干擾技術將在不久的將來會在基因治療和基因應用中發揮極大的作用,并將給整個生物理論帶來巨大而深遠的影響。
[1]Choi KH, Kim KJ. Applications of transposon-based gene delivery system in bacteria[J]. J Microbiol Biotechnol, 2009, 19(3):217-228.
[2]Guo S, Kemphues KJ. par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed[J]. Cell, 1995, 81(4):611-620.
[3]Fire A, Xu SQ, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391(6669):806-811.
[4]Tuschl T, Zamore PD, Lehmann R, et al. Targeted mRNA degradation by double-stranded RNA in vitro[J]. Genes & Development, 1999, 13(24):3191-3197.
[5]Ketting RF, Fischer SEJ, Bernstein E, et al. Dicer functions in RNA interference and in synthesis of small RNA involved in developmental timing in C. elegans[J]. Genes & Development, 2001, 15(20):2654-2659.
[6]Lee NS, Dohjima T, Bauer G, et al. Expression of small interfering RNAs targeted against HIV-1 rev transcripts in human cells[J]. Nature Biotechnology, 2002, 20(5):500-505.
[7]Weber ND, Merkel OM, Kissel T, et al. PEGylated poly(ethylene imine)copolymer-delivered siRNA inhibits HIV replication in vitro[J]. Journal of Controlled Release, 2012, 157(1):55-63.
[8]Hannon GJ. RNA interference[J]. Nature, 2002, 418(6894):244-251.
[9]Mello CC, Conte D. Revealing the world of RNA interference[J]. Nature, 2004, 431(7006):338-342.
[10]Elbashir SM, Harborth J, Weber K, et al. Analysis of gene function in somatic mammalian cells using small interfering RNAs[J]. Methods, 2002, 26(2):199-213.
[11]Mohr S, Bakal C, Perrimon N. Genomic screening with RNAi:results and challenges[J]. Annual Review of Biochemistry, 2010, 79(6):37-64.
[12]石智, 符立梧. RNAi 及其在腫瘤研究中的應用[J]. 生物化學與生物物理進展, 2004, 31(6):492-499.
[13]Harborth J, Elbashir SM, Bechert K, et al. Identification of essential genes in cultured mammalian cells using small interfering RNAs[J]. Journal of Cell Science, 2001, 114(24):4557-4565.
[14]Ui-Tei K, Naito Y, Takahashi F, et al. Guidelines for the selection of highly effective siRNA sequences for mammalian and chick RNA interference[J]. Nucleic Acids Research, 2004, 32(3):936-948.
[15]El-Lakkani A, Elgawad WHA, Sayed EA. Selection of highly efficient small interference RNA(SiRNA)targeting mammalian genes[J]. Journal of Biophysical Chemistry, 2013, 4(2):72-79.
[16]Naito Y, Yamada T, Ui-Tei K, et al. siDirect:highly effective, target-specific siRNA design software for mammalian RNA interference[J]. Nucleic Acids Research, 2004, 32(suppl 2):W124-W129.
[17]Boudreau RL, Spengler RM, Hylock RH, et al. siSPOTR:a tool for designing highly specific and potent siRNAs for human and mouse[J]. Nucleic Acids Research, 2013, 41(1):e9.
[18]Eguchi A, Meade BR, Chang YC, et al. Efficient siRNA delivery into primary cells by a peptide transduction domain-dsRNA binding domain fusion protein[J]. Nature Biotechnology, 2009, 27(6):567-571.
[19]谷凌云, 酈明芳, 曹騰威, 等. 脂聯素通過腺苷酸活化蛋白激酶抑制血管緊張素Ⅱ誘導的心房肌細胞肥大[J]. 中華心律失常學雜志, 2013, 17(5):371-375.
[20]Duxbury MS, Whang EE. RNA interference:a practical approach[J]. Journal of Surgical Research, 2004, 117(2):339-344.
[21]Bumcrot D, Manoharan M, Koteliansky V, et al. RNAi therapeutics:a potential new class of pharmaceutical drugs[J]. Nature Chemical Biology, 2006, 2(12):711-719.
[22]Zhao M, Yang H, Jiang X, et al. Lipofectamine RNAiMAX:an efficient siRNA transfection reagent in human embryonic stem cells[J]. Molecular Biotechnology, 2008, 40(1):19-26.
[23]李杰, 賈鈺華, 楊萍, 等. 脂質體介導化學合成 siRNA 轉染原代心肌細胞:篩選理想濃度[J]. 中國組織工程研究與臨床康復, 2010, 14(007):1239-1243.
[24]王玉潔, 吳韶菊, 吳芹. 篩選介導化學合成 siRNA 轉染原代肝癌細胞的最佳試劑[J]. 中國組織工程研究與臨床康復, 2011, 15(2):245-248.
[25]Park M, Youn BS, Zheng X, et al. Globular adiponectin, acting via AdipoR1/APPL1, protects H9c2 cells from hypoxia/reoxygenationinduced apoptosis[J]. PloS One, 2011, 6(4):e19143.
[26]鄧清華, 付世新, 劉國文, 等. siRNA 特異性抑制犢牛原代肝細胞 SREBP—1c 基因的表達[J]. 中國獸醫學報, 2011, 31(7):1050-1053.
[27]Luo J, Deng ZL, Luo X, et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J]. Nature Protocols, 2007, 2(5):1236-1247.
[28]Wang W, Ha CH, Jhun BS, et al. Fluid shear stress stimulates phosphorylation-dependent nuclear export of HDAC5 and mediates expression of KLF2 and eNOS[J]. Blood, 2010, 115(14):2971-2979.
[29]Liu J, Xu X, Feng X, et al. Adenovirus-mediated delivery of bFGF small interfering RNA reduces STAT3 phosphorylation and induces the depolarization of mitochondria and apoptosis in glioma cells U251[J]. Journal of Experimental & Clinical Cancer Research, 2011, 30(1):80-86.
[30]Sakurai Y, Hatakeyama H, Sato Y, et al. Gene silencing via RNAi and siRNA quantification in tumor tissue using MEND, a liposomal siRNA delivery system[J]. Molecular Therapy, 2013, 21(6):1195-1203.
[31]Liu Z, Winters M, Holodniy M, et al. siRNA delivery into human t cells and primary cells with carbon-nanotube transporters[J]. Angewandte Chemie International Edition, 2007, 46(12):2023-2027.
[32]Juliano R, Alam MR, Dixit V, et al. Mechanisms and strategies for
effective delivery of antisense and siRNA oligonucleotides[J]. Nucleic Acids Research, 2008, 36(12):4158-4171.
[33]Bates K, Kostarelos K. Carbon nanotubes as vectors for gene therapy:Past achievements, present challenges and future goals[J]. Advanced Drug Delivery Reviews, 2013, 65(15):2023-2033.
[34]Wang Y, Li Z, Wang J, et al. Graphene and graphene oxide:biofunctionalization and applications in biotechnology[J]. Trends in Biotechnology, 2011, 29(5):205-212.
[35]Pantarotto D, Singh R, Mccarthy D, et al. Functionalized carbon nanotubes for plasmid DNA gene delivery[J]. Angewandte Chemie, 2004, 116(39):5354-5358.
[36]Kam NWS, Liu Z, Dai H. Functionalization of carbon nanotubes via cleavable disulfide bonds for efficient intracellular delivery of siRNA and potent gene silencing[J]. Journal of The American Chemical Society, 2005, 127(36):12492-12493.
[37]Yang XZ, Dou S, Sun TM, et al. Systemic delivery of siRNA with cationic lipid assisted PEG-PLA nanoparticles for cancer therapy[J]. Journal of Controlled Release, 2011, 156(2):203-211.
[38]Podesta JE, Al-Jamal KT, Herrero MA, et al. Antitumor activity and prolonged survival by carbon-nanotube-mediated therapeutic siRNA silencing in a human lung xenograft model[J]. Small, 2009, 5(10):1176-1185.
[39]Al-Jamal KT, Gherardini L, Bardi G, et al. Functional motor recovery from brain ischemic insult by carbon nanotube-mediated siRNA silencing[J]. Proceedings of the National Academy of Sciences, 2011, 108(27):10952-10957.
[40]Cheung W, Pontoriero F, Taratula O, et al. DNA and carbon nanotubes as medicine[J]. Advanced Drug Delivery Reviews, 2010, 62(6):633-649.
[41]Liu B, Zhao L, Ma HZ, et al. Knockdown of MRP4 by lentivirusmediated siRNA improves sensitivity to adriamycin in adriamycinresistant acute myeloid leukemia cells[J]. Chinese Science Bulletin, 2012(1):1-8.
[42]Krajcik R, Jung A, Hirsch A, et al. Functionalization of carbon nanotubes enables non-covalent binding and intracellular delivery of small interfering RNA for efficient knock-down of genes[J]. Biochemical and Biophysical Research Communications, 2008, 369(2):595-602.
[43]Yokota T, Sakamoto N, Enomoto N, et al. Inhibition of intracellular hepatitis C virus replication by synthetic and vector-derived small interfering RNAs[J]. Embo Reports, 2003, 4(6):602-608.
(責任編輯 狄艷紅)
Research Progress of Gene Silencing by RNA Interfering Technology in Mammal
Cao Tengwei1Gu Lingyun2Huang He1,3Gao Zhen1Li Mingfang4
(1. College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing 211816;2. Jiangyin Hospital Affiliated to Southeast University,Jiangyin 214400;3. State Key Laboratory of Materials-Oriented Chemical Engineering,Nanjing 210009;4. The First Affiliated Hospital with Nanjing Medical University,Nanjing 210029)
Variation of metabolic pathways result from RNA interference and related RNA silencing pathways have revolutionized our understanding of gene regulation. Gene silencing has been used as a research tool to control the expression of specific genes in numerous experimental organisms. Importing the different cells with specific siRNA need different transfection reagent to achieve maximum transfection efficiency, and will not produce larger cell toxicity. In recent years, new nano-material such as carbon nanotubes exert interference effect expanding us the traditional liposomes and virus’ understanding. The rapid progress in the field of RNA interference was summarized, and then compare different RNA interference experiments used several different carriers. Further, the perspectives of future research on RNA interference mediated from traditional liposomes to virus and polymer nano-material in disease treatment and clinic diagnose were proposed.
RNA interference Small interfering RNA Gene silencing Transfection Carbon nanotubes
2014-01-20
國家自然科學基金項目(81000083)
曹騰威,男,碩士研究生,研究方向:分子細胞學;E-mail:caotw6154@163.com
高振,男,博士,副研究員,研究方向:生物化學;E-mail:gaozhen@njtech.edu.cn酈明芳,女,博士,講師,研究方向:心臟電生理學;E-mail:mingflee@hotmail.com

