昆蟲包涵體衍生型病毒經(jīng)口感染相關(guān)蛋白的研究進展
相興偉 周宇芳
(浙江省海洋開發(fā)研究院,舟山 316000)
昆蟲包涵體衍生型病毒經(jīng)口感染相關(guān)蛋白的研究進展
相興偉 周宇芳
(浙江省海洋開發(fā)研究院,舟山 316000)
了解昆蟲桿狀病毒包涵體衍生型病毒(Occlusion-derived virus,ODV)的經(jīng)口感染相關(guān)蛋白對揭示桿狀病毒建立原發(fā)感染的機制、明確昆蟲的先天免疫系統(tǒng),以及研究控制昆蟲新策略等方面具有重要意義。目前已鑒定的經(jīng)口感染因子(Per os infectivity factors,PIF)包括P74、PIF1、PIF2、PIF3、PIF4、PIF5(ODV-E56)和PIF6。此外,與ODV病毒粒子經(jīng)口感染有關(guān)的蛋白有ODV-E66、VP91、Ac108、ORF 145和ORF 150。綜述近年來關(guān)于上述經(jīng)口感染相關(guān)蛋白的結(jié)構(gòu)和功能等研究成果,分析了這些蛋白的分子生物學(xué)特征。
桿狀病毒 包涵體衍生型病毒 經(jīng)口感染 分子特征
桿狀病毒是一類專一性感染節(jié)肢動物的病原微生物,在感染周期中產(chǎn)生兩種表型不同但遺傳物質(zhì)完全一樣的病毒形態(tài),即出芽型病毒(Budded virus,BV)和包涵體衍生型病毒(Occlusion-derived virus,ODV)。BV在病毒感染早期大量產(chǎn)生,負責(zé)組織間的水平傳播。而在病毒感染晚期,數(shù)以千計的ODV被裝配包埋入由多角體蛋白組成的包涵體(Occlusion body,OB)中,該類型病毒負責(zé)代與代間的垂直傳播。目前對BV的研究比較深入,而對ODV的研究相對較少。ODV病毒粒子借其表面的囊膜蛋白與中腸柱狀上皮細胞的微絨毛表面受體結(jié)合,通過膜融合使病毒核衣殼進入中腸上皮細胞內(nèi)而啟動原發(fā)感染。因此,ODV病毒粒子囊膜上含有決定宿主范圍和啟動原發(fā)感染的蛋白質(zhì)因子,這些蛋白因子被稱為經(jīng)口感染因子(Per os infectivity factors,PIF)。近年來,隨著多種桿狀病毒基因組測序的完成,越來越多的經(jīng)口感染相關(guān)蛋白得到鑒定(圖 1)。目前確定的pif基因有p74、pif-1(orf119)、pif-2(orf22)、pif-3(orf115)、pif-4(orf96)、pif-5(odv-e56)和pif-6(orf68)、而 ORF 145、ORF 150、VP91、ODV-E66和 Ac108與經(jīng)口感染有關(guān)。下面以桿狀病毒的模式代表種苜蓿銀紋夜蛾核型多角體病毒(Autographa californica multiple nucleopolyhedrov-irus,AcMNPV)為例,對桿狀病毒中與經(jīng)口感染相關(guān)的蛋白進行綜述。
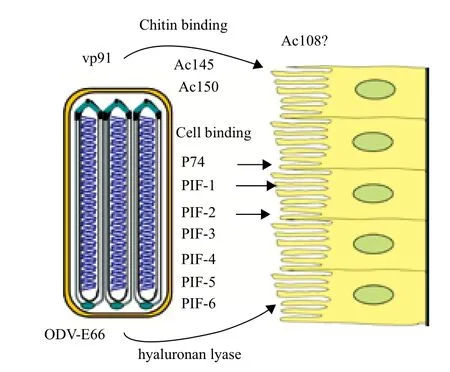
圖1 經(jīng)口感染相關(guān)蛋白
1 經(jīng)口感染因子
1.1 P74
p74基 因(ORF 138,119 135-121 072 nt)長1 938 bp,編碼的分子量74 kD由645個氨基酸殘基組成P74。P74是第一個被鑒定到的與經(jīng)口感染相關(guān)的ODV囊膜蛋白,按照發(fā)現(xiàn)時間可以把P74看作是PIF-0[1,2]。在所有已測序的桿狀病毒中都存在P74及其同源物,而且在Nudiviruses病毒[3],唾液腺肥大病毒(Salivary gland hypertrophy viruses,SGHVs)[4]和寄生蜂多分病毒(Polydnaviruses)[5]中也存在其同源物。P74蛋白的羧基端存在一個高度疏水的跨膜序列,該序列使P74定位于ODV囊膜上[6,7]。Haas-Stapleton等[8]證實P74能介導(dǎo)ODV與中腸上皮細胞表面的特殊受體相結(jié)合;與野生型病毒相比,缺失P74的突變病毒的經(jīng)口感染力下降了105倍,而結(jié)合到中腸上皮細胞的ODV數(shù)量僅僅降低了3倍,表明ODV與中腸上皮細胞的結(jié)合并不能確保原發(fā)感染。研究表明P74以飽和方式與柱狀上皮細胞的刷狀緣基底膜囊泡(Brush border membrane vesicles,BBMV)相互結(jié)合,從棉鈴蟲中腸的BBMV中鑒定到一個30 kD的潛在受體蛋白,而在甜菜夜蛾中腸的BBMV中篩選到一個35 kD的蛋白[2,9]。Slack等[10]研究發(fā)現(xiàn)在中腸強堿性環(huán)境下,P74經(jīng)胰蛋白酶裂解才能發(fā)揮其經(jīng)口感染作用。該研究小組近期證實缺失C端高度疏水跨膜域的P74仍然具有經(jīng)口感染的能力,而且能夠功能性地修復(fù)敲除p74的重組病毒[11]。最近研究人員發(fā)現(xiàn),在ODV從包涵體釋放過程中,P74首先被包涵體內(nèi)的內(nèi)源性堿性蛋白酶迅速酶解為兩段,再被胰蛋白酶裂解N端,表明P74在發(fā)揮作用的過程中經(jīng)歷了兩次酶解過程[12]。Wang等[13]將p74、p10和p26一起敲除,觀察到形成的多角體未包涵病毒粒子,推測P74可能與ODV的成熟以及隨后的包埋有關(guān)。最近研究證實,PIF-1、PIF-2與PIF-3在ODV病毒粒子表面形成一個穩(wěn)定的復(fù)合體,而P74與復(fù)合體有關(guān),但敲除p74并不影響復(fù)合體的形成[14,15]。在BV表面展示P74并不能增強BV的經(jīng)口感染能力[16]。
1.2 PIF-1
pif-1基因(ORF 119,100 699-102 291 nt)長1 593 bp,編碼分子量60 kD的由530個氨基酸殘基組成的PIF-1。首次在灰翅夜蛾核型多角體病毒(Spodoptera littoralis Nucleopolyhedrovirus,SpliNPV)中鑒定到PIF-1蛋白是ODV囊膜蛋白[17]。像P74蛋白一樣,PIF-1也是高度保守的,存在于所有已經(jīng)測序的桿狀病毒中,而且在Nudiviruses病毒中也存在PIF-1的同源物[3]。敲除該基因不影響病毒在培養(yǎng)細胞中的毒力,卻使重組病毒喪失了經(jīng)口感染昆蟲幼蟲的能力,而且PIF-1也參與介導(dǎo)了ODV與昆蟲中腸柱狀上皮細胞表面的特異性受體的識別與結(jié)合的過程[18]。Peng等[14,15]發(fā)現(xiàn)PIF-1、PIF-2和PIF-3在ODV病毒粒子的表面形成一個穩(wěn)定的復(fù)合體,敲除pif-1后復(fù)合體將不再形成。
1.3 PIF-2
pif-2基因(ORF 22,17 301-18 449 nt)長1 149 bp,編碼分子量44 kD的由382個氨基酸殘基組成的PIF-2。PIF-2在目前已測序的桿狀病毒基因組中高度保守,在Nudiviruses病毒中也存在其同源物[19]。在PIF-2的 N端存在一段高度疏水的跨膜域,PIF-2特異性地分布在ODV囊膜的表面[6,15]。分別在甜菜夜蛾核型多角體病毒(Spodoptera exigua multiple nucleopolyhedrovirus,SeMNPV)和棉鈴蟲核型多角體 病 毒(Helicoverpa armigera nucleopolyhedrovirus,HearNPV)中敲除pif-2,都觀察到經(jīng)口感染能力顯著降低[20,21]。與P74和PIF-1相似,缺失PIF2不影響B(tài)V的感染能力,卻影響經(jīng)口感染能力,且PIF2也參與介導(dǎo)昆蟲中腸上皮細胞與ODV結(jié)合的
過程[18]。如前所述,PIF-2是經(jīng)口感染因子復(fù)合體的組分,敲除pif-2不會形成復(fù)合體[14,15]。
1.4 PIF-3
pif-3基因(ORF 115,99 182-99 796 nt)長615 bp,編碼分子量23 kD的由204個氨基酸殘基組成的PIF-3。與前面介紹的經(jīng)口感染因子相似,PIF-3在已測序的桿狀病毒基因組中也是高度保守的,也存在于Nudiviruses病毒中[22]。在PIF-3的N端也存在一段高度疏水的跨膜域,而且研究人員已證實PIF-3特異性地定位于ODV囊膜[18]。Ohkawa等[18]研究發(fā)現(xiàn)PIF-3也是經(jīng)口感染必需的,卻不參與介導(dǎo)ODV與中腸上皮細胞的結(jié)合和融合的過程,推測PIF-3可能在原發(fā)感染的過程起到一種未知但關(guān)鍵的作用。最近報道PIF-3是經(jīng)口感染因子復(fù)合體的必備組分,很好地解釋了PIF-3為何也是經(jīng)口感染必須的[14,15]。
1.5 PIF-4
pif-4基因(ORF 96,84 346-84 867 nt)長522 bp,編碼分子量28 kD的由173個氨基酸殘基組成的PIF-4。PIF-4也是高度保守的,存在于目前已經(jīng)測序的所有桿狀病毒和Nudiviruses病毒中[22]。研究發(fā)現(xiàn)PIF-4在家蠶BmNPV中的同源物ORF 79分布在ODV囊膜上[23],而在AcMNPV中不僅存在于ODV囊膜上,也存在于BV的囊膜上[24],最近發(fā)現(xiàn)PIF-4特異性的存在于HearNPV的ODV囊膜上[6]。在AcMNPV中敲除該基因發(fā)現(xiàn),不影響B(tài)V的感染能力和多角體的形成,卻使重組病毒喪失了經(jīng)口感染能力[24]。PIF-4也是經(jīng)口感染因子復(fù)合體的組分,而且與PIF-1、PIF-2和PIF-3形成一個穩(wěn)定的復(fù)合體,敲除pif-4后影響了穩(wěn)定復(fù)合體的形成[14]。棉鈴蟲核型多角體病毒(HearNPV)的ORF85是PIF-4的同源物,研究發(fā)現(xiàn)缺失ha85導(dǎo)致復(fù)合體不能正常形成,而且酵母雙雜交證實HA85與P74、PIF-1、PIF-2和 PIF-3存在相互作用[25]。我們在BmNPV中敲除Bm79使得重組病毒喪失感染對幼蟲的經(jīng)口感染能力,雙分子熒光蛋白互補和免疫共沉淀表明Bm79與PIF1、PIF2、PIF3和ODV-E66存在相互作用。
1.6 PIF-5(ODV-E56)
pif-5基因(ORF 148,129 008-130 138 nt)長1 131 bp,編碼分子量41 kD 的由376個氨基酸殘基組成的PIF-5,也稱為ODV-E56。ODV-E56是高度保守的,其同源物存在于所有已公布的桿狀病毒和Nudiviruses病毒中[22]。在AcMNPV、HearNPV、CuniNPV、ChchNPV和PrGV的ODV的蛋白質(zhì)組中都發(fā)現(xiàn)了ODV-E56及其同源物[26-30],令人疑惑的是在AcMNPV的BV的蛋白質(zhì)組中也鑒定到了該蛋白[31],系統(tǒng)分析HearNPV的BV和ODV發(fā)現(xiàn)ODV-E56特異性地存在于ODV囊膜上[6]。ODV-E56是種屬特異性因子,能決定宿主范圍[32]。先前的研究表明,將LacZ插入替換其中的139個氨基酸不會影響病毒的毒力[33]。而最近的一些研究表明缺失ODV-E56 雖不影響B(tài)V的感染力,卻與經(jīng)口感染相關(guān)[34],本實驗室在這方面也做了相關(guān)工作[35],而且茶刺蛾核型多角體病毒(Rachiplusia ou multiple nucleopolyhedrovirus,RoMNPV)的ODV-E56可以功能性地修復(fù)缺失ODV-E56的AcMNPV[36]。與PIF-3類似,ODV-E56也不參與介導(dǎo)ODV與中腸上皮細胞的結(jié)合和融合的過程[34]。在研究經(jīng)口感染因子復(fù)合體的過程中,發(fā)現(xiàn)ODV-E56并不是復(fù)合體的組分[14],而酵母雙雜交證明ODV-E56可與38K和PIF-3發(fā)生相互作用[15],推測ODV-E56可能在原發(fā)感染的過程中通過與經(jīng)口感染因子復(fù)合體的組分互作而發(fā)揮作用。
1.7 PIF-6
pif-6基 因(ORF68,129 008-130 138 nt) 長579 bp,編碼分子量22.3 kD的由192個氨基酸殘基組成的PIF-6。PIF-6也是高度保守的,存在于所有的已測序的桿狀病毒中。BmNPV ORF 56是其同源物,在研究Bm56的過程中,發(fā)現(xiàn)其定位于ODV的核衣殼上,在BV和ODV的囊膜上都不存在,與其他經(jīng)口感染因子的定位明顯不同[37]。而在研究AcMNPV的Ac68時發(fā)現(xiàn)其在BV和ODV上都有分布[38],蛋白質(zhì)組學(xué)鑒定到PIF-6的同源物存在于HearNPV的ODV囊膜上[6]。在BmNPV中敲除bm56,對BV的毒力無影響,卻延長了幼蟲的致死時間,而且影響多角體的形態(tài)[37]。先前研究發(fā)現(xiàn)當(dāng)AcMNPV缺失ac68時,對BV的感染力、核衣殼結(jié)構(gòu)和包涵體形態(tài)都無影響,卻延長了致死時間[39]。
近期研究人員發(fā)現(xiàn)Ac68與經(jīng)口感染相關(guān),將其命名為PIF-6[38]。巧合的是,在分析經(jīng)口感染因子復(fù)合體的組分時,預(yù)測Ac68可能是其中的一種組分,目前尚缺少試驗數(shù)據(jù)證實[14]。
2 經(jīng)口感染相關(guān)蛋白
2.1 ODV-E66
odv-e66基因(ORF 46,36 718-38 832 nt)長2 115 bp,編碼分子量66 kD的由704個氨基酸殘基組成的ODV-E66。在研究ODV-E66的過程中證實ODV囊膜蛋白存在于病毒誘導(dǎo)的核內(nèi)微泡中[40]。ODV-E66在鱗翅目桿狀病毒中高度保守,其N端也存在一個高度疏水域[41]。ODV-E66特異性地定位于ODV囊膜上,在BV中不存在[6]。之前對ODV-E66的研究主要集中在N端的跨膜域上,將其與EGFP融合表達時可傳遞融合蛋白至核內(nèi)膜和ODV囊膜[41]。研究人員發(fā)現(xiàn)在缺失FP25K的條件下,ODV-E66轉(zhuǎn)運到病毒誘導(dǎo)的核內(nèi)囊泡的數(shù)量明顯減少[42]。共價交聯(lián)試驗進一步證實FP25K直接參與ODV-E66至核膜的傳送過程[43]。本實驗室成功構(gòu)建了敲除odv-e66的突變病毒,發(fā)現(xiàn)缺失ODV-E66不影響病毒的感染力和核衣殼的組裝,卻影響病毒的經(jīng)口感染能力[44]。分析鑒定經(jīng)口感染因子復(fù)合體的組分時,發(fā)現(xiàn)其并非復(fù)合體的組成成分[14]。酵母雙雜交試驗表明ODV-E66與PIF-2和PIF-3相互作用,表明ODV-E66雖不是經(jīng)口感染因子復(fù)合體的組分,卻與復(fù)合體的組分相互作用,從而在經(jīng)口感染的過程中發(fā)揮作用[45]。ODV-E66與肺炎鏈球菌的透明質(zhì)酸酶具有很高的相似度,可能是一種透明質(zhì)酸酶,在原發(fā)感染過程中有助于穿透細胞外基質(zhì)[46]。最近研究報道,在桿狀病毒感染的昆蟲細胞培養(yǎng)基中發(fā)現(xiàn)一種新型的軟骨素酶,經(jīng)鑒定其是截短的ODV-E66,其具體生物學(xué)機制有待進一步闡述[47]。
2.2 ORF 145和ORF 150
ORF 145和ORF 150彼此相關(guān),這兩個蛋白的氨基酸序列具有23%的同源性,而且與棉鈴蟲痘病毒的11 kD蛋白相關(guān)。ac145存在于大部分已測序的桿狀病毒中,除雙翅目核型多角體病毒外;而ac150僅存在于與AcMNPV親緣關(guān)系較近的鱗翅目核型多角體病毒中。Ac145和Ac150存在一個與幾丁質(zhì)結(jié)合的功能域[48],而且Ac145在HearNPV中同源物被證實可與幾丁質(zhì)結(jié)合[49]。研究人員證實Ac145和Ac150在BV和ODV的囊膜中都能檢測到,單獨敲除ac145使得對粉紋夜蛾的感染力下降6倍,對煙蚜夜蛾卻無影響,單獨敲除ac150無影響,將2個基因一起刪除導(dǎo)致對煙蚜夜蛾的感染能力下降39倍[50]。通過血淋巴注射和經(jīng)口感染的對比試驗來研究野生型和敲除ac150的突變病毒的毒力差別,結(jié)果在煙蚜夜蛾、斜紋夜蛾和粉紋夜蛾的幼蟲中重組病毒的經(jīng)口感染能力明顯降低[51]。在BmNPV中敲除ac150的同源物bm126,發(fā)現(xiàn)經(jīng)口感染能力無明顯差別,而致死時間有一定程度的延長[52]。因此,Ac145和Ac150也被分類為PIF因子,與其他PIF因子不同,它們起介導(dǎo)作用卻不是經(jīng)口感染必需的。
2.3 VP91
vp91基因(ORF 83,67 884-70 427 nt)長3 543 bp,編碼分子量91 kD的由1 180個氨基酸殘基組成的VP91。在OpMNPV中首次鑒定到了VP91,其并不是特異性地存在于ODV囊膜上,在BV中也存在[53]。VP91在核膜區(qū)域積累,分布于病毒感染的細胞核中,免疫電鏡觀察到VP91存在于ODV的囊膜和衣殼中[53]。VP91高度保守,在所有桿狀病毒和Nudiviruses病毒中都有存在[22]。在許多桿狀病毒的ODV中都檢測到了VP91及其同源物[6,26-30],在AcMNPV和HearNPV的BV的蛋白質(zhì)組學(xué)中卻未鑒定到VP91及其同源物[6,29]。在分析經(jīng)口感染因子復(fù)合體的組成成分時發(fā)現(xiàn),其是經(jīng)口感染因子復(fù)合體的成分[14]。本實驗室在BmNPV中敲除該基因的同源物發(fā)現(xiàn),其影響B(tài)V的產(chǎn)生,而且與核衣殼的成熟以及隨后病毒粒子包埋進入包涵體的過程相關(guān)。這些結(jié)果表明BmP95對BV的產(chǎn)生、核衣殼的精確組裝,以及ODV的成熟是必需的[54]。目前沒有相關(guān)試驗數(shù)據(jù)表明P95與經(jīng)口感染相關(guān),因為敲除該基因影響了BV的形成,不能獲得缺失BmP95的子代病毒粒子,因而無法進行相關(guān)的生物學(xué)試驗驗證其經(jīng)口感染特性。最近,研究人員在AcMNPV中敲除該基因的幾丁質(zhì)結(jié)合域,導(dǎo)致重組病毒的經(jīng)口感染能力顯著降低,暗示了該蛋白的幾丁質(zhì)結(jié)合域可能在ODV病毒粒子與圍食膜或者其他含有幾丁質(zhì)的
組織相互結(jié)合的過程中起作用[55]。
2.4 Ac108
ac108基因(ORF 108,94 392-94 709 nt)長318 bp,編碼分子量11 kD的由105個氨基酸殘基組成的Ac108。Ac108在鱗翅目桿狀病毒中高度保守,其同系物出現(xiàn)在所有I型NPV、II型NPV和GV(除PlxyGV)中。在HearNPV和柞蠶核型多角體病毒(Antheraea pernyi nucleopolyhedrovirus,AnpeNPV)的ODV中檢測到Ac108的同系物,表明該蛋白為一ODV蛋白[6,56]。斜紋夜蛾核型多角體病毒(Spodoptera frugiperda nucleopolyhedrovirus,SfMNPV)ORF 58是其同源物,利用λ-red同源重組系統(tǒng)構(gòu)建敲除sf58的重組病毒,經(jīng)口感染試驗表明,敲除型病毒的多角體不能感染斜紋夜蛾的幼蟲,而修復(fù)型病毒與野生型病毒的多角體可感染其幼蟲,表明Sf58是僅存在于鱗翅目桿狀病毒中的一種新鑒定的經(jīng)口感染因子[57]。Ac108在BmNPV中的同源物是Bm91,在BmNPV中敲除bm91其不影響B(tài)mNPV的毒力,使得幼蟲的致死時間延長[58]。本實驗室研究Bm91發(fā)現(xiàn),其特異性地定位于ODV囊膜,而生物學(xué)試驗與Tang等[58]研究存在一定差異(未發(fā)表數(shù)據(jù))。研究人員通過蛋白質(zhì)組學(xué)研究經(jīng)口感染因子復(fù)合體的組成成分時,預(yù)測Ac108可能是經(jīng)口感染因子復(fù)合體的組分[14]。
3 結(jié)語
目前,對桿狀病毒與昆蟲中腸之間的生物化學(xué)和物理方面的相互作用探索較少,而這方面的知識是發(fā)展新的基因方法控制農(nóng)業(yè)害蟲的理論基礎(chǔ)。因此,了解ODV經(jīng)口感染相關(guān)蛋白能為控制有害昆蟲提供干預(yù)策略,而且闡明這些科學(xué)問題將有助于揭示桿狀病毒的入侵機制及規(guī)律,并為設(shè)計相對廣譜的抗病毒入侵藥物提供新思路。同時,作為桿狀病毒原發(fā)感染的場所,幼蟲中腸也能合成許多特異性表達的抗病毒蛋白,但是目前尚不清楚其抗病毒機理。因此,從宿主中腸組織中篩選與經(jīng)口感染相關(guān)蛋白互作的蛋白質(zhì),有可能找到抑制病毒感染的宿主蛋白,拓展桿狀病毒的生物防治和應(yīng)用。
[1]Faulkner P, Kuzio J, Williams GV, et al. Analysis of p74, a PDV envelope protein of Autographa californica nucleopolyhedrovirus required for occlusion body infectivity in vivo[J]. J Gen Virol, 1997, 78(Pt 12):3091-3100.
[2]Zhou W, Yao L, Xu H, et al. The function of envelope protein P74 from Autographa californica multiple nucleopolyhedrovirus in primary infection to host[J]. Virus Genes, 2005, 30:139-150.
[3]Wang Y, Jehle JA. Nudiviruses and other large, double-stranded circular DNA viruses of invertebrates:new insights on an old topic[J]. J Invertebr Pathol, 2009, 101:187-193.
[4]Garcia-Maruniak A, Abd-Alla AM, Salem TZ, et al. Two viruses that cause salivary gland hypertrophy in Glossina pallidipes and Musca domestica are related and form a distinct phylogenetic clade[J]. J Gen Virol, 2009, 90:334-346.
[5]Bezier A, Annaheim M, Herbiniere J, et al. Polydnaviruses of braconid wasps derive from an ancestral nudivirus[J]. Science, 2009, 323:926-930.
[6]Hou D, Zhang L, Deng F, et al. Comparative proteomics reveal fundamental structural and functional differences between the two progeny phenotypes of a baculovirus[J]. J Virol, 2013, 87:829-839.
[7]Slack JM, Dougherty EM, Lawrence SD. A study of the Autographa californica multiple nucleopolyhedrovirus ODV envelope protein p74 using a GFP tag[J]. J Gen Virol, 2001, 82:2279-2287.
[8]Haas-Stapleton EJ, Washburn JO, Volkman LE. P74 mediates specific binding of Autographa californica M nucleopolyhedrovirus occlusion-derived virus to primary cellular targets in the midgut epithelia of Heliothis virescens larvae[J]. J Virol, 2004, 78:6786-6791.
[9]Yao L, Zhou W, Xu H, et al. The Heliothis armigera single nucleocapsid nucleopolyhedrovirus envelope protein P74 is required for infection of the host midgut[J]. Virus Res, 2004, 104:111-121.
[10]Slack JM, Lawrence SD, Krell PJ, et al. Trypsin cleavage of the baculovirus occlusion-derived virus attachment protein P74 is prerequisite in per os infection[J]. J Gen Virol, 2008, 89:2388-2397.
[11]Slack JM, Lawrence SD, Krell PJ, et al. A soluble form of P74 can act as a per os infectivity factor to the Autographa californica multiple nucleopolyhedrovirus[J]. J Gen Virol, 2010, 91:915-918.
[12]Peng K, van Lent JW, Vlak JM, et al. In situ cleavage of baculovirus occlusion-derived virus receptor binding protein P74 in the peroral infectivity complex[J]. J Virol, 2011, 85:10710-10718.
[13]Wang L, Salem TZ, Campbell DJ, et al. Characterization of a virion occlusion-defective Autographa californica multiple nucleopolyhedrovirus mutant lacking the p26, p10 and p74 genes[J]. J Gen Virol, 2009, 90:1641-1648.
[14]Peng K, van Lent JW, Boeren S, et al. Characterization of novel components of the baculovirus per os infectivity factor complex[J]. J Virol, 2012, 86:4981-4988.
[15]Peng K, van Oers MM, Hu Z, et al. Baculovirus per os infectivity factors form a complex on the surface of occlusion-derived virus[J]. J Virol, 2010, 84:9497-9504.
[16]Alfonso V, Lopez MG, Carrillo E, et al. Surface display of AcMNPV occlusion-derived P74 does not enhance oral infectivity of budded viruses[J]. Intervirology, 2012, 55:247-251.
[17]Kikhno I, Gutierrez S, Croizier L, et al. Characterization of pif, a gene required for the per os infectivity of Spodoptera littoralis nucleopolyhedrovirus[J]. J Gen Virol, 2002, 83:3013-3022.
[18]Ohkawa T, Washburn JO, Sitapara R, et al. Specific binding of Autographa californica M nucleopolyhedrovirus occlusion-derived virus to midgut cells of Heliothis virescens larvae is mediated by products of pif genes Ac119 and Ac022 but not by Ac115[J]. J Virol, 2005, 79:15258-15264.
[19]Cheng CH, Liu SM, Chow TY, et al. Analysis of the complete genome sequence of the Hz-1 virus suggests that it is related to members of the Baculoviridae[J]. J Virol, 2002, 76:9024-9034.
[20]Fang M, Nie Y, Wang Q, et al. Open reading frame 132 of Helicoverpa armigera nucleopolyhedrovirus encodes a functional per os infectivity factor(PIF-2)[J]. J Gen Virol, 2006, 87:2563-2569.
[21]Pijlman GP, Pruijssers AJ, Vlak JM. Identification of pif-2, a third conserved baculovirus gene required for per os infection of insects[J]. J Gen Virol, 2003, 84:2041-2049.
[22]Wang Y, Kleespies RG, Huger AM, et al. The genome of Gryllus bimaculatus nudivirus indicates an ancient diversification of baculovirus-related nonoccluded nudiviruses of insects[J]. J Virol, 2007, 81:5395-5406.
[23]Xu HJ, Yang ZN, Wang F, et al. Bombyx mori nucleopolyhedrovirus ORF79 encodes a 28-kDa structural protein of the ODV envelope[J]. Arch Virol, 2006, 151:681-695.
[24]Fang M, Nie Y, Harris S, et al. Autographa californica multiple nucleopolyhedrovirus core gene ac96 encodes a per os infectivity factor(PIF-4)[J]. J Virol, 2009, 83:12569-12578.
[25]Huang H, Wang M, Deng F, et al. ORF85 of HearNPV encodes the per os infectivity factor 4(PIF4)and is essential for the formation of the PIF complex[J]. Virology, 2012, 427:217-223.
[26]Braunagel SC, Russell WK, Rosas-Acosta G, et al. Determination of the protein composition of the occlusion-derived virus of Autographa californica nucleopolyhedrovirus[J]. Proc Natl Acad Sci USA, 2003, 100:9797-9802.
[27]Deng F, Wang R, Fang M, et al. Proteomics analysis of Helicoverpa armigera single nucleocapsid nucleopolyhedrovirus identified two new occlusion-derived virus-associated proteins, HA44 and HA100[J]. J Virol, 2007, 81:9377-9385.
[28]Perera O, Green TB, Stevens SM Jr, et al. Proteins associated with Culex nigripalpus nucleopolyhedrovirus occluded virions[J]. J Virol, 2007, 81:4585-4590.
[29]Wang XF, Zhang BQ, Xu HJ, et al. ODV-associated proteins of the Pieris rapae granulovirus[J]. J Proteome Res, 2011, 10:2817-2827.
[30]Xu F, Ince IA, Boeren S, et al. Protein composition of the occlusion derived virus of Chrysodeixis chalcites nucleopolyhedrovirus[J]. Virus Res, 2011, 158:1-7.
[31]Wang R, Deng F, Hou D, et al. Proteomics of the Autographa californica nucleopolyhedrovirus budded virions[J]. J Virol, 2010, 84:7233-7242.
[32]Harrison RL, Bonning BC. Application of maximum-likelihood models to selection pressure analysis of group I nucleopolyhedrovirus genes[J]. J Gen Virol, 2004, 85:197-210.
[33]Braunagel SC, He H, Ramamurthy P, et al. Transcription, translation, and cellular localization of three Autographa californica nuclear polyhedrosis virus structural proteins:ODV-E18, ODV-E35, and ODV-EC27[J]. Virology, 1996, 222, :100-114.
[34]Sparks WO, Harrison RL, Bonning BC. Autographa californica multiple nucleopolyhedrovirus ODV-E56 is a per os infectivity factor, but is not essential for binding and fusion of occlusionderived virus to the host midgut[J]. Virology, 2011, 409:69-76.
[35]Xiang X, Chen L, Guo A, et al. The Bombyx mori nucleopolyhedrovirus(BmNPV)ODV-E56 envelope protein is also a per os infectivity factor[J]. Virus Res, 2011, 155:69-75.
[36]Harrison RL, Sparks WO, Bonning BC. Autographa californica multiple nucleopolyhedrovirus ODV-E56 envelope protein is required for oral infectivity and can be substituted functionally by Rachiplusia ou multiple nucleopolyhedrovirus ODV-E56[J]. J Gen Virol, 2010, 91:1173-1182.
[37]Xu HJ, Yang ZN, Zhao JF, et al. Bombyx mori nucleopolyhedrovirus ORF56 encodes an occlusion-derived virus protein and is not essential for budded virus production[J]. J Gen Virol, 2008, 89:1212-1219.
[38]Nie Y, Fang M, Erlandson MA, et al. Analysis of the Autographa californica multiple nucleopolyhedrovirus overlapping gene pair lef3 and ac68 reveals that AC68 is a per os infectivity factor and that LEF3 is critical, but not essential, for virus replication[J]. J Virol, 2012, 86:3985-3994.
[39]Li G, Wang J, Deng R, et al. Characterization of AcMNPV with a deletion of ac68 gene[J]. Virus Genes, 2008, 37:119-127.
[40]Hong T, Braunagel SC, Summers MD. Transcription, translation, and cellular localization of PDV-E66:a structural protein of the PDV envelope of Autographa californica nuclear polyhedrosis virus[J]. Virology, 1994, 204:210-222.
[41]Hong T, Summers MD, Braunagel SC. N-terminal sequences from Autographa californica nuclear polyhedrosis virus envelope proteins ODV-E66 and ODV-E25 are sufficient to direct reporter proteins to the nuclear envelope, intranuclear microvesicles and the envelope of occlusion derived virus[J]. Proc Natl Acad Sci USA, 1997, 94:4050-4055.
[42]Braunagel SC, Burks JK, Rosas-Acosta G, et al. Mutations within the Autographa californica nucleopolyhedrovirus FP25K gene decrease the accumulation of ODV-E66 and alter its intranuclear transport[J]. J Virol, 1999, 73:8559-8570.
[43]Braunagel SC, Williamson ST, Saksena S, et al. Trafficking of ODV-E66 is mediated via a sorting motif and other viral proteins:facilitated trafficking to the inner nuclear membrane[J]. Proc Natl Acad Sci USA, 2004, 101:8372-8377.
[44]Xiang X, Chen L, Hu X, et al. Autographa californica multiple nucleopolyhedrovirus odv-e66 is an essential gene required for oral infectivity[J]. Virus Res, 2011, 158:72-78.
[45]Peng K, Wu M, Deng F, et al. Identification of protein-protein interactions of the occlusion-derived virus-associated proteins of Helicoverpa armigera nucleopolyhedrovirus[J]. J Gen Virol, 2010, 91:659-670.
[46]Vigdorovich V, Miller AD, Strong RK. Ability of hyaluronidase 2 to degrade extracellular hyaluronan is not required for its function as a receptor for jaagsiekte sheep retrovirus[J]. J Virol, 2007, 81:3124-3129.
[47]Sugiura N, Setoyama Y, Chiba M, et al. Baculovirus envelope protein ODV-E66 is a novel chondroitinase with distinct substrate specificity[J]. J Biol Chem, 2011, 286:29026-29034.
[48]Dall D, Luque T, O’Reilly D. Insect-virus relationships:sifting by informatics[J]. Bioessays, 2001, 23:184-193.
[49]Wang D, Zhang CX. HearSNPV orf83 encodes a late, nonstructural protein with an active chitin-binding domain[J]. Virus Res, 2006, 117:237-243.
[50]Lapointe R, Popham HJ, Straschil U, et al. Characterization of two Autographa californica nucleopolyhedrovirus proteins, Ac145 and Ac150, which affect oral infectivity in a host-dependent manner[J]. J Virol, 2004, 78:6439-6448.
[51]Zhang JH, Ohkawa T, Washburn JO, et al. Effects of Ac150 on virulence and pathogenesis of Autographa californica multiple nucleopolyhedrovirus in noctuid hosts[J]. J Gen Virol, 2005, 86:1619-1627.
[52]Hao B, Huang J, Sun X, et al. Variants of open reading frame Bm126 in wild-type Bombyx mori nucleopolyhedrovirus isolates exhibit functional differences[J]. J Gen Virol, 2009, 90:153-161.
[53]Russell RL, Rohrmann GF. Characterization of P91, a protein associated with virions of an Orgyia pseudotsugata baculovirus[J]. Virology, 1997, 233:210-223.
[54]Xiang X, Shen Y, Yang R, et al. Bombyx mori nucleopolyhedrovirus BmP95 plays an essential role in budded virus production and nucleocapsid assembly[J]. J Gen Virol, 2013, 94:1669-1679.
[55]Zhu S, Wang W, Wang Y, et al. The baculovirus core gene ac83 is required for nucleocapsid assembly and per os infectivity of Autographa californica nucleopolyhedrovirus[J]. J Virol, 2013, 87:10573-10586.
[56]Shi SL, Pan MH, Lu C. Characterization of Antheraea pernyi nucleopolyhedrovirus p11 gene, a homologue of Autographa
californica nucleopolyhedrovirus orf108[J]. Virus Genes, 2007, 35:97-101.
[57]Simon O, Palma L, Williams T, et al. Analysis of a naturallyoccurring deletion mutant of Spodoptera frugiperda multiple nucleopolyhedrovirus reveals sf58 as a new per os infectivity factor of lepidopteran-infecting baculoviruses[J]. J Invertebr Pathol, 2012, 109:117-126.
[58]Tang Q, Li G, Yao Q, et al. Bm91 is an envelope component of ODV but is dispensable for the propagation of Bombyx mori nucleopolyhedrovirus[J]. J Invertebr Pathol, 2013, 113:70-77.
(責(zé)任編輯 狄艷紅)
Research Progress of Proteins Associated with Per os Infectivity of the Occlusion-derived Virus
Xiang Xingwei Zhou Yufang
(Zhejiang Marine Development Research Institute,Zhoushan 316000)
The study of baculovirus proteins associated with per os infectivity is of great importance not only for viral biology but also for the fact that these proteins expose vulnerabilities in the insect immune system and this knowledge is also fundamental for the development of new strategies for insect control. Recent researches show that the proteins associated with per os infectivity of the occlusion-derived virus(ODV)include P74, PIF1, PIF2, PIF3, PIF4, PIF5(ODV-E56), PIF6, ODV-E66, VP91, Ac108, ORF 145 and ORF 150. This paper reviewed recent research achievements about the structure and function of the proteins and analyzed the molecular biology characteristics of these proteins.
Baculovirus Occlusion-derived virus Per os infectivity factors Molecular characteristics.
2014-03-27
國家科技支撐項目(2012BAD29B06),浙江省自然科學(xué)基金項目(LQ14C170001)
相興偉,男,博士,研究方向:分子生物學(xué)及其基因工程利用;E-mail:xxw11086@126.com

