甘蔗類異黃酮還原酶(IRL)基因的克隆與表達分析
謝曉娜張小秋邵敏朱惠楊麗濤,2李楊瑞,2
(1..廣西大學農學院 亞熱帶農業生物資源保護與利用國家重點實驗室,南寧 530004;2.中國農業科學院甘蔗研究中心 廣西農業科院農業部廣西甘蔗生物技術與遺傳改良重點實驗室 廣西甘蔗遺傳改良重點實驗室,南寧 530007)
甘蔗類異黃酮還原酶(IRL)基因的克隆與表達分析
謝曉娜1張小秋1邵敏1朱惠1楊麗濤1,2李楊瑞1,2
(1..廣西大學農學院 亞熱帶農業生物資源保護與利用國家重點實驗室,南寧 530004;2.中國農業科學院甘蔗研究中心 廣西農業科院農業部廣西甘蔗生物技術與遺傳改良重點實驗室 廣西甘蔗遺傳改良重點實驗室,南寧 530007)
采用 RT-PCR 技術從甘蔗中克隆 SoIRL基因,用生物信息學方法對獲得的氨基酸序列進行分析,利用熒光定量PCR 技術研究SoIRL基因在甘蔗不同組織和不同脅迫條件下的表達特性。結果表明,克隆獲得甘蔗 SoIRL,GenBank 登錄號為KF808324。該 cDNA 全長 1 169 bp,含有 1 個 927 bp 的完整開放閱讀框(ORF),編碼 309個氨基酸。系統進化樹分析顯示,甘蔗SoIRL 與玉米的 IRL 蛋白親緣關系較近。qRT-PCR 分析表明 SoIRL 在甘蔗根、莖、葉中均有表達;在RSD病菌及低溫(4℃)、聚乙二醇(PEG)、NaCl 和 脫落酸(ABA)4種非生物脅迫下均被誘導表達,但表達模式不同。說明該基因可能參與甘蔗應答RSD過程,并可能在非生物脅迫中也發揮了作用。
甘蔗 類異黃酮還原酶 基因克隆 表達分析
甘蔗是制糖的主要原料,是我國最重要的糖料作物,也是極具潛力的生物質能源作物[1],甘蔗宿根矮化病(Ratoon stuning disease,RSD)是甘蔗生產中最為嚴重的細菌病害之一,常導致感病品種新
植蔗減產10%-15%,宿根蔗減產20%-25%,在干旱的情況下感病品種的宿根蔗產量損失可達60%以上[2],目前有關甘蔗與RSD病原菌互作的分子機制研究不多。類異黃酮還原酶(IRL),是合成木質素和異黃酮等植物次生代謝產物的一類關鍵酶[3,4],而木質素、類黃酮和生物堿等次生代謝產物[5],在植物的生長發育、色素形成、抗毒素的產生等方面都具有重要的作用。自1991年首次從豆科植物克隆得到異黃酮還原酶基因以來,陸續從擬南芥[6]、煙草[7]、葡萄[8]、馬鈴薯[9]、金蕎麥[10]、苦蕎[11]、銀杏[12]等多種植物中克隆得到IRL基因。目前,對編碼甘蔗類異黃酮還原酶基因的研究還未見報道,對于異黃酮還原酶基因與植物抗逆性之間的機理研究也未見報道。本研究利用差異蛋白質組學技術和MALDI-TOF/TOF技術,鑒定出類異黃酮還原酶蛋白,并通過RT-PCR克隆甘蔗SoIRL基因;分析SoIRL基因的相關結構域、序列特征及細胞定位,研究SoIRL基因在甘蔗不同部位及不同逆境下的表達模式,為甘蔗的抗逆尤其是抗病育種提供理論依據。
1 材料與方法
1.1 材料
材料處理與取樣:試驗于2011年3月至2013年12月在廣西大學農學院甘蔗智能溫室大棚及廣西大學亞熱帶農業生物資源保護與利用國家重點實驗室完成。
將PCR檢測后沒有宿根矮化病的甘蔗品種GT11砍成單芽種莖,50℃ 2 h溫湯脫菌后,涼至室溫。一部分用Lxx菌液浸種,一部分用清水浸種作為對照。將處理后的甘蔗品種的單芽種莖進行桶栽土培。混合土為(土∶有機肥∶沙=7∶2∶1,W/W),并把桶移至智能溫室大棚,按照日常管理。待甘蔗長至90、120、150、180 d時分別取蔗莖基部2-3節;取不做任何處理的生長健壯,長勢一致的甘蔗單芽種莖種植在細沙中,當苗長出2-3葉時,轉移到營養杯(沙∶土=1∶1)中培養。待苗長到 7-8片真葉時,取長勢一致的植株,分為4組,進行如下處理,一組用15%的PEG進行澆灌處理;一組 4℃低溫處理(白晝 16 h/8 h,濕度 65%);另外兩組分別用 100 mmol/L的 NaCl 和100 μmol/L的 ABA進行噴灑葉面處理。在處理后分別于 0、3、6、12、24和 48 h 取樣;另取不做任何處理的健康甘蔗根、莖、葉樣品。各處理取樣后用液氮速凍,置于-80℃保存備用。
1.2 方法
1.2.1 雙向電泳 RSD菌液浸種為處理,ddH2O浸種為對照,以TCA-丙酮法提取對照與處理蔗汁蛋白質,進行雙向電泳,利用BioRad 2-D分析軟件找出差異蛋白點,質譜鑒定,登錄NCBI數據庫,對質譜鑒定結果進行分析。
1.2.2 總RNA的提取及cDNA的合成 用Trizol試劑提取總RNA(北京康為世紀公司),RNA濃度測定后,將RNA稀釋至同一濃度保存待用。應用 M-MLV反轉錄試劑盒(TaKaRa)將純化的總RNA 反轉錄成第一鏈 cDNA,逆轉錄加尾引物為Oligo(dT)18:5'-GGCCACGCGTCGACTAGTAC(T)18-3',具體操作步驟參照說明書進行。
1.2.3 SoIRL基因的克隆與生物信息學分析 以質譜鑒定的 IRL蛋白氨基酸序列為參照,登錄NCBI進行搜索,選取同源性較高的植物核苷酸序列,運用Primer軟件設計該基因上游引物IRL1:5'-ATGGCGTCGGAGAAGAGCAA-3',下游引物使用逆轉錄加尾引物 3side:5'-GGCCACGCGTCGACTAGTAC-3'。SoIRL基因的克隆參照Dream Taq DNA 聚合酶的反應體系及程序,PCR產物經1.0%的瓊脂糖電泳檢測,回收純化目的條帶,用pMD18-T連接,挑取陽性克隆,PCR檢測后,送去上海生工生物工程公司測序。
用軟件 BioXM2.6 預 測 SoIRL 氨 基 酸 序 列;用Protparam分析蛋白質理化性質;用TMpred分析分析SoIRL蛋白的跨膜結構;用ExPASy Proteomics Server軟件預測基因的親疏水性;用SOPMA軟件預測基因的二級結構分析;用Motif Scan軟件對SoIRL的功能結構域進行預測;采用MEGA 4軟件構建甘蔗SoIRL氨基酸序列與其它物種的進化樹。
1.2.4 SoIRL基因的實時熒光定量表達分析 根據獲得的SoIRL基因序列設計Real-time PCR特異性引物IRL-F:5'-GAGAAGAAGACCGGCAAGAC-3',IRL-R:5'-GATCGCCAGGATGATATTCAG-3';以 甘蔗GAPDH基因(登錄號為 EF189713)為內參,并設計內參
引物 GAPDH-F:5'-AAGGGTGGTGCCAAGAAGG-3',GAPDH-R:5'-CAAGGGGAGCAAGGCAGTT-3'。試驗在羅氏 480(LC480)熒光定量 PCR 儀上進行,反應總體積為25 μL,反應體系及程序參照 TaKaRa SYBR Premix Ex TaqTMⅡ說明書。按照 2-ΔΔCT法計算基因的相對表達量。
2 結果
2.1 RSD脅迫下甘蔗蔗汁差異蛋白質雙向電泳分析以甘蔗為材料,提取健康與感染RSD的甘蔗蔗汁蛋白,對蛋白質進行等點聚焦和SDS-PAGE電泳分離,利用BioRad 2-D軟件進行分析,其中蛋白點12在RSD病原菌脅迫下調表達,被MALDI-TOFTOF/MS鑒定為IRL基因(圖1)。

圖 1 甘蔗低溫脅迫SoIRL蛋白的差異表達
2.2 SoIRL基因的克隆
以cDNA為模板,IRL1和3side為上下游引物進行PCR擴增,瓊脂糖電泳(圖2)檢測得到一條1 200 bp左右的DNA條帶,對目的條帶進行回收純化,連接T載體,轉化DH5α,藍白斑篩選后,測序得到一個1 169 bp的序列。該基因命名為SoIRL,NCBI登錄號為KF808324。BioXM2.6 軟件分析顯示該基因包含啟動子 ATG 和終止子TGA,開放閱讀框(open read frame,ORF)為927 bp,編碼309個氨基酸(圖3)。

圖 2 甘蔗 SoIRL 的擴增
2.3 SoIRL基因生物信息學分析
用在線軟件http://www.expasy.org/tools/protpara m.htm分析SoIRL的理化性質,顯示該基因所編碼的氨基酸序列等電點為 5.17,蛋白質分子量大小為 33.00 kD。在氨基酸序列組成中,一些氨基酸如Ala、Leu、Val、Gly 出現頻率較高,分別占11.7%、9.4%、9.1%和9.1%,而一些氨基酸如Trp、Met、His 出現頻率則較低,只占0.3%、1.0%、1.3%和1.9%,而Sec、Cys 在氨基酸序列中則沒有出現。該蛋白質的分子式為C1486H2365N387O453S3,原子總數為4 694,消光系數為23 380,不穩定系數為30.18,是穩定蛋白;脂肪系數為97.25,總平均親水性為-0.026,該蛋白為親水蛋白。SOSUI signal軟件預測顯示SoIRL N端1-24含一個序列長24個氨基酸的信號肽(MASEKSKILVVGGTGYLGRHVVAA)。TMpred軟件預測含有7個跨膜螺旋區,3個區為由內向外跨膜,分別分布在15-36、150-169和259-277區域;4個區為由外向內跨膜,位置分別在8-24、7-191、150-168和258-274。氨基酸疏水性最小值為-2.544,最大值為2.478。二級結構預測顯示,α-螺旋122個,占39.48%,延伸鏈54個,占17.48%;β-轉角22個,占7.12%;無規則卷曲111個,占35.92%,可見SoIRL蛋白的二級結構主要是α-螺旋和無規則卷曲組成。該基因含有16個磷酸化位點,Ser 4個、Thr 4個和Tyr 4個,轉錄后修飾位點的存在,說明轉錄后修飾對功能性蛋白SoIRL具有重要的作用。
蛋白質功能結構域分析顯示含有一個環腺苷酸磷酸化位點為138-141;3個蛋白激酶C磷酸化位點分別為3-5、25-27、235-237;5個酪蛋白激酶Ⅱ磷酸化位點分別為52-55、223-226、229-232、277-
280和299-302;序列132-137、145-150、165-170、286-291為N-肉豆蔻酰化位點;210-213為N-糖基化位點;122-129為依賴于cAMP-cGMP蛋白激酶磷酸化位點;9-29、10-23為NAD輔酶結合位點;兩個NmrA(氮代謝抑制調節劑)保守結構域(8-300)。這說明SoIRL很可能為短鏈脫氫酶家族(SDR)的成員。在NCBI在線軟件分析SoIRL極可能為SDR大家族中PCBER家族的一員。

圖 3 SoIRL 編碼區核苷酸序列及推導的氨基酸序列
甘蔗 SoIRL 的氨基酸序列與其它作物 IRL 編碼的氨基酸序列多重比對分析(圖4)發現,它們之間有較高的同源性,但也有明顯堿基上的差異。通過構建甘蔗和其它植物的IRL進化樹(圖5),發現甘蔗的 SoIRL 與高粱、玉米、禾草聚為一大類,與玉米的同源性最高為 99%。從進化樹上看,相同科或類群的植物聚為一類,但不同植物間 IRL 間也存在很高的同源性,這也可推測其在進化過程中是相當保守的。
2.4 SoIRL基因的表達量分析
提取甘蔗不同組織的RNA,以甘蔗GAPDH基因為內參,進行實時熒光定量PCR分析,結果(圖6)表明SoIRL在甘蔗的根、莖、葉中都有表達,為組成型表達,SoIRL基因在+1、+3、+5葉(最高可見肥厚帶葉為+1葉,往下以此類推)中的表達量差異不大;在莖中的表達量為第7節間(莖中部)最高,莖基部第1節間次之,在莖尖表達量最小,只有莖中部表達量的1/4;SoIRL在根部也有表達,且表達量與在莖中部及葉中的表達量差異不是很大。
同時采集90、120、150和180 d健康及感染RSD甘蔗蔗莖基部,進行qRT-PCR分析,結果(圖7)表明,在感病的蔗莖體內90、120和150 d,So-IRL的表達都高于健康對照,而在180 d則低于健康蔗莖。無論是健康還是感染RSD的蔗莖,SoIRL都表現為先升高后降低的趨勢,可見SoIRL在甘蔗體內的表達不是一成不變的,而是隨著甘蔗的生長而發生著變化。
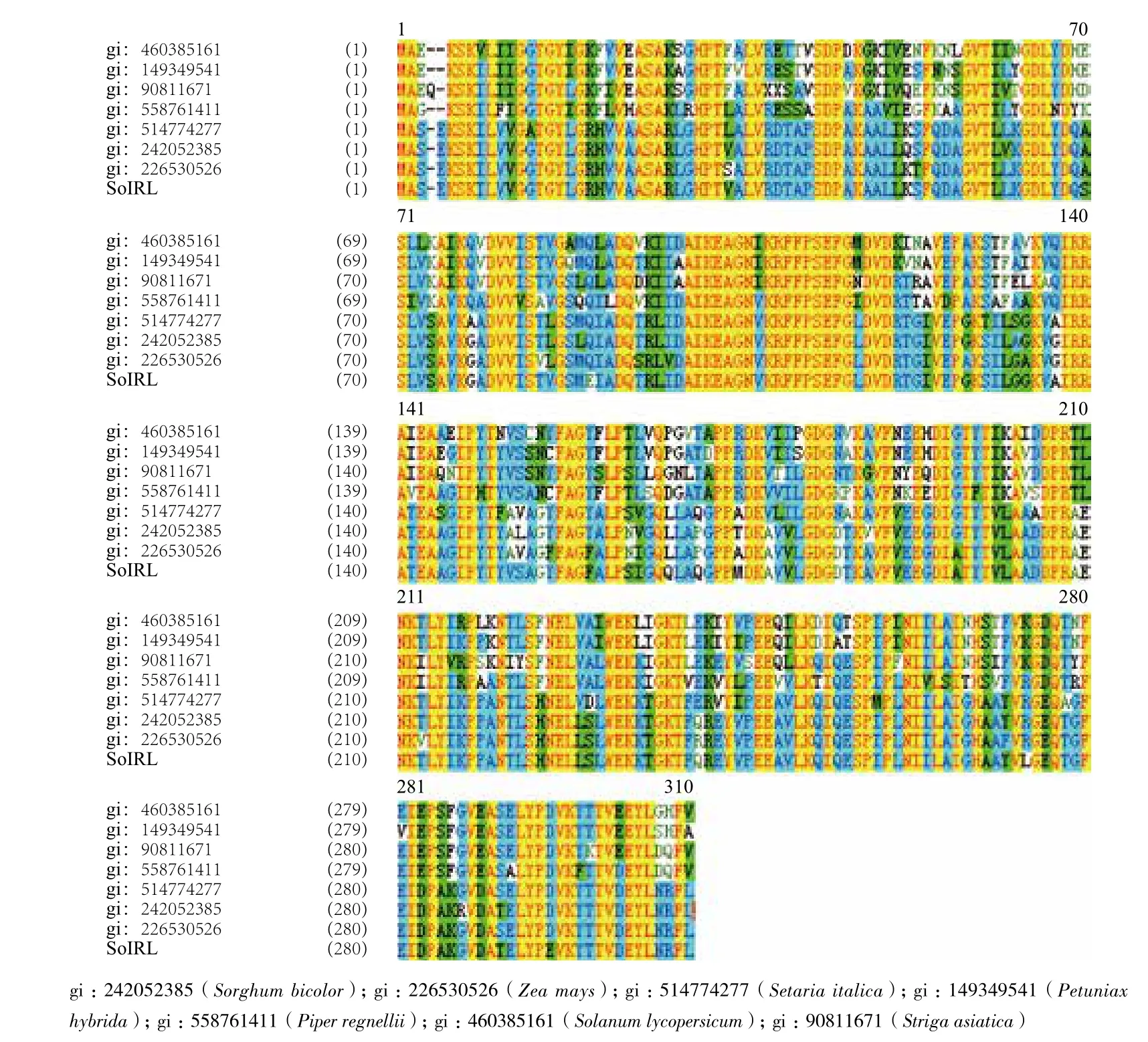
圖 4 SoIRL與其它植物IRL 氨基酸序列多重比對
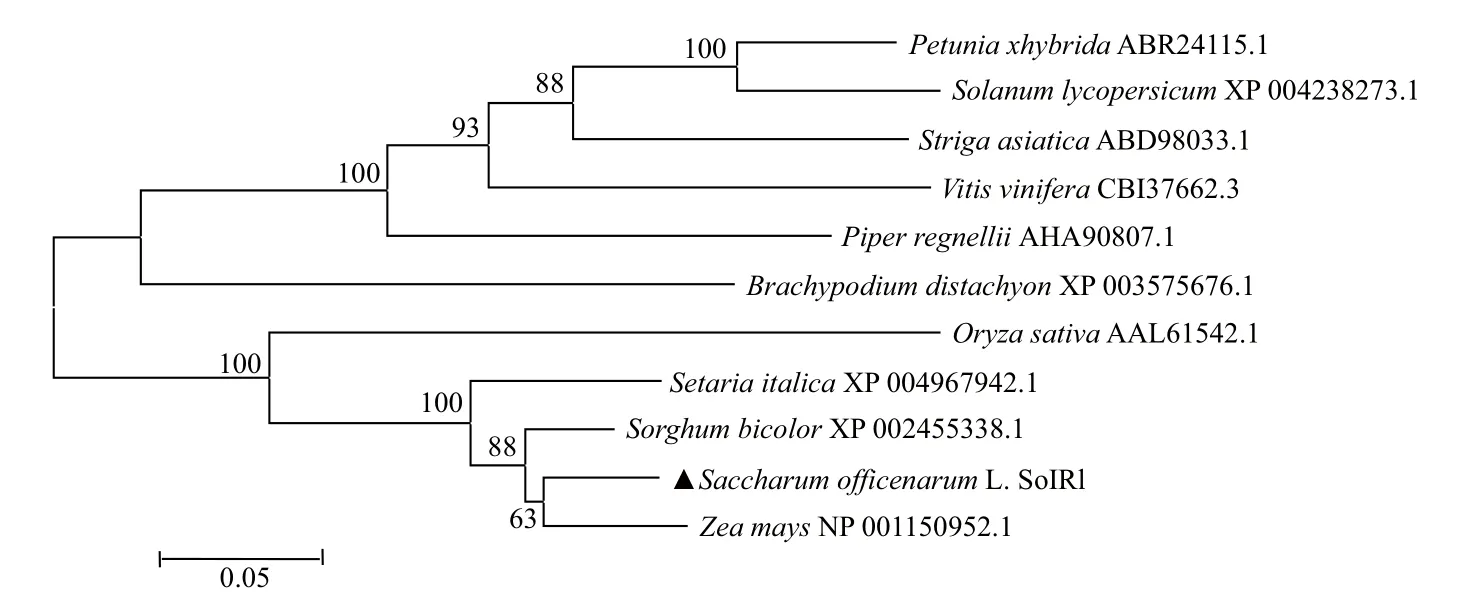
圖 5 甘蔗 SoIRL 與其它植物 IRL 氨基酸序列的關系分析
在干旱、低溫、激素和鹽脅迫下 SoIRL 均被誘導表達,但表達模式不一(圖 8)。在PEG模擬的干旱脅迫下,SoIRL 出現先下調后上調的表達模式,處理3 h時降到最低僅為對照的一半,之后開始緩慢上升,到48 h時升為對照的1.9倍。在4℃低溫脅迫下,SoIRL的表達則出現“抑-揚-抑-揚”的雙峰表達模式,3 h時SoIRL的表達量急劇下降,降為對照的3.8%,之后開始緩慢增加,12 h時升到最高為對照的1.83倍,之后又開始有所下降,48 h時又升為對照的1.63倍。ABA處理下SoIRL的表達出現“升-降-升”的表達趨勢,處理3 h時表達量有所增
加,之后開始下降,24 h降到最低,僅為對照的37.0%,之后又開始增加,到48 h時表達量還是低于對照。NaCl模擬的高鹽脅迫下SoIRL的表達也出現“揚-抑-揚”的表達趨勢,在處理3 h時升為對照的2.3倍,之后開始出現急劇下降,12 h降到最低僅為對照的13.0%,之后又開始上升,48 h升到最高為對照的3倍之多。

圖6 甘蔗SoIRL的組織特異性表達

圖7 健康及感染RSD的甘蔗出苗后90-180 d SoIRL的表達
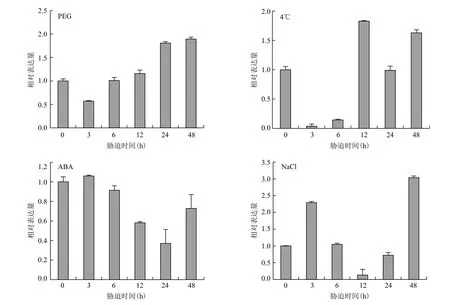
圖 8 SoIRL 在 4 種非生物脅迫條件下的表達特性
3 討論
類異黃酮還原酶包括異黃酮還原酶(IFR)[13]、落葉松脂醇還原酶(PLR)[14]和苯基香豆滿芐醚還原酶(PCBER)[15],進幾年的研究發現IRL與植物中多種抗毒素的合成密切相關,參與了植物對生物和非生物脅迫的應答[4],在植物的生長發育、抗病、抗逆等方面發揮著重要的作用。
本研究根據已知IRL基因序列設計簡并引物,獲得甘蔗SoIRL基因的全長序列1 167 bp,序列
分析表明該基因具有完整的開放閱讀框,生物信息學分析SoIRL極可能屬于短鏈脫氫酶家族,是NADPH依賴性還原酶,屬于PCBER家族成員的一員。這與趙海霞等[11]已報道的苦蕎FtIRL 推導的蛋白質含有保守的NADPH 結合位點,符合短鏈脫氫酶家族的結構特征結論一致。軟件預測顯示SoIRL N端1-24含一個序列長24個氨基酸的信號肽(MASEKSKILVVGGTGYLGRHVVAA),包含兩個NmrA保守結構域,4個N-肉豆蔻酰化位點,一個保守的N-糖基化位點,多個重要的磷酸化位點,這些與已報道的野生金蕎麥FcIRL結構相似[10]。同源性分析顯示甘蔗SoIRL編碼的氨基酸序列與其它物種IRL氨基酸序列具有較高的同源性,進化樹分析發現SoIRL與高粱還有玉米的IRL親緣關系最近,相同科或類群的植物聚為一類,同時發現不同植物間IRL間也有較高的同源性,這說明IRL在進化過程中保持了一定的演化趨同性。
本研究通過 qRT-PCR 分析SoIRL在甘蔗組織中的表達差異,發現SoIRL在甘蔗的根、莖、葉中都有表達,為組成型表達。這與Vander Mijnsbrugge等[16]報道的PCBER在快速生長的植物組織中都能大量表達一致。棉花種皮的PCBER轉錄水平較高[15],這在種子發育時起著至關重要的作用,因為它不僅能保護種子的結構不被破壞,而且可以增強棉花抵御外來生物侵染的能力。在RSD病原菌的脅迫下,SoIRL被誘導表達。有研究報道,葡萄的IRL蛋白在抵抗UV射線及病原菌感染時被誘導產生[8],水稻OsIRL 在稻瘟病病原菌(Magnaporthe grisea)和茉莉酸的誘導下,其表達量上升[18],咖啡葉中CoIRL在真菌浸染和機械損傷的逆境下,表達量顯著上升[3]。本研究還通過 qRT-PCR分析了SoIRL在4種非生物脅迫下的表達情況,結果顯示,在PEG、4℃脅迫下SoIRL都表現為先降低后升高的表達模式,都是在處理3 h表達量降到最低點。而在ABA作用下SoIRL出現“揚-抑”的表達模式,3 h時升到最高,24 h降到最低,在NaCl模擬的高鹽脅迫下,SoIRL則表現為“揚-抑-揚”的表達模式,48 h表達量升到最高。可見非生物脅迫可以誘導SoIRL的表達,但不同的非生物脅迫表達的模式不盡相同。關于其它植物IRL在不同逆境脅迫下的表達分析也已有報道。在ABA處理下銀杏體內的GbIRL出現上調表達,推測可能是通過促進苯丙烷代謝途徑從而提高下游代謝水平[12],柚子IRL基因參與應答紫外輻射[19],銀杏在UV-B照射下,GbIRL1表達量升高,推測可能與異黃酮的積累有關[20],水稻OsIRL在ABA、SA作用下表達量下調[18],擬南芥中的IRL基因被氧化脅迫誘導,編碼產生相應蛋白[6],煙草A622基因能夠被MeJA誘導表達,但卻被乙烯及其類似物所抑制[21],銀杏GbIRL在機械損傷、SA、ABA、ALA誘導下,其表達量上升,在ETH誘導下表達量下降[12]。環境條件會對植物的生長產生各種各樣的影響甚至脅迫,為了提高植物對物理環境的適應性,植物一方面在形態結構上發生變化,另一方面在生理生化上發生變化,而一些次生物質則成為后種適應的物質基礎。在植物耐旱、抗寒和耐鹽性研究中都發現次生代謝產物在其中發揮著重要作用[22]。在干旱脅迫下,植物組織中次生代謝產物的濃度常常上升。由于4℃、PEG、NaCl 等對植物的脅迫與植物遭受寒害、干旱、滲透脅迫的效應類似,因此可以推測 SoIRL在甘蔗抗干旱、抗滲透脅迫或者抗氧化脅迫中發揮某種作用,推測SoIRL基因可能通過調節木質素代謝過程對脅迫產生一定的應急反應或發揮其它作用,但是調控方式和調控程度在不同物種中表現又有所不同,具體作用需通過進一步的試驗來探討。
4 結論
通過研究甘蔗感染RSD后蛋白質組的變化,鑒定并克隆出SoIRL。通過qRT-PCR分析研究了SoIRL在RSD病原菌脅迫、甘蔗不同組織及與 4 種非生物脅迫條件下的表達特性,結果表明該基因在甘蔗體內為組成型表達,其表達受RSD病原菌誘導,并參與了甘蔗應答RSD過程,也受非生物脅迫的誘導,推測其在甘蔗抵抗干旱、低溫和高鹽等非生物脅迫的逆境中也發揮了重要作用。
[1]李楊瑞, 楊麗濤. 20世紀90年代以來我國甘蔗產業和科技的新發展[J]. 西南農業學報, 2009, 22(5):1469-1476.
[2]Zerillo MM, Van Sluys MA, Camargo LE, et al. Characterization of
new IS elements and studies of their dispersion in two subspecies of Leifsonia xyli[J]. BMC Microbiology, 2008, 8:127.
[3]Brandalise M, Severino FE, Maluf M P, et al. The promoter of a gene encoding an isoflavone reductase-like protein in coffee(Coffea arabica)drives a stress-responsive expression in leaves[J]. Plant Cell Reports, 2009, 28(11):1699-1708.
[4]Kajikawa M, Hirai N, Hashimoto T. A PIP-family protein is required for biosynthesis of tobacco alkaloids[J]. Plant Molecular Biology, 2009, 69(3):287-298.
[5]Ferrer JL, Austin M, Stewart Jr C, et al. Structure and function of enzymes involved in the biosynthesis of phenylpropanoids[J]. Plant Physiology and Biochemistry, 2008, 46(3):356-370.
[6]Babiychuk E, Kushnir S, Belles-Boix E, et al. Arabidopsis thaliana NADPH oxidoreductase homologs confer tolerance of yeasts toward the thiol-oxidizing drug diamide[J]. Journal of Biological Chemistry, 1995, 270(44):26224-26231.
[7]Hibi N, Higashiguchi S, Hashimoto T, et al. Gene expression in tobacco low-nicotine mutants[J]. The Plant Cell Online, 1994, 6(5):723-735.
[8]Lers A, Burd S, Lomaniec E, et al. The expression of a grapefruit gene encoding an isoflavone reductase-like protein is induced in response to UV irradiation[J]. Plant Molecular Biology, 1998, 36(6):847-856.
[9]Van Eldik G, Ruiter R, Colla P, et al. Expression of an isoflavone reductase-like gene enhanced by pollen tube growth in pistils of Solanum tuberosum[J]. Plant Molecular Biology, 1997, 33(5):923-929.
[10]郭鐵英. 野生金蕎麥類異黃酮還原酶基因(FcIRL)的克隆與功能的初步研究[D].重慶:西南大學, 2008.
[11]趙海霞, 李成磊, 白悅辰, 等. 苦蕎類異黃酮還原酶基因(FtlRL)的克隆及序列分析[J]. 食品科學, 2012, 33(11):210-214.
[12]Cheng H, Li LL, Xu F, et al. Expression patterns of an isoflavone reductase-like gene and its possible roles in secondary metabolism in Ginkgo biloba[J]. Plant Cell Reports, 2013, 32(5):637-650.
[13]Paiva NL, Edwards R, Sun Y, et al. Stress responses in alfalfa(Medicago sativa L.)11. Molecular cloning and expression of alfalfa isoflavone reductase, a key enzyme of isoflavonoid phytoalexin biosynthesis[J]. Plant Molecular Biology, 1991, 17(4):653-667.
[14]Hano C, Martin I, Fliniaux O, et al. Pinoresinol-lariciresinol reductase gene expression and secoisolariciresinol diglucoside accumulation in developing flax(Linum usitatissimum)seeds[J]. Planta, 2006, 224(6):1291-1301.
[15]Turley RB. Expression of a phenylcoumaran benzylic ether reductase-like protein in the ovules of Gossypium hirsutum[J]. Biologia Plantarum, 2008, 52(4):759-762.
[16]Vander Mijnsbrugge K, Beeckman H, De Rycke R, et al. Phenylcoumaran benzylic ether reductase, a prominent poplar xylem protein, is strongly associated with phenylpropanoid biosynthesis in lignifying cells[J]. Planta, 2000, 211(4):502-509.
[17]Turley RB. Expression of a phenylcoumaran benzylic ether reductase-like protein in the ovules of Gossypium hirsutum[J]. Biologia Plantarum, 2008, 52(4):759-762.
[18]Kim ST, Cho KS, Kim SG, et al. A rice isoflavone reductaselike gene, OsIRL, is induced by rice blast fungal elicitor[J]. Molecules & Cells, 2003, 16(2):224-231.
[19]Min T, Kasahara H, Bedgar D L, et al. Crystal structures of pinoresinol-lariciresinol and phenylcoumaran benzylic ether reductases and their relationship to isoflavone reductases[J]. Journal of Biological Chemistry, 2003, 278(50):50714-50723.
[20]Xu F, Cai R, Cheng Sǐ, et al. Molecular cloning, characterization and expression of phenylalanine ammonia-lyase gene from Ginkgo biloba[J]. African Journal of Biotechnology, 2008, 7(6)721-729.
[21]Shoji T, Winz R, Iwase T, et al. Expression patterns of two tobacco isoflavone reductase-like genes and their possible roles in secondary metabolism in tobacco[J]. Plant Molecular Biology, 2002, 50(3):427-440.
[22]段傳人, 王伯初, 徐世榮. 環境應力對植物次生代謝產物形成的作用[J]. 重慶大學學報:自然科學版, 2003, 26(10):67-71.
(責任編輯 李楠)
Cloning and Expression Analysis of Sugarcane Isoflavone Reductaselike(IRL)Gene
Xie Xiaona1Zhang Xiaoqiu1Shao Min1Zhu Hui1Yang Litao1,2Li Yangrui1,2
(1. College of Agriculture,Guangxi University,State Key Laboratory for Conservation and Utilization of Subtropical Agro-Bioresources,Nanning 530004;2. Sugarcane Research Center,Chinese Academy of Agricultural Sciences,Key Laboratory of Sugarcane Biotechnology and Genetic Improvement(Guangxi),Ministry of Agriculture,Guangxi Academy of Agricultural Sciences,Guangxi Key Laboratory of Sugarcane Genetic Improvement,Nanning 530007)
The SoIRL gene cDNA sequence was cloned from sugarcane variety GT11 using RT-PCR techniques. The bioinformatics methods were used to analyze the putative amino acid sequence, and Real-time PCR method was used to study the expression of SoIRL gene in different tissues and under different stresses. The results showed that the full-length cDNA of SoIRL(GenBank accession number:KF808324)in sugarcane was cloned. The sequence consists of 1 167 bp with an intact open reading frame of 927 bp, encoding a polypeptide of 303 amino acids. Phylogenetic tree analysis indicated that SoIRL was highlg closely related to IRL of Zea mays. Real-time PCR results showed that the SoIRL expressed in root, stalk and leaf. Furthermore, SoIRL transcription level was induced under the treatment of the bacterial of ratoon stuning diaease, low temperature, PEG, NaCl and ABA stresses, but the expression patterns were different. Gene SoIRL was firstly isolated and characterized from sugarcane(GT11), which may participate in sugarcane resistance to RSD, and also play a role in the sugarcane resistance to chilling, drought and salt stress environments.
Sugarcane SoIRL Gene cloning Expression analysis
2014-03-27
國家”863”計劃課題(2013AA102604),國家自然科學基金項目(31360293),國家國際合作項目(2013DFA31600),廣西科技合作與交流計劃項目(桂科合1347004-2),廣西自然科學基金創新團隊項目(2011GXNSFF018002),廣西自然科學基金項目(2012GXNSFDA053011)
謝曉娜,女,博士研究生,研究方向:作物栽培及生理基礎;E-mail:xiaonaxie@163.com
楊麗濤,教授,研究方向:甘蔗生理生化及分子生物學,E-mail:liyr@gxu.edu.cn;李楊瑞,教授,研究方向:甘蔗,E-mail:liyr@gxaas.net

