重組大腸桿菌表達水稻白葉枯病菌FtsZ蛋白
陳洋 黃運紅 李素珍 龍中兒
(江西師范大學生命科學學院,南昌 330022)
重組大腸桿菌表達水稻白葉枯病菌FtsZ蛋白
陳洋 黃運紅 李素珍 龍中兒
(江西師范大學生命科學學院,南昌 330022)
旨在通過現代分子生物學技術制備水稻白葉枯病菌FtsZ蛋白。以水稻白葉枯病菌總DNA為模板,采用巢式PCR方法擴增獲得水稻白葉枯病菌ftsZ基因,構建ftsZ基因的表達載體pET-22b-ftsZ,轉化表達宿主E. coli BL21后,經PCR、Nde I/ Xho I雙酶切及測序鑒定、陽性克隆子經IPTG誘導表達,融合蛋白經鎳柱純化后,通過SDS-PAGE和Western blotting分析鑒定。結果顯示,水稻白葉枯病菌ftsZ基因的重組表達載體構建成功,且陽性克隆子在IPTG的誘導下表達了FtsZ-6×His融合蛋白,并通過鎳柱純化獲得了電泳純的FtsZ-6×His融合蛋白。
FtsZ蛋白 水稻白葉枯病菌 大腸桿菌 基因重組
FtsZ蛋白是真核細胞微管蛋白的原核同系物,在細菌體內高度保守,具有GTPase活性,并能受GTP的誘導發生聚合,是原核生物細胞分裂的關鍵蛋白之一[1]。由于在細胞分裂中的重要作用及其高度的保守性,FtsZ是抗菌藥物開發的理想靶標之一[2]。水稻白葉枯病是水稻白葉枯病菌(Xanthomonas oryzae)引起的水稻生產上的嚴重病害之一,導致水稻葉片枯萎,光合作用受到妨礙,稻穗充實率降低,不實粒增加,同時可造成米質疏松脆裂,食味降低[3,4]。目前,常用手段是使用噻枯唑作為防治水稻白葉枯病的主要化學藥劑,但水稻白葉枯病菌對噻枯唑的敏感性逐漸下降,抗藥突變體已出現[5,6]。因此,研發經濟、高效、無毒的抗水稻白葉枯病菌的農用抗生素具有重要的意義。
本研究構建pET-22b-ftsZ重組表達載體,進行水稻白葉枯病菌FtsZ的體外表達,旨在為進一步構建靶向抑制FtsZ的抗生素篩選模型奠定基礎。
1 材料與方法
1.1 材料
1.1.1 菌種與質粒 水稻白葉枯病菌(X. oryzae),購自武漢大學中國典型培養物保藏中心(菌株保藏編號:CCTCC AB 91123),Escherichia coli DH5α感受態細胞和pMD19-T Vector克隆載體購自大連寶生物公司,E. coli BL21感受態細胞由南昌大學惠贈,
pET-22b(+)載體由本實驗室于-20℃冰箱保存。
1.1.2 培養基 NB液體培養基,LB固體培養基,LB液體培養基,SOC培養基。
1.1.3 試劑 DNA分子量標準、蛋白質分子量標準、限制性內切酶Nde I、Xho I為大連寶生物公司產品,GoldView、咪唑為Solarbio公司產品,胰蛋白胨和酵母提取物為Oxoid公司產品,Ezup柱式細菌基因組提取試劑盒、SanPrep柱式DNA凝膠回收試劑盒和SanPrep柱式質粒DNA小量提取試劑盒、SDS、Tris、IPTG、氨芐青霉素為生工生物工程(上海)有限公司產品,Protein IsoTMNi-NTA Resin和預染蛋白Marker為北京全式金產品,抗His標簽鼠單克隆抗體(一抗)和HRP標記的羊抗鼠多克隆抗體(二抗)為Sigma公司產品,其他試劑均為國產分析純。
1.2 方法
1.2.1 水稻白葉枯病菌總DNA的提取 采用上海生工生物工程Ezup柱式細菌基因組提取試劑盒提取,具體操作按說明書進行。
1.2.2 ftsZ基因的擴增 根據NCBI上X. oryzae pv. Oryzae KACC10331全基因組序列(ID:58155)及其ftsZ基因(ID:3264933),分別設計擴增ftsZ的引物(forward1:5'-GGCGAGCAGGTAGGCGGTAAAATT-3',backward1:5'-ACAATGCAGACAGACGCTGAATCGA-3')和特異性引物(forward2:5'-GGAATTCCATATGGCACATTTCGAACTGATTG-3',backward2:5'-CCGCTCGAGGTCGGCCTGGCGGCGCAGG-3')。50 μL PCR反應體系含TaKaRa LA Taq(5 U/μL)0.5 μL,2× GC PCR Buffer I 25 μL,dNTP Mixture(各2.5 mmol/L)8 μL,基因組DNA 1 μL,forward1(25 μmol/L)1 μL,backward1(25 μmol/L)1 μL,滅菌超純水13.5 μL。反應條件為:94℃預變性1 min;94℃變性1 min,57℃退火30 s,72℃延伸90 s,30個循環;72℃延伸 5 min。第二次PCR除更換引物,以第一次PCR產物為模板外,其余條件不變。擴增后,瓊脂糖凝膠電泳檢測擴增產物。
1.2.3 pET-22b-ftsZ重組質粒的構建 用上海生工SanPrep柱式DNA膠回收試劑盒回收目的條帶,按pMD19-T Vector說明書配置連接體系,并轉化入感受態細胞E. coli DH5α后,涂布于含50 μg/mL氨芐西林鈉的LB固體培養基,37℃培養12 h后提取質粒,通過質粒PCR及Nde I 和Xho I 限制性內切酶雙酶切鑒定出陽性克隆子后送上海生工測序[7]。
用 Nde I和Xho I限制性內切酶分別處理pET-22b(+)載體和目的基因片段,將處理后的質粒與目的基因連接,連接條件參考pMD19-T Vector說明書。重組質粒以同樣的方式轉入感受態E. coli BL21,以載體的氨芐抗性標記初篩轉化子,再提取質粒,以Nde I和Xho I限制性內切酶雙酶切及質粒PCR鑒定,將陽性克隆子送至上海生工測序[8]。
1.2.4 目的基因的誘導表達 取1 mL培養過夜的E.coli BL21陽性轉化子菌懸液接種于裝有50 mL LB液體培養基的錐形瓶中,200 r/min、37℃培養3 h[9],再加IPTG母液使其終濃度為0.6 mmol/L,繼續培養3 h。取誘導菌懸液1 mL于12 000 r/min 離心30 s,棄上清,加100 μL 1% SDS重懸菌體,沸水浴5 min后,SDS-PAGE電泳分析表達結果[10]。
1.2.5 目的蛋白的純化 取經IPTG誘導表達的菌懸液以8 000 r/min 離心20 min,棄上清,加10倍菌體質量的裂解液,超聲破碎(3 s工作,5 s間歇,99個循環,400 W功率)后,再12 000 r/min離心30 min,取上清上鎳柱純化,最后以1倍柱體積的500 mmol/L 咪唑平衡液洗脫目的蛋白。
1.2.6 Western blotting分析 按文獻[10]的方法進行。具體操作如下:將咪唑洗脫下的蛋白溶液進行SDS-PAGE電泳;剪一塊與膠大小相當的PVDF膜,以甲醇浸泡60 s活化,并放入轉膜液中,取3張經轉膜液浸泡過的大濾紙放在轉膜儀上,再依次放上PVDF膜、SDS-PAGE膠和3張經過轉膜液浸泡過的略小于膠的濾紙(注意避免產生氣泡),蓋上轉膜儀,連接電泳儀后,67 mA恒流60 min,將目的蛋白從聚丙烯酰胺凝膠上轉至PVDF膜上,而后將PVDF膜放入裝有5%脫脂牛奶的培養皿中封閉60 min,10 mmol/L的PBS洗滌4次。將PVDF膜放入含10 mL(1∶5 000,V/V)His一抗的培養皿中,室溫條件下中速水平搖床上孵育1 h,充分反應后,用0.01 mol/L PBS 洗滌4次,以除去未結合His一抗,后將與一抗反應的PVDF膜放入含10 mL(1∶5 000,V/V)羊抗鼠二抗的培養皿中,并在室溫條件下中速的水平搖床上反應30 min,再用0.01 mol/LPBS洗滌4次,
以除去未結合羊抗鼠二抗體;在避光條件下,將與二抗反應后的PVDF膜放入DAB顯色液中,反應10 min,0.01 mol/L PBS洗滌3次,晾干,照相保存。
2 結果
2.1 總DNA的提取
提取的水稻白葉枯病菌總DNA經1%的瓊脂糖凝膠電泳,結果(圖1)顯示,DNA條帶明顯,通過核酸分析檢測儀測得DNA濃度為81.8 μg/μL,豐度適宜,可用作PCR的模板。
圖1 水稻白葉枯病菌總DNA
2.2 目的基因的獲得
分別采用巢式PCR及普通PCR技術擴增目的基因,產物經1%瓊脂糖凝膠電泳檢測,結果(圖2)顯示,巢式PCR產物中的目的基因豐度和純度更高,符合預期目的。
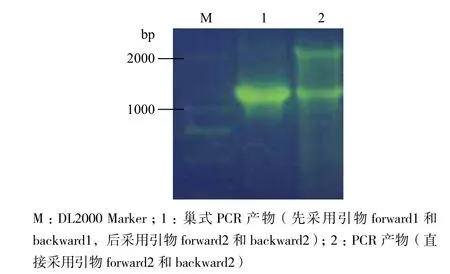
圖2 ftsZ的PCR產物
2.3 pMD19-ftsZ重組質粒鑒定
2.3.1 質粒PCR鑒定 質粒PCR結果(圖3)顯示,以基因組DNA及以pMD19-ftsZ重組質粒為模板都擴增出含有目的基因大小的條帶,說明pMD19-ftsZ重組質粒構建成功。
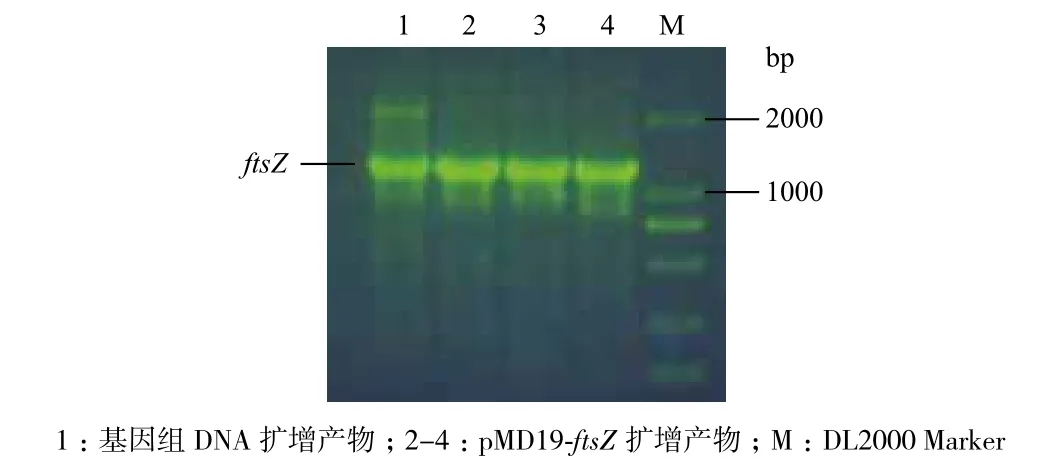
圖3 pMD19-T-ftsZ重組質粒的PCR鑒定圖
2.3.2 雙酶切鑒定 用Nde I和Xho I對pMD19-ftsZ重組質粒進行雙酶切后,結果(圖4)顯示,目的基因與pMD19-T Vector分離,大小符合預期。
2.4 pET-22b-ftsZ重組質粒鑒定
2.4.1 質粒PCR鑒定 pET-22b-ftsZ重組質粒的PCR結果(圖5)與重組載體pMD19-ftsZ的質粒PCR結果一致,說明ftsZ基因已轉入pET載體中。

圖5 pET-22b-ftsZ融合質粒PCR鑒定
2.4.2 雙酶切鑒定 用Nde I 和Xho I 對pET-22bftsZ重組質粒進行雙酶切后,結果(圖6)顯示,目的基因與pET-22b(+)質粒分離,大小符合預期。
2.5 測序鑒定
將測序結果與NCBI數據庫中X. oryzae pv. Ory-
zae KACC10331的ftsZ基因(ID:3264933)序列比對,兩者匹配度為100%。

圖6 pET-22b-ftsZ重組質粒的雙酶切鑒定
2.6 FtsZ蛋白的表達與純化
根據表達載體pET-22b(+)的特點及重組質粒pET-22b-ftsZ 的構建過程可以預測,E. coli BL21表達的FtsZ蛋白為一個C-末端帶有組氨酸標簽的融合蛋白(FtsZ-6×His融合蛋白),可以用鎳柱純化。FtsZ-6×His融合蛋白的表達與純化結果(圖7)顯示,在細胞破碎上清液的電泳條帶中,目的蛋白條帶明顯,證明目的蛋白以可溶的形式存在,其分子量略大于40 kD,符合預期估算的44 kD。純化的FtsZ-6×His 融合蛋白以單條帶的形式存在(圖7泳道1),表明經鎳柱純化的FtsZ蛋白達到電泳純。
同時,試驗采用Western blotting分析了宿主細胞破碎后的上清液和經鎳柱純化后的目的蛋白溶液,電泳條帶都在預期分子量大小的位點上顯色(圖8),結果證實了FtsZ蛋白表達成功,且表達的FtsZ蛋白為帶有組氨酸標簽的融合蛋白。
3 討論
目前,有關水稻白葉枯病的研究,主要集中在水稻白葉枯病菌的致病性相關基因[12,13]、水稻白葉枯病菌的遺傳多樣性[14,15]、水稻白葉枯病菌抗性水稻的選育[16,17]以及抗水稻白葉枯病菌的藥劑[18,19]等幾個方面。噻枯唑是防治水稻白葉枯病的主要化學藥劑,但水稻白葉枯病菌對噻枯唑的敏感性逐漸下降,抗藥突變體已出現[3,4],尚未找到能夠替代噻枯唑的有效化學藥劑。研發抗水稻白葉枯病菌的新型抗生素對水稻白葉枯病菌的防治具有重要意義。
新抗生素的研發策略主要有三,一是通過對已知抗生素的結構改造、甚至全合成的手段獲得已知抗生素的結構類似物[20,21],甚至全新結構的抗生素,以克服細菌的耐藥現象;二是不斷拓展抗生素來源,通過篩選新的微生物物種獲得新的抗生素[22,23];三是創新抗生素篩選模型,將傳統的抗生素離體篩選模型,如平板拮抗法、孢子萌發測定、杯碟法、紙片法等,發展到基于抗生素作用機理及特定靶標,尤其是全新靶標的高通量篩選模型[24,25]等。
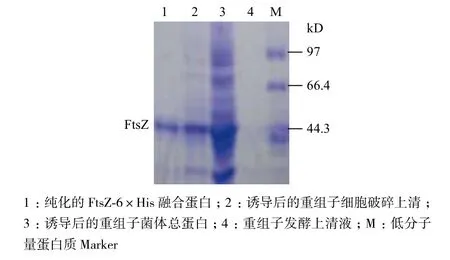
圖7 FtsZ蛋白的純化

圖8 純化FtsZ 的Western blotting分析
FtsZ蛋白是一種出現在原核細胞分裂位點上的第一個蛋白,起到細胞骨架作用,形成的FtsZ蛋白聚合體吸引與其結合的蛋白裝配成原絲,螺旋成為Z環,進一步吸引膜結合蛋白,通過直接或間接作用形成隔膜,然后引導整個分裂過程。它廣泛分布于原核生物細胞內,其保守性高,已成為抗細菌抗生素篩選的理想靶標[2,26]。本研究實現了水稻白葉枯病菌FtsZ蛋白的體外表達,為進一步開發靶向抑制FtsZ蛋白生物活性、進而抑制細胞分裂的抗水稻白葉枯病菌的抗生素奠定了堅實的基礎。
4 結論
本研究以水稻白葉枯病菌總DNA為模板,采用巢式PCR方法擴增獲得水稻白葉枯病菌ftsZ基因,構建了ftsZ基因的表達載體pET-22b-ftsZ。表達載體
轉化宿主E. coli BL21后,經IPTG誘導表達了FtsZ-6×His融合蛋白,并通過鎳柱純化獲得了電泳純的FtsZ-6×His融合蛋白。
[1]Fernando MG, Estefanía S, Jesús IM, et al. Molecular dynamics simulation of GTPase activity in polymers of the cell division protein FtsZ[J]. FEBS Letters, 2012, 586:1236-1239.
[2]Kapoor S, Panda D. Targeting FtsZ for antibacterial therapy:a promising avenue[J]. Expert Opinion on Therapeutic Targets, 2009, 13(9):1037-1051.
[3]González JF, Degrassi G, Devescovi G, et al. A proteomic study of Xanthomonas oryzae pv. oryzae in rice xylem sap[J]. Journal of Proteomics, 2012, 75:5911-5919.
[4]Mew TW, Alvare AM, Leach JE. Focus on bacterial blight of rice[J]. Plant Disease, 1993, 77(1):5-12.
[5]Zhu XF, Xu Y, Peng D, et al. Detection and characterization of bismerthiazol-resistance of Xanthomonas oryzae pv. Oryzae[J]. Crop Protection, 2013, 47:24-29.
[6]孫恢鴻.我國水稻白葉枯病菌致病力分化研究[J].植物保護, 2003, 29(3):5-8.
[7]朱清禾, 賈紅華, 李艷, 等. Rhodococcus erythropolis手性醇脫氫酶的克隆表達及其性質[J]. 微生物學報, 2012, 52:83-89.
[8]李承剛, 商慶龍, 谷鴻喜, 等. pET21b-HPV16E4重組質粒的構建及鑒定[J].哈爾濱醫科大學學報, 2007, 4(2):112-114.
[9]王光路, 夏俊剛, 謝希賢, 等.假交替單胞菌XM2107嘌呤核苷磷酸化酶基因克隆表達、重組蛋白純化及酶學性質[J].微生物學報, 2010, 50(2):222-227.
[10]劉箭.生物化學實驗教程[M].北京:科學出版社, 2004:94-101
[11]徐靜靜, 藺宇, 董立明, 等.用SSR標記和巢式PCR快速檢測大豆疫霉菌[J].中國農業科學, 2009, 42(5):1624-1630.
[12]Cho JH, Jeong KS, Han JW, et al. Mutation in clpxoo4158 reduces virulence and resistance to oxidative stress in Xanthomonas oryzae pv. oryzae KACC10859[J]. Plant Pathol J, 2011, 27:89-92.
[13]Li T, Huang S, Zhao X, et al. Modularly assembled designer TAL effector nucleases for targeted gene knockout and gene replacement in eukaryotes[J]. Nucleic Acids Res, 2011, 39:6315-6325.
[14]王春蓮, 章琦, 周永力, 等. 我國長江以南地區水稻白葉枯病原菌遺傳多樣性分析[J].中國水稻科學, 2001, 15(2):131-136.
[15]Yang SQ, Liu SY, Zhao S, et al. Molecular and pathogenic characterization of new Xanthomonas oryzae pv. oryzae strains from the coastline region of Fangchenggang city in China[J]. World J Microbiol Biotechnol, 2013, 29(4):713-720.
[16]Bhasin H, Bhatia D, Raghuvanshi S, et al. New PCR-based sequence-tagged site marker for bacterial blight resistance gene Xa38 of rice[J]. Molecular Breeding, 2012, 30:607-611.
[17]Feng JX, Cao L, Li J, et al. Involvement of OsNPR1 /NH1 in rice basal resistance to blast fungus Magnaporthe oryzae[J]. European Journal of Plant Pathology, 2011, 131(2):221-235.
[18]Zhu XF, Xu Y, Peng D, et al. Detection and characterization of bismerthiazol-resistance of Xanthomonas oryzae pv. Oryzae[J]. Crop Protection, 2013, 47:24-29.
[19]Davies J. How to discover new antibiotics:harvesting the parvome[J]. Curr Opin Chem Biol, 2011, 15(1):5-10.
[20]Yan RB, Yuan M, Wu Y, et al. Rational design and synthesis of potent aminoglycoside antibiotics against resistant bacterial strains[J]. Bioorg Med Chem, 2011, 19(1):30-40.
[21]Huigens-III RW, Reyes S, Reed CS, et al. The chemical synthesis and antibiotic activity of a diverse library of 2-aminobenzimidazole small molecules against MRSA and multidrug-resistant A. baumannii[J]. Bioorg Med Chem, 2010, 18(2):663-674.
[22]Fiedler HP, Bruntner C, Bull AT, et al. Marine actinomycetes as a source of novel secondary metabolities[J]. Antonie van Leeuwenhock, 2005, 87(1):37-42.
[23]Peric-Concha N, Long PF. Mining the microbial metabolome:a new frontier for natural product lead discovery[J]. Drug Discovery Today, 2003, 8(23):1078-1084.
[24]Heath RJ, Rock CO. Fatty acid biosynthesis as a target for novel antibacterials[J]. Current Opinion in Investigational Drugs, 2004, 5(2):146-153.
[25]Jain R, Chen D, White RJ, et al. Bacterial peptide deformylase inhibitors:a new class of antibacterial agents[J]. Current Medicinal Chemistry, 2005, 12(14):1607-1621.
[26]Singh P, Panda D. FtsZ inhibition:a promising approach for antistaphylococcal therapy[J]. Drug News & Perspectives, 2010, 23(5):295-304.
(責任編輯 馬鑫)
Expression of FtsZ Protein from Xanthomonas oryzae in Escherichia coli
Chen Yang Huang Yunhong Li Suzhen Long Zhonger
(College of Life Science,Jiangxi Normal University,Nanchang 330022)
It was to prepare FtsZ protein using techniques of modern molecular biology. The ftsZ gene was amplified from Xanthomonas oryzae by nested PCR, and recombinant plasmid pET-22b-ftsZ was constructed and transformed to E.coli BL21. The clony fragment was identificatified by PCR screening, Nde I/Xho I digestion and DNA sequencing, the positive clones were induced by IPTG for expression;the fusion protein was purified through Ni-NTA Resin, and identified by SDS-PAGE and Western blotting. Results showed that the recombinant plasmid pET-22b-ftsZ was constructed successfully, the FtsZ-6×His fusion protein was expressed in recombined E. coli BL21 induced by IPTG, and purified through Ni-NTA Resin by electrophoretic purity.
FtsZ protein Xanthomonas oryzae Escherichia coli Genetic recombination
2014-04-09
國家自然科學基金項目(31160029,31360018),江西省自然科學基金項目(20122BAB204008,20132BAB204007)
陳洋,男,碩士研究生,研究方向:微生物藥物學;E-mail:845487250@qq.com
龍中兒,男,博士,教授,研究方向:基礎和應用微生物學;E-mail:Longzhonger@163.com

