人組蛋白α-氨基乙酰基轉移酶Nat11表達純化、晶體生長及底物結合研究
黃嘉欣 李海濤
(清華大學醫學院基礎醫學系,北京 100086)
人組蛋白α-氨基乙酰基轉移酶Nat11表達純化、晶體生長及底物結合研究
黃嘉欣 李海濤
(清華大學醫學院基礎醫學系,北京 100086)
α-氨基乙酰基轉移酶11(Nat11)催化組蛋白H4和H2A氨基端乙酰化修飾,發揮著重要的表觀遺傳調控功能。將人Nat11基因構建到原核表達載體pSUMO中,轉化入大腸桿菌BL21(DE3)進行重組表達。通過鎳柱親和層析等一系列體外純化步驟,獲得高純度Nat11。利用等溫滴定量熱法(ITC),測得Nat11與底物多肽微摩爾量級結合常數。利用質譜技術,發現純化后的Nat11結合有大腸桿菌內源產生的乙酰輔酶A或輔酶A,在ITC滴定過程中可以產生對多肽底物的乙酰化修飾,表明純化獲得的Nat11在溶液中具有酶活力。隨后,對Nat11進行晶體生長研究,通過初篩優化獲得蛋白截短體及底物-酶融合蛋白單晶。
α-氨基乙酰基轉移酶11 重組蛋白表達 蛋白聚集 酶-底物結合 晶體生長
真核細胞中,蛋白質乙酰化是一種重要的翻譯后修飾。除了以賴氨酸為代表的氨基酸側鏈乙酰化之外,蛋白的N-末端也可以發生α-氨基乙酰化(N-alpha acetylation)。研究表明N-末端α-氨基乙酰化的蛋白質在哺乳動物細胞中占80%-90%,在酵母中約占50%-70%[1-3],是一種較為普遍存在的乙酰化修飾。真核生物體內,蛋白質N-末端乙酰化由α-氨基乙酰基轉移酶(N-alpha acetyltransferases,NATs)家族成員催化完成。在高等真核生物中,目前已鑒定出6種 NATs家族成員,分別為NatA[4]、NatB[5]、NatC[6]、NatD[7]、NatE[8]和NatF[9];其中前5種在酵母中也被報道存在。NATs能夠與核糖
體結合,以一種共翻譯修飾方式完成新生多肽鏈N-末端的乙酰化修飾。與此同時,尤其是在人體內,很大一部分的NATs可以游離于核糖體之外存在,發揮著共翻譯修飾以外的功能。蛋白氨基端乙酰化可以中和自由氨基端的正電荷,并引入額外的化學修飾基團,在蛋白質降解、蛋白-蛋白和蛋白-生物膜相互作用,以及蛋白質定位等細胞生理過程中發揮著重要調控功能。2011年,人們首次發現Nat基因突變是一種人類遺傳紊亂病——Ogden綜合癥的分子遺傳學病因[10]。患這種疾病的男孩出現全身發育延遲,而且在嬰兒期就會死去,充分顯示了蛋白N-末端乙酰化的重要性。
染色質的基本單位是核小體,每個核小體是由核心組蛋白八聚體以及纏繞在上面的147個堿基對DNA所組成。核心組蛋白八聚體包括H2A、H2B、H3和H4各兩分子[11,12],其中組蛋白上許多位點能發生翻譯后修飾,比如乙酰化、甲基化、磷酸化、泛素化、SUMO化等。這些組蛋白修飾及其組合被寬泛的定義為一類“組蛋白密碼”[13-15],發揮重要的基因表達和染色體結構調控作用。研究表明,組蛋白H2A、H2B和H4的N-末端也可以發生乙酰化修飾,而H3卻不發生該修飾[16]。其中,組蛋白H2B N-末端乙酰化由NatA負責[17],而組蛋白H2A和H4的 N-末端乙酰化卻是由Nat11(亦名NatD,Naa40p)來完成,表現出組蛋白氨基端乙酰化修飾的底物特異性。研究表明,NatA還能修飾除H2B以外的許多蛋白質底物;而與NatA不同,Nat11迄今為止被發現只能特異性地修飾H2A和H4[7,16,18]。人組蛋白H2A和H4的N-末端序列非常相似,分別為S1GRGKQGGK9和S1GRGKGGKG9,相似的序列可能是它們都能被Nat11催化的分子基礎。Nat11只有一個亞基,在細胞質中部分Nat11與核糖體共定位,暗示著伴隨H2A和H4的合成,新生組蛋白H2A、H4多肽的N-末端發生乙酰化修飾[13,19]。同時有試驗表明,人Nat11除了存在于細胞質中,在細胞核中也有分布[7]。另外,在小鼠腦細胞中有7%的H4 N-末端沒有乙酰化修飾[20],在HeLa細胞中也鑒定出約8.5%的H4 N-末端不帶乙酰基[21],這共同暗示了Nat11在細胞核中發揮某種調控作用。最近研究表明,H4 N-末端乙酰化會影響H4第3位精氨酸(H4R3)的甲基化以及核糖體DNA(ribosomal DNA,rDNA)沉默。Nat11缺失后,會導致H4R3出現非對稱二甲基化,同時rDNA沉默加劇[22]。由此可見,Nat11所催化的H4 N-末端乙酰化具有重要的表觀遺傳調控功能。
本研究表達純化人Nat11進行晶體生長研究,并利用等溫滴定量法測量Nat11與底物多肽、產物多肽的結合常數,旨在為進一步深入研究Nat11特異識別并催化組蛋白H2A和H4 N-末端乙酰化修飾的分子結構機制奠定基礎。
1 材料與方法
1.1 材料
本試驗所使用的表達載體為pSUMO10,改造于表達載體pET-28b,帶氨基端串聯10×His-SUMO標簽。PCR引物合成及基因測序由Invitrogen公司合成;PCR mixture為購自Genstar公司;限制性核酸內切酶及T4連接酶購自NEB公司;質粒抽提試劑盒和瓊脂糖凝膠DNA回收試劑盒為康為公司;蛋白質Marker、DNA Marker購自全式金公司;瓊脂糖購自BIOWEST公司;鎳親和層析預裝柱、分子篩HiLoad SuperdexTM75、脫鹽柱HiPrep 26/10 Desalting Column購自GE Healthcare公司。多肽人H4(1-9)、人acH4(1-9)、人H4(1-25),購自北京中科亞光公司。所使用的晶體篩選試劑盒購自Hampton Research公司和Emerald Biosystems公司;結晶試劑購自Sigma-Aldrich公司,均為分析純。
1.2 方法
1.2.1 人Nat11截短體及融合蛋白設計 將人Nat11與RimL進行序列比對,RimL為原核細胞鼠傷寒沙門菌蛋白質N-末端乙酰基轉移酶,結構已解。設計截短體人Nat11(21-237)和(21-223)。此外,為獲得人Nat11與底物H4的復合物結構,設計了底物-酶融合蛋白,將人H4 N-末端7肽(SGRGKGG)融合人Nat11(24-223)的N-末端,即H4(1-7)-Nat11(24-223)融合蛋白。
1.2.2 原核表達質粒構建 以人cDNA庫為模板,PCR擴增出Nat11全長及截短體基因,并連接到pSUMO載體上,轉化到大腸桿菌DH5α感受態中,培養單克隆,提取質粒測序,最后獲得人Nat11全
長及截短體的原核表達質粒。
1.2.3 人Nat11全長及截短體蛋白表達 將質粒轉化入大腸桿菌BL21(DE3)感受態細胞。挑取單克隆菌落37℃培養,至菌液OD600為0.8-1.0,降溫至25℃,加入異丙基-β-D-硫代半乳糖苷(IPTG)至0.2 mmol/L,過夜誘導。
1.2.4 重組蛋白鎳柱親和層析純化 收集菌體,用緩沖液20 mmol/L Tris(pH8.5),500 mmol/L NaCl重懸,破碎后高速離心。將上清液上樣到鎳柱,先用裂解緩沖液除去不結合鎳柱的雜蛋白,隨后逐漸提高咪唑濃度,重組蛋白在含約95 mmol/L咪唑的緩沖液中洗脫出來。蛋白溶液中加入含6×His標簽的重組SUMO蛋白酶ULP1,4℃過夜酶切SUMO。Nat11 N-末端的His-SUMO標簽蛋白會被ULP1切除。
1.2.5 目的蛋白與His-SUMO、His-ULP1分離 在過夜酶切的蛋白溶液加入10 mmol/L 二硫蘇糖醇(DTT),濃縮,過脫鹽柱HiPrep 26/10 Desalting Column,緩沖液為重懸緩沖液。蛋白溶液上樣到鎳柱,由于目的蛋白不帶有His標簽,不結合鎳柱,因此柱流出液中含有目的蛋白,將流出液收集即可得到目的蛋白。SUMO及ULP1的N端帶有His標簽,流經鎳柱時會與鎳柱結合,從而與目的蛋白分離。
1.2.6 分子篩進一步純化人Nat11蛋白溶液 加入新鮮DTT至5 mmol/L濃縮,上樣到分子篩HiLoad SuperdexTM75中,用緩沖液20 mmol/L HEPES(pH 7.5),100 mmol/L NaCl,2 mmol/L DTT洗脫。280 nm紫外分光檢測蛋白質濃度,分裝,在液氮中速凍,于-80℃保存。
1.2.7 全長蛋白晶體生長 人Nat11全長蛋白二聚體分別與CoA或AcCoA按摩爾比1∶3相混,冰上孵育2 h,使用商業試劑盒Structure Screen I、II,Crystal Screen I、II以及Natrix I進行初篩,坐滴,1 μL蛋白混合物溶液與1 μL結晶試劑相混,18℃靜置。長出晶體,并對條件進行優化。
1.2.8 截短體人Nat11(21-237)純化及晶體生長 截短體人Nat11(21-237)與AcCoA按摩爾比1∶3相混,冰上孵育2 h,篩選試劑盒Index和Structure Screen I、II時,在池液中添加新鮮DTT至10 mmol/L。長出晶體后,對條件進行優化。
1.2.9 底物-酶融合蛋白晶體生長 融合蛋白H4(1-7)-Nat11(24-237)與AcCoA按摩爾比1∶3相混,冰上孵育2 h,篩選試劑盒Index和Structure Screen I、II時。長出晶體后,對條件進行優化。
1.2.10 等溫滴定量熱法(ITC)測定截短體對底物及產物結合能力 在25℃ 1 mmol/L底物多肽H4(1-9)對0.1 mmol/L截短體Nat11(21-223)進行ITC滴定,用于稀釋多肽和蛋白的緩沖液成分為20 mmol/L HEPES(pH7.0),100 mmol/L NaCl。
1.2.11 質譜分析 將ITC滴定產物和底物-酶融合蛋白進行質譜MALDI-TOF分析。
2 結果
2.1 人Nat11原核表達質粒構建
pSUMO原核表達載體改造于pET-28b,N端標簽是帶有10個His的SUMO蛋白,SUMO對于蛋白質折疊有促進作用,能提高蛋白質的溶解度。蛋白酶ULP1特異性識別SUMO的三維結構,并在其C端酶切,酶切后目的蛋白的N-末端會殘留一個氨基酸絲氨酸。由于H4 N-末端第一位氨基酸正是絲氨酸,所以底物-酶融合蛋白使用pSUMO載體,能確保融合蛋白中底物位點不被屏蔽。此外,Nat11全長蛋白很難獲得單晶,因此通過與RimL序列比對,設計了截短體人Nat11(21-237)和(21-223)。
2.2 重組蛋白鎳柱純化結果
在25℃,0.2 mmol/L IPTG過夜誘導下,80%重組蛋白為可溶性表達。重組蛋白帶有His標簽,能與鎳柱結合,而雜蛋白不結合或只有微弱結合,因此鎳柱能分離重組蛋白與雜蛋白。咪唑會與重組蛋白競爭結合鎳柱,逐漸提高咪唑濃度,能將重組蛋白洗脫下來。重組蛋白在大約95 mmol/L咪唑濃度下被洗脫下來。
2.3 His-SUMO標簽蛋白與目的蛋白分離
鎳柱純化后,使用SUMO蛋白酶ULP1將Nat11 N端的標簽蛋白His-SUMO切掉。由于SUMO和ULP1的N端都有His標簽,通過再次過鎳柱,反掛除去,進而實現目的蛋白的純化。值得注意的是,經過第一次鎳柱純化后,溶液中含有咪唑,會影響His-SUMO及His-ULP1結合鎳柱,所以先使用脫鹽柱將咪唑除去。此外,上脫鹽柱前,蛋白質濃縮時加入DTT,由于DTT會螯合鎳柱上的鎳離子,所以
脫鹽柱緩沖液不含有DTT。利用脫鹽柱除去蛋白溶液中的咪唑及DTT。經SDS-PAGE鑒定,發現反掛鎳柱的流出液中不存在SUMO及ULP1組分,只有目的蛋白條帶。
2.4 分子篩純化Nat11及Nat11聚集研究
利用蛋白質分子量差異,使用分子篩HiLoad SuperdexTM75進一步純化蛋白質Nat11。濃縮及分子篩緩沖液中不含有還原劑時,全長蛋白過分子篩時發現出現3個峰(圖1-A),根據出峰位置與蛋白分子量的對應關系,這3個峰分別對應著高聚體,二聚體和單體。經SDS-PAGE檢測蛋白質純度,發現不管是二聚體蛋白還是單體蛋白,純度都達到95%以上,而高聚體則存在少量大分子量的雜蛋白。由于蛋白質分子發生聚集會導致狀態不均一,進而影響晶體生長。為解決這一問題,我們嘗試改變緩沖液pH。使用3種不同pH的緩沖液,分別為NaAc(pH4.5),Bis-Tris(pH6.3)和HEPES(pH7.5)發現在不同pH的緩沖液中,蛋白質依舊出現聚集峰,這說明pH改變并不能改善蛋白質聚集。分析Nat11序列發現,Nat11全長序列中含有10個半胱氨酸,可能會導致分子間交聯,引起蛋白質聚集,因此在濃縮過程加入新鮮DTT至5 mmol/L,并在分子篩緩沖液中也添加2 mmol/L DTT。經過分子篩后,發現高聚體和二聚體含量明顯下降,單體成為主要成分(圖1-B)。由此可見,使用還原劑DTT破壞二硫鍵形成,能有效改善蛋白的聚集行為。
2.5 等溫滴定量熱法(ITC)檢測Nat11對H4結合
還原劑DTT的存在會造成ITC滴定體系基線漂移。在沒有DTT的環境下,為盡量降低蛋白質的聚集情況,使用新鮮純化的截短體Nat11(21-223)單體進行ITC滴定。分別使用底物H4(1-9)多肽和產物acH4(1-9)多肽滴定蛋白,測量結合常數。經后續質譜檢測,發現蛋白溶液中含有AcCoA和CoA,所以底物多肽滴定時會發生乙酰化反應,另外結合的AcCoA可能會對產物多肽與蛋白結合有抑制作用,所以測得的結合常數為表觀結合常數,底物多肽與蛋白的表觀結合常數(Kd)為1.1 μM;產物多肽與蛋白的表觀結合常數為4.6 μM(圖2)。

圖1 人Nat11全長蛋白聚集情況
2.6 質譜結果分析
將用于進行ITC的蛋白溶液進行質譜分析,發現溶液中存在AcCoA和CoA(圖3-A),由于蛋白質表達以及純化時并沒有添加AcCoA和CoA,因此推測來源于大腸桿菌,Nat11在表達及后續純化過程中,一直保持結合狀態。所結合的CoA是發生催化反應后由AcCoA轉變而來的,還是直接結合的,還需要進一步確證。底物H4(1-9)多肽滴定蛋白質后,質譜分析發現,溶液中同時存在H4(1-9)和乙酰化的H4(1-9)(圖3-B),而且只有CoA,并沒有AcCoA,這說明了在滴定時,發生了乙酰化反應,與蛋白質結合的AcCoA被消耗完,但由于蛋白含量少于AcCoA,所以只有部分底物被乙酰化。此外,產物多肽滴定蛋白質,無法發生乙酰化反應,所以同時存在AcCoA和CoA。
由于Nat11在表達純化過程中結合大腸桿菌中的AcCoA,因此猜測底物-酶融合蛋白表達時也會結合AcCoA。質譜分析融合蛋白,發現只有CoA,沒有AcCoA,而且蛋白質的分子質量比理論分子質量多了42(圖3-D),為一個乙酰基的大小,這表明融
合蛋白確實結合了大腸桿菌中的AcCoA,并且利用其作為底物,發生了自我乙酰化。
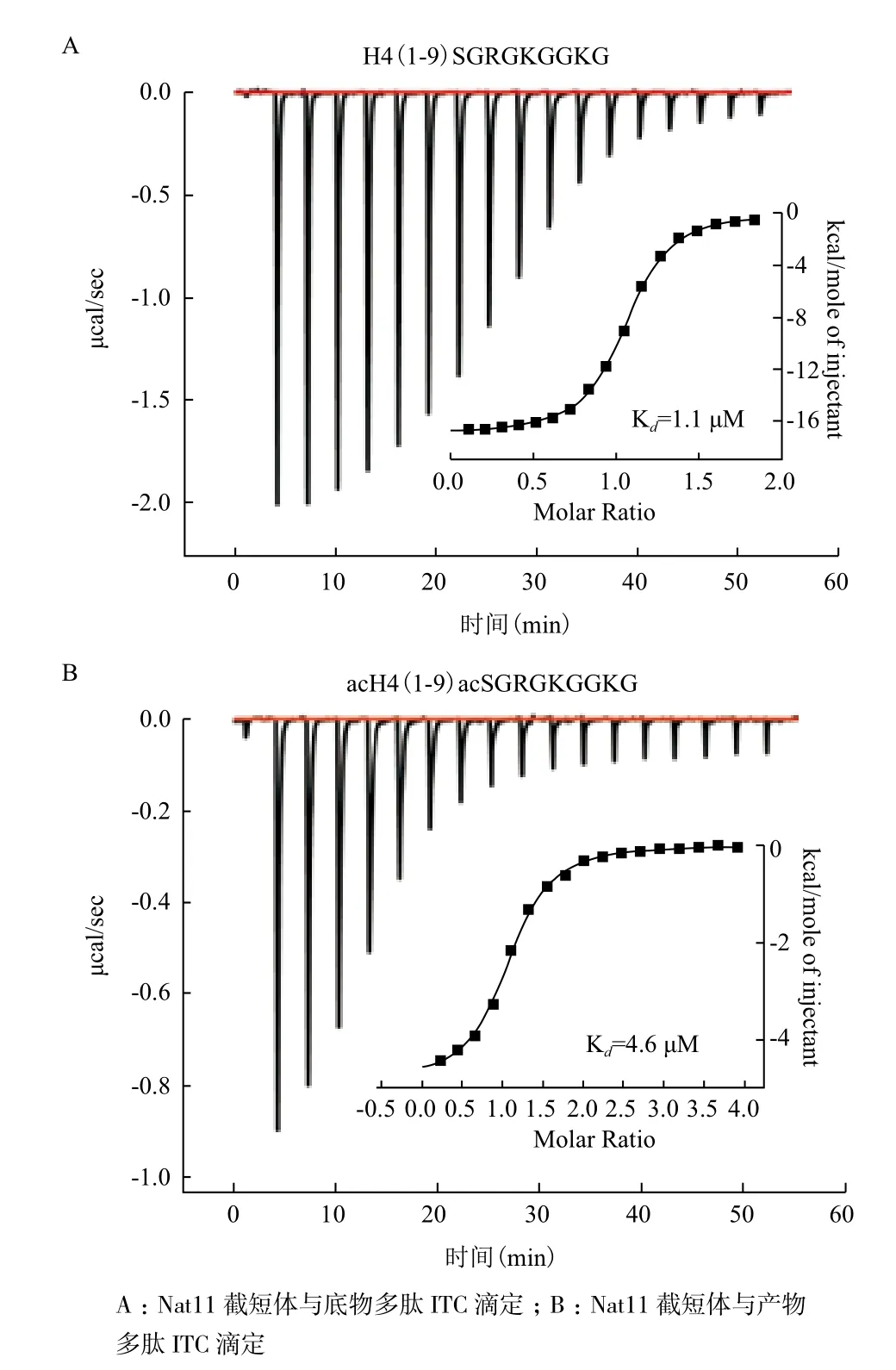
圖2 等溫滴定量熱法測量Nat11截短體(21-223)與底物多肽、產物多肽的表觀結合常數
2.7 晶體生長
把人Nat11全長蛋白與CoA或AcCoA相混進行晶體生長,可以在多個條件長出成簇針狀微晶(圖4-A),但難以優化并進行衍射數據收集。為解決該問題,嘗試使用截短體Nat11(21-237)進行晶體篩選,最后在Structure Screen I 的第7號條件:0.2 mol/L NH4Ac,0.1 mol/L Na3Citrate,pH5.6,30% PEG 4K,10 mmol/L DTT 中長出截短體Nat11與AcCoA復合物的片狀晶體(圖4-B)。隨后優化條件,最后沉淀劑換成30% PEG 3350,能重復出一樣的晶體。在點晶體時發現,將蛋白質與結晶試劑相混,會立刻出現白色小顆粒狀沉淀,隨著沉淀劑PEG 3350的濃度提高,沉淀會變嚴重。但18℃靜置1 d后,沉淀就會消失,隨后晶體長出來。
由于質譜結果(圖3-D)顯示,底物-酶融合蛋白能發生自我乙酰化,所以推測底物部分與酶結合了,故用此融合蛋白進行晶體生長,獲得復合物結構。底物-酶融合蛋白與AcCoA及CoA混合物均在Structure Screen II的1號條件:0.1 mol/L sodium chloride,0.1 mol/L Bicine(pH9.0),30% PEG 550 MME中10 d后長出晶體(圖4-C)。
3 討論
在真核細胞中,蛋白質N-末端乙酰化普遍存在,其中核小體核心組蛋白H2A、H2B和H4都能發生該修飾,而H3則不發生。特異性乙酰化H2A和H4的酶是Nat11,人Nat11在細胞核中有分布,暗示著Nat11在細胞核中起著某種調控作用。
本試驗根據序列比對及序列分析,構建Nat11全長蛋白、截短體以及底物-酶融合蛋白-pSUMO原核表達體系。經大腸桿菌表達,經過鎳柱親和層析初步純化,ULP1酶切His-SUMO,脫鹽柱除咪唑,二次鎳柱除去His-SUMO及His-ULP1,最后通過分子篩,對蛋白質進一步純化。使用的分子篩是HiLoad SuperdexTM75,分離范圍為3-70 kD。由于分子篩對上樣量的體積有要求,所以在上分子篩前需要濃縮蛋白質。濃縮后過分子篩,發現出現蛋白質高聚體峰,二聚體峰和單體峰,表明發生了蛋白質聚集,而且有高聚化。通過改變分子篩緩沖液pH值,發現對于聚集問題并沒有改善。分析全長序列發現,Nat11含有10個半胱氨酸,聚集可能是由于分子間產生二硫鍵交聯,因此在濃縮時加入5 mmol/L DTT,并在分子篩緩沖液中加入2 mmol/L DTT,此時發現高聚體和二聚體含量明顯下降,單體成為主要成分,由此說明蛋白聚集是因為分子間形成二硫鍵,使用還原劑能極大地改善這一現象。

圖3 ITC滴定體系及底物-酶融合蛋白質譜結果
從質譜結果得知,高純度Nat11截短體(21-223)溶液中含有AcCoA和CoA,由于沒有人為添加,所以AcCoA和CoA均為大腸桿菌內源產生,而且在純化時一直與蛋白結合。Nat11結合AcCoA,在底物多肽ITC滴定蛋白質時,發生了乙酰基轉移反應。
由于Nat11含量低于多肽,即與蛋白結合的AcCoA含量低于多肽,所以只有部分底物多肽被乙酰化,全部AcCoA轉化為CoA。產物多肽滴定蛋白,沒有乙酰化反應,AcCoA和CoA共存。H4多肽對Nat11滴定峰為倒峰,意味著結合是放熱反應。而底物多肽滴定時發生的乙酰化反應也是放熱反應,所以ITC量熱應為兩者的共同貢獻,所測得的表觀結合常數1.1 μM應比實際結合常數大。部分Nat11結合AcCoA,AcCoA的存在可能對產物多肽結合蛋白有抑制作用,所以測得的表觀結合常數4.6 μM應比實際結合常數小。從兩個反應的表觀結合常數可看出,底物和產物與蛋白的實際結合常數均應為4.6-1.1 μM之間。后續將通過設計不影響結合的催化殘基突變體,來測定實際結合常數。

圖4 Nat11晶體生長
另外,質譜分析底物-酶融合蛋白溶液,發現溶液中只含有CoA,并且蛋白質的分子量比理論分子量多了42,正好是一個乙酰基的大小,因此我們認為,融合蛋白也能在表達時結合大腸桿菌生產的AcCoA,并且發生自身乙酰化。
4 結論
本研究成功將人Nat11全長,截短體及底物-酶融合蛋白基因構建到原核表達載體,利用一系列純化手段,獲得了高純度Nat11,發現還原劑DTT能改善蛋白質聚集這一問題。使用高純度Nat11進行晶體生長,最后獲得截短體(21-237)以及底物-酶融合蛋白單晶。同時ITC測得Nat11與底物多肽微摩爾量級結合常數。質譜結果顯示,Nat11及底物-酶融合蛋白在表達純化時會結合大腸桿菌生產的AcCoA及CoA,底物-酶融合蛋白還會發生自身乙酰化。
[1]Starheim KK, Gevaert K, Arnesen T. Protein N-terminal acetyltransferases:when the start matters[J]. Trends in Biochemical Sciences, 2012, 37(4):152-161.
[2]Arnesen T, Van Damme P, Polevoda B, et al. Proteomics analyses reveal the evolutionary conservation and divergence of N-terminal acetyltransferases from yeast and humans[J]. Proceedings of the National Academy of Sciences, 2009, 106(20):8157-8162.
[3]Polevoda B, Sherman F. N-terminal acetyltransferases and sequence requirements for N-terminal acetylation of eukaryotic proteins[J]. Journal of Molecular Biology, 2003, 325(4):595-622.
[4]Gromyko D, Arnesen T, Ryningen A, et al. Depletion of the human Nα-terminal acetyltransferase A induces p53-dependent apoptosis and p53-independent growth inhibition[J]. International Journal of Cancer, 2010, 127(12):2777-2789.
[5]Starheim K, Arnesen T, Gromyko D, et al. Identification of the human Nalpha-acetyltransferase complex B(hNatB):a complex important for cell-cycle progression[J]. Biochem J, 2008, 415:325-331.
[6]Starheim KK, Gromyko D, Evjenth R, et al. Knockdown of human Nα-terminal acetyltransferase complex C leads to p53-dependent apoptosis and aberrant human Arl8b localization[J]. Molecular and Cellular Biology, 2009, 29(13):3569-3581.
[7]Hole K, Van Damme P, Dalva M, et al. The human N-alphaacetyltransferase 40(hNaa40p/hNatD)is conserved from yeast and N-terminally acetylates histones H2A and H4[J]. PloS One, 2011, 6(9):e24713.
[8]Evjenth R, Hole K, Karlsen OA, et al. Human Naa50p(Nat5/San)displays both protein Nα-and Nε-acetyltransferase activity[J]. Journal of Biological Chemistry, 2009, 284(45):31122-31129.
[9]Van Damme P, Hole K, Pimenta-Marques A, et al. NatF contributes to an evolutionary shift in protein N-terminal acetylation and is important for normal chromosome segregation[J]. PLoS Genetics, 2011, 7(7):e1002169.
[10]Rope AF, Wang K, Evjenth R, et al. Using VAAST to identify an X-linked disorder resulting in lethality in male infants due to N-terminal acetyltransferase deficiency[J]. The American Journal of Human Genetics, 2011, 89(1):28-43.
[11]Kornberg RD, Lorch Y. Twenty-five years of the nucleosome, fundamental particle of the eukaryote chromosome[J]. Cell, 1999, 98(3):285-294.
[12]Luger K, Richmond TJ. The histone tails of the nucleosome[J]. Current Opinion in Genetics & Development, 1998, 8(2):140-
146.
[13]Strahl BD, Allis CD. The language of covalent histone modifications[J]. Nature, 2000, 403(6765):41-45.
[14]Portela A, Esteller M. Epigenetic modifications and human disease[J]. Nature Biotechnology, 2010, 28(10):1057-1068.
[15]Egger G, Liang G, Aparicio A, Jones PA. Epigenetics in human disease and prospects for epigenetic therapy[J]. Nature, 2004, 429(6990):457-463.
[16]Song OK, Wang X, Waterborg JH, Sternglanz R. An Nalpha-acetyltransferase responsible for acetylation of the N-terminal residues of histones H4 and H2A[J]. The Journal of Biological Chemistry, 2003, 278(40):38109-38112.
[17]Mullen JR, Kayne P, Moerschell R, et al. Identification and characterization of genes and mutants for an N-terminal acetyltransferase from yeast[J]. The EMBO Journal, 1989, 8(7):2067-2075.
[18]Polevoda B, Hoskins J, Sherman F. Properties of Nat4, an N(alpha)-acetyltransferase of Saccharomyces cerevisiae that modifies N termini of histones H2A and H4[J]. Molecular and Cellular Biology, 2009, 29(11):2913-2924.
[19]Polevoda B, Brown S, Cardillo TS, et al. Yeast N(alpha)-terminal acetyltransferases are associated with ribosomes[J]. Journal of Cellular Biochemistry, 2008, 103(2):492-508.
[20]Tweedie-Cullen RY, Brunner AM, Grossmann J, et al. Identification of combinatorial patterns of post-translational modifications on individual histones in the mouse brain[J]. PloS One, 2012, 7(5):e36980.
[21]Young NL, DiMaggio PA, Plazas-Mayorca MD, et al. High throughput characterization of combinatorial histone codes[J]. Molecular & Cellular Proteomics, 2009, 8(10):2266-2284.
[22]Schiza V, Molina-Serrano D, Kyriakou D, et al. N-alpha-terminal acetylation of histone H4 regulates arginine methylation and ribosomal DNA silencing[J]. PLoS Genetics, 2013, 9(9):e1003805.
(責任編輯 馬鑫)
Expression,Crystallization and Substrate Binding Studies of Human Histone N-terminal Acetyltransferase Nat11
Huang Jiaxin Li Haitao
(Department of Basic Medical Sciences,School of Medicine,Tsinghua University,Beijing 100086)
The alpha-amino groups of histones H4 and H2A can be acetylated by histone N-terminal acetyltransferase 11(Nat11), which plays an important role in epigenetic regulation. The cDNA of human Nat11 was amplified and cloned into pSUMO vector. The resultant construct was transformed into E.coli strain BL21(DE3)for recombinant protein expression. Homogenous Nat11 was highly purified through a series of purification procedures including nickel column affinity chromatography. Using isothermal titration calorimetry(ITC), we measured micromolar binding constants between Nat11 and histone H4 peptides. MALDI-TOF mass spectrometry analysis revealed that purified Nat11 was pre-bound with acetyl coenzyme A or coenzyme A that was co-purified from E.coli. After ITC titration using unmodified peptide as ligand, N-acetylated product was detected by mass spectrometry, suggesting that the purified Nat11 is active. We performed crystallization screening and successfully obtained single crystal of a truncate form of Nat11 and substrate-enzyme recombinant protein after optimization.
Alpha-amino acetyltransferase 11 Recombinant protein expression Protein aggregation Enzyme-substrate binding Crystallization
2014-04-08
科技部“973”項目(2011CB965303),2012教育部新世紀優秀人才支持計劃
黃嘉欣,女,碩士研究生,研究方向:結構表觀遺傳學;E-mail:hjx.star@163.com
李海濤,博士,教授,研究方向:結構表觀遺傳學;E-mail:lht@tsinghua.edu.cn

