神經肽Y及其Y1受體在遺傳性癲癇大鼠腦內的表達及意義
徐曉雪,郭鳳,王千慧,張朝東,楊軍,趙久晗,蔡際群
(中國醫科大學1.附屬第一醫院神經內科;2.神經病學研究所;3.藥學院藥物毒理教研室,沈陽110001)
神經肽Y及其Y1受體在遺傳性癲癇大鼠腦內的表達及意義
徐曉雪1,2,郭鳳3,王千慧3,張朝東1,2,楊軍1,2,趙久晗1,2,蔡際群3
(中國醫科大學1.附屬第一醫院神經內科;2.神經病學研究所;3.藥學院藥物毒理教研室,沈陽110001)
目的探討遺傳性癲癇大鼠(TRM)海馬和顳葉皮質中神經肽Y(NPY)及其Y1受體(Y1R)的表達和分布。方法逆轉錄聚合酶鏈反應(RT-PCR)檢測NPY和Y1RmRNA表達。ELISA試劑盒法檢測TRM和Wistar大鼠海馬和顳葉皮質中NPY濃度。Western blot檢測Y1R蛋白表達。免疫熒光雙標記法分析TRM及Wistar大鼠海馬CA1、CA3和DG區以及顳葉皮質中NPY與Y1R的分布和共定位。結果ELISA和RT-PCR結果均顯示,TRM海馬和顳葉皮質中NPY表達明顯上調,與Wistar大鼠比較差異有統計學意義(P<0.01)。Western blot結果證實,TRM海馬中Y1R蛋白表達明顯低于Wistar大鼠,而在顳葉皮質中顯著高于Wistar大鼠。免疫熒光分析發現NPY與Y1R在TRM海馬CA1、CA3區神經元細胞和DG區顆粒細胞以及顳葉皮質神經元細胞中分布廣泛,并存在共定位且主要定位在細胞膜上。結論在TRM海馬和顳葉皮質中,NPY及其Y1R表達出現異常變化,而這種異常表達可能與TRM癲癇發生機制有關。
癲癇;神經肽Y;Y1受體;亞型;海馬;顳葉皮質
癲癇是一種以大腦神經元異常放電為特征的神經系統常見疾病[1],其發病機制非常復雜,至今沒有完全闡明。近年研究發現誘發癲癇發病的主要因素除了與神經元興奮性異常增高有關,還可能與機體自身缺乏有效的抑制性神經信息傳遞有密切聯系。神經肽Y(neuropeptide Y,NPY)是由36個氨基酸構成的一種活性多肽。由Lund berg等[2]于1982年首次從豬腦中提取,在哺乳動物中樞神經系統中NPY是含量最豐富的多肽之一。由于其在海馬結構中濃度最高,并且能夠與經典的抑制性氨基酸γ-氨基丁酸共存,因此NPY被認為是一種內源抑制性神經肽,參與調節神經元興奮性[3]。Y1受體(Y1 receptor,Y1R)是重要的NPY受體亞型,屬于G蛋白偶聯受體家族,廣泛分布在海馬、皮質等部位的中間神經元中。在紅藻氨酸致癇模型中,NPY與Y1R結合后,可以通過G蛋白降低神經元興奮性[4]。而在不同的致癇模型中,NPY及其Y1R的表達和功能也可能有差異。
由日本京都大學首次發現的遺傳性癲癇大鼠(Tremor rat,TRM)在10號染色體上存在Tm基因突變,出生8周后無需外加物理化學因素刺激而出現自發性抽搐以及失神樣的癲癇發作,是研究癲癇小發作的理想模型[5,6]。目前關于TRM腦內NPY及其受體的表達變化未見報道。因此,本研究擬利用分子生物學檢測方法探討NPY及其Y1R在TRM癲癇發生中的作用,為進一步開發抗遺傳性癲癇特異性藥物和基因治療提供理論依據。
1 材料與方法
1.1 實驗動物與試劑
日本京都大學饋贈TRM種鼠,由中國醫科大學自行繁殖;健康Wistar大鼠由中國醫科大學實驗動物部提供。模型組TRM和對照組Wistar大鼠均為9~12周齡,雌雄不限,在每項實驗中各8只。TRIzol購自美國Sigma公司,NPY、Y1R和GAPDH引物由TaKaRa公司合成,ELISA試劑盒購于武漢優爾生公司,一抗NPY小鼠單克隆抗體和Y1R兔多克隆抗體購自美國ABCAM公司,一抗GAPDH小鼠單克隆抗體購自美國Santa Cruz公司。
1.2 逆轉錄聚合酶鏈反應(reverse transcription polymerase chain reaction,RT-PCR)檢測NPY與Y1RmRNA水平表達
TRM和Wistar大鼠麻醉后斷頭,迅速取出全腦,剝離海馬和顳葉皮質,參照TRIzol說明書提取總RNA,紫外分光光度計測定RNA濃度和純度。取1 μg總RNA樣本模板于10 μL逆轉錄反應體系中,參照TaKaRa逆轉錄反應試劑盒操作。反應條件為37℃反應15 min,85℃反應5 s,反應體積為25 μL。采用GAPDH為內參,反應條件為95℃反應45 s,60℃反應50 s,72℃反應90 s,72℃反應5 min,共30個循環。陰性對照模板為ddH2O,其余體系組分以及反應條件均與實驗組相同。反應產物經2%瓊脂糖凝膠電泳后分析比對灰度值。以NPY和Y1R與GAPDH灰度值的比值為mRNA相對表達量。各目的基因PCR反應引物序列:NPY:上游5′-TAGGT AACAAACGAATGGGG-3′,下游5′-AGGATGAGAT GAGATGTGGG-3′;Y1R:上游5′-CGTTAGGCCATT CACAAGAATGAAG-3′,下游5′-ATGCTCTGATGAG CGATGCAA-3′;GAPDH:上游5′-GGCACAGTCAAG GCTGAGAATG-3′,下游5′-ATGGTGGTGAAGACGC CAGTA-3′。
1.3 ELISA試劑盒檢測NPY蛋白濃度
乙醚麻醉TRM和Wistar大鼠,斷頭取腦后快速分離海馬和顳葉皮質。提取總蛋白并測濃度,將所用樣品濃度統一稀釋到3 μg/μL。其余步驟按照ELISA試劑盒說明書操作。所有試劑盒內試劑和樣品室溫平衡30 min。在確保酶標板板底無水滴和孔內無氣泡后,立即用酶標儀在450 nm波長測量各孔的光密度值。
1.4 Western blot檢測Y1R蛋白水平表達
將剝離的海馬和顳葉皮質加入RIPA裂解液以及蛋白酶抑制劑混合物,勻漿超聲后低溫離心取上清液,提取樣本總蛋白用BCA法測定蛋白濃度,加入上樣緩沖液煮沸變性后取60 μg/孔,5%濃縮膠和12%分離膠進行SDS-PAGE電泳,濃縮膠電壓80 V 60 min,分離膠電壓120 V 80 min。之后轉印至PVDF膜(200 mA,1.5 h)。5%BSA常溫封閉1 h后分別加入一抗Y1R(1∶500)和GAPDH(1∶1 500),4℃過夜孵育。次日TBST洗膜后,加入相應的二抗(羊抗兔1∶3 000,羊抗小鼠1∶3 000),37℃孵育1 h,TBST洗膜后ECL化學發光,測定分析灰度值,將Y1R與GAPDH灰度值的比值作為蛋白相對表達量。
1.5 免疫熒光雙標記染色檢測NPY與Y1R分布
TRM和Wistar大鼠麻醉后,4%多聚甲醛心臟灌流,迅速取腦,4%多聚甲醛固定24 h,30%蔗糖沉糖24 h OCT復合物包埋,冰凍切片機進行10 μm厚的連續冠狀切片。0.01 mol/L PBS漂洗3次,每次10 min,1%正常牛血清蛋白及0.2%Triton X-100孵育90 min,分別加入兔抗Y1R(1∶50)和小鼠抗NPY一抗(1∶40)混合物,4℃濕盒過夜。次日PBS清洗,在暗室中加入FITC標記羊抗兔(1∶200)和Cy3標記羊抗小鼠(1∶200)二抗混合物,避光孵育2 h后加入DAPI(1∶500)標記細胞核并封片。400倍熒光顯微鏡下觀察并統計陽性細胞數。陰性對照一抗由PBS代替,其余步驟均相同。
1.6 統計學處理
2 結果
2.1 NPY在TRM海馬和顳葉皮質中表達上調
利用RT-PCR檢測NPY在TRM腦內mRNA水平表達,如圖1結果顯示,NPY在TRM和Wistar大鼠中的相對灰度值海馬分別為0.76±0.10和0.43±0.08,顳葉皮質分別為0.74±0.08和0.49±0.10。說明相較于Wistar大鼠,TRM海馬和顳葉皮質中NPYmRNA相對表達量出現顯著上調(均P<0.01)。
由于NPY的分子量很小,因此選擇ELISA試劑盒分析NPY在TRM腦內的蛋白濃度,結果顯示,TRM海馬和顳葉皮質中的NPY含量分別為(56.93±3.77)和(48.12±3.13)pg/mL,Wistar大鼠分別為(23.18±2.15)和(19.17±2.32)pg/mL,TRM海馬和顳葉皮質中的NPY含量均比Wistar大鼠相應部位含量多(均P<0.01)。與RT-PCR實驗結論基本一致。
2.2 Y1R在TRM海馬和顳葉皮質中表達異常
RT-PCR檢測TRM腦內Y1RmRNA水平表達。如圖1顯示,在TRM和Wistar大鼠海馬中,Y1RmRNA表達相對灰度值分別為0.52±0.12和0.90± 0.12,而在顳葉皮質中分別為0.91±0.08和0.59± 0.11。說明相較于Wistar大鼠,Y1RmRNA水平表達在TRM海馬中顯著降低,而在其顳葉皮質中則明顯增高(均P<0.01)。
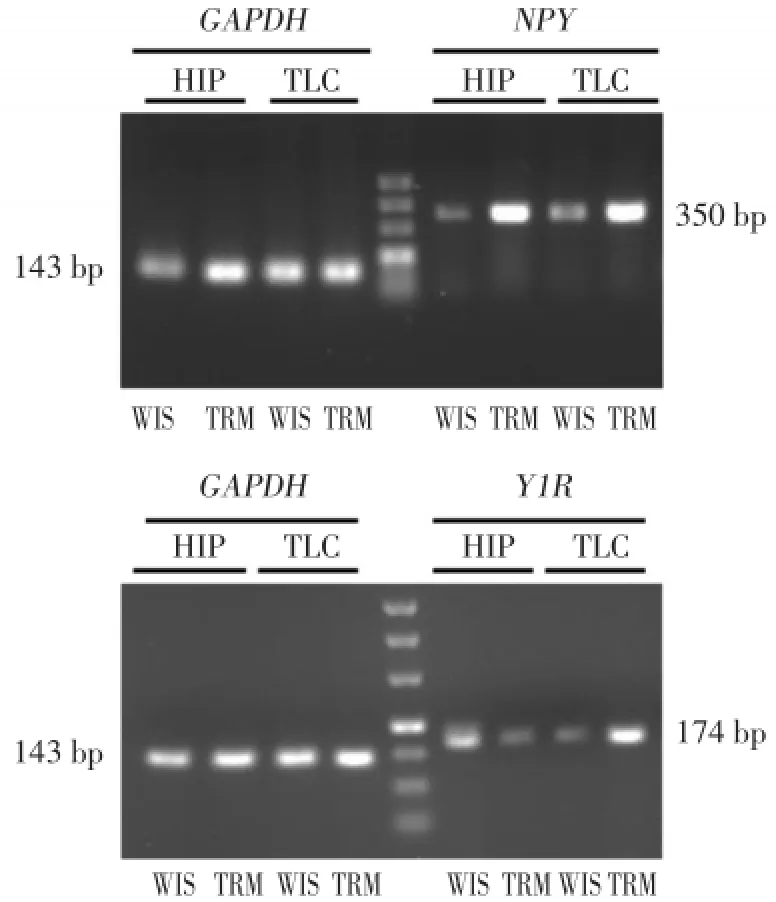
圖1 RT-PCR檢測NPY和Y1R在各組大鼠腦內的表達Fig.1 The mRNA expression of NPY and Y1R in TRM and Wistar brain subareas detected by RT-PCR
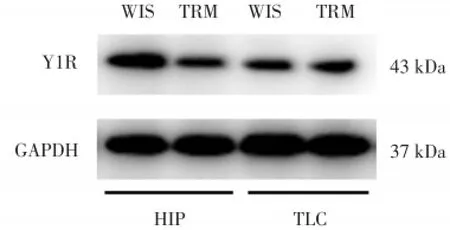
圖2 Western blot檢測Y1R在各組大鼠腦內的蛋白表達Fig.2 The protein expression of Y1R detected by Western blot in TRM and Wistar brain subareas
Western blot檢測TRM腦內Y1R蛋白水平表達。如圖2顯示,TRM海馬和顳葉皮質中Y1R蛋白表達相對灰度值分別為0.50±0.06和0.49±0.04,而Wistar大鼠分別為0.79±0.08和0.35±0.04,說明相較于Wistar大鼠,Y1R蛋白水平表達在TRM海馬中明顯下降,而在其顳葉皮質中則顯著升高(均P<0.01)。進一步驗證了RT-PCR實驗結論。
2.3 免疫熒光雙標記法檢測TRM腦內NPY與Y1R分布
免疫熒光檢測了NPY和Y1R在TRM腦內的分布以及共定位情況。如圖3顯示,NPY和Y1R在TRM海馬CA1、CA3、DG區以及顳葉皮質區都有廣泛的分布和共定位,包括CA1和CA3錐體細胞層以及DG區的顆粒細胞層。其中Y1R主要定位在細胞膜以及神經元部分軸突上。通過統計100個細胞中的陽性細胞數我們發現,相較于Wistar大鼠,Y1R與NPY共定位的陽性細胞在TRM海馬CA1和CA3數量顯著減少,在DG的數量無明顯變化,但是在顳葉皮質區數量增多,見表1。
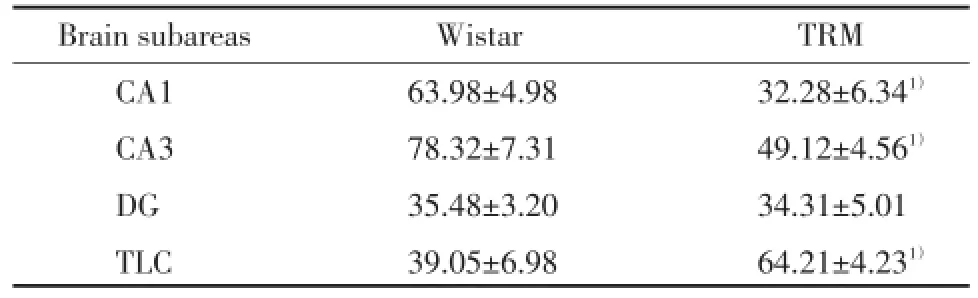
表1 TRM腦內不同部位中NPY與Y1R共定位陽性細胞數統計Tab.1 The number of positive cells with co-localized NPY and Y1R in TRM brain subareas
3 討論
本研究的主要目的是研究NPY和Y1R在TRM海馬和顳葉皮質的表達和分布。我們首次發現相較于正常Wistar大鼠,NPY在TRM海馬以及顳葉皮質中表達異常增加,Y1R在TRM海馬中表達明顯減少,而在顳葉皮質中表達顯著上調。免疫熒光雙標記檢測結果也證實,NPY和Y1R在TRM海馬CA1、CA3和DG以及顳葉皮質區域都有廣泛的分布和共定位。
作為一種突觸前抑制劑,NPY能夠通過抑制谷氨酸的釋放來調控神經元興奮性。因此當癲癇發作造成神經元損傷時,NPY介導的內源性神經保護功能可能被啟動。在紅藻氨酸注射誘導致癇的大鼠模型中,在海馬中間神經元能夠觀察到NPY表達的持續增加[7,8]。這與我們的實驗結果基本一致。Mao等[9]前期研究發現TRM腦內谷氨酸和γ-氨基丁酸濃度失衡。因此推測,NPY的異常表達增加可能是機體內源性的保護作用。目前,已有相關報道通過外源性注射NPY以及利用腺病毒攜帶人工高表達NPY基因的質粒都能夠達到抗癲癇的功效[10,11],進一步驗證了NPY對于癲癇治療的重要價值。
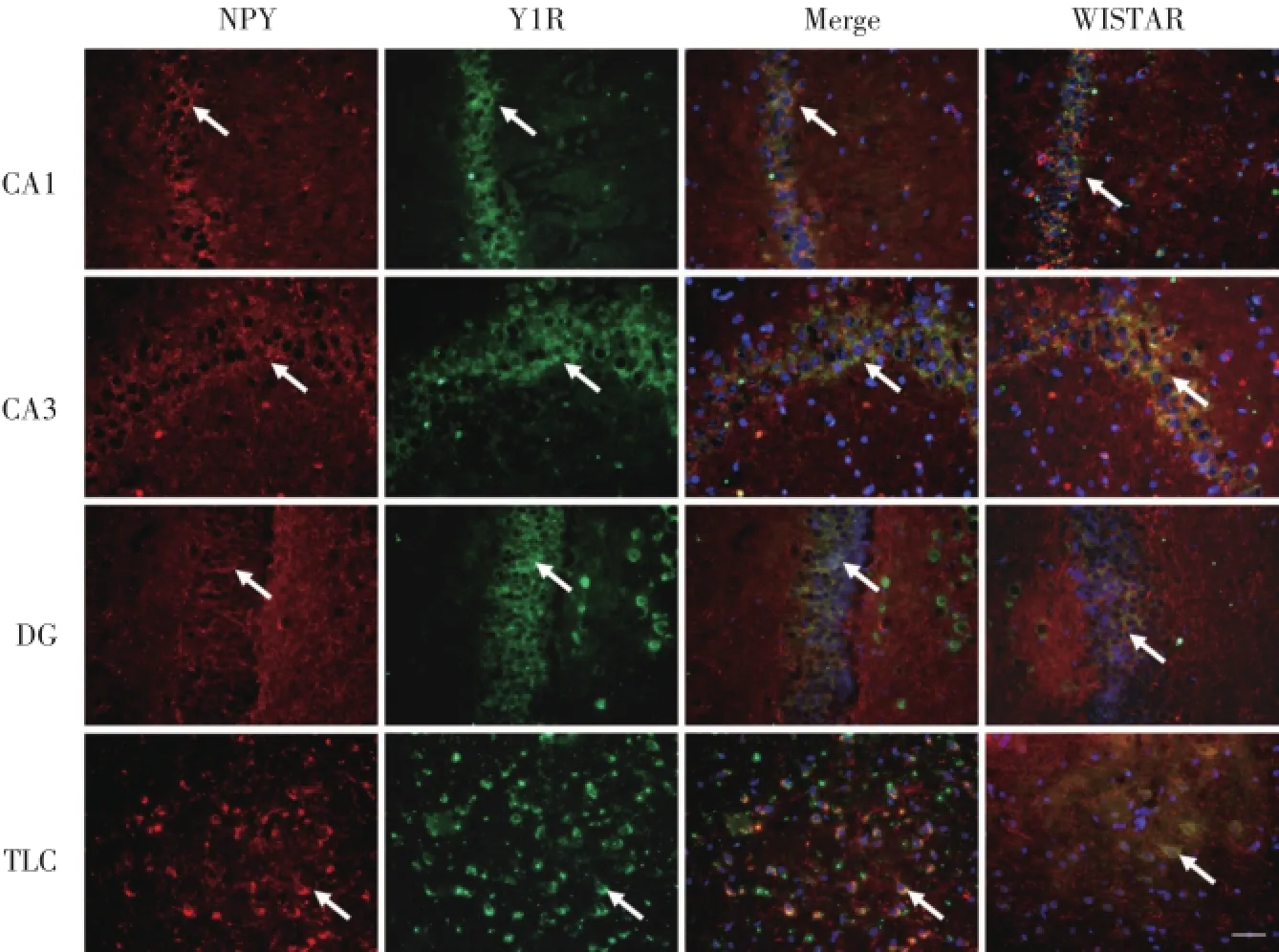
圖3 免疫熒光染色檢測NPY與Y1R在TRM腦內的分布與定位×400Fig.3 The co-localizations of NPY and Y1R in TRM and Wistar brains by double-labeled immunofluorescence staining×400
癲癇誘發的NPY異常表達與NPY受體的表達變化有密切關系。Y1R是大量存在于海馬和顳葉皮質突觸后神經元上的受體[12],對維持機體內部的能量環路平衡發揮重要作用。Husum等[13]認為,在電休克致癇模型中阻礙Y1R的活性可抑制細胞內NPY的釋放。但是由于Y1R在不同致癇模型中表達變化有差異,因此其在癲癇發生中扮演的角色一直存在爭議。例如在癲癇患者發作后,有研究發現其顆粒細胞層中的Y1R表達急劇下降以及Y1R陽性神經元的缺失與損傷。這與我們在TRM海馬中觀察到的結果類似。但是在Noda癲癇大鼠中,Y1R在海馬中的表達卻出現明顯增加[14]。還有體內試驗認為NPY能夠通過Y1R的作用增加谷氨酸的釋放,但并不影響或阻礙其抗癲癇功能[15]。這說明不同的癲癇模型中Y1R的表達變化可能不一致,再一次驗證了癲癇發生機制的復雜性。我們推測,TRM海馬中Y1R表達減少可能有助于NPY神經保護功能的啟動和發揮,而其在顳葉皮質中的表達增加則有可能是機體的一種代償作用。
綜上,本研究首次發現與正常Wistar大鼠相比,NPY在TRM海馬和顳葉皮質部位表達明顯增加;Y1R在TRM海馬表達下調,而在顳葉皮質中表達上調。TRM腦內NPY介導的神經保護功能可能沒有受到損傷并正常啟動。而Y1R的異常表達可能有助于NPY發揮抗癲癇作用。但是這種保護沒有完全抵御TRM癲癇的發生。這可能是由于NPY表達量仍然不足,也有可能是其他關鍵蛋白例如蛋白激酶C的異常表達阻礙了NPY抑制興奮性氨基酸釋放的功能。但是無論哪種推測都需要進一步驗證。
[1]郭鳳,姚陽,孫威,等.無鎂誘導培養大鼠海馬神經元與SH-SY5Y細胞自發性放電的變化[J].中國醫科大學學報,2012,41(7):577-579.
[2]Lundberg JM,Tatemoto K.Pancreatic polypeptide family(APP,BPP,NPY and PYY)in relation to sympathetic vasoconstriction resistant to alpha-adrenoceptor blockade[J].Acta Physiol Scand,1982,116(4):393-402.
[3]Decressac M,Barker RA.Neuropeptide Y and its role in CNS disease and repair[J].Exp Neurol,2012,238(2):265-272.
[4]Cardoso A,Freitas-da-Costa P,Carvalho LS,et al.Seizure-induced changes in neuropeptide Y-containing cortical neurons:potential role for seizure threshold and epileptogenesis[J].Epilepsy Behav,2010,19(4):559-567.
[5]Mao X,Ma P,Cao D,et al.Altered expression of GABAA receptors(a4,c2 subunit),potassium chloride cotransporter2 and astrogliosis in tremor rat hippocampus[J].Brain Res Bull,2011,86(5-6):373-379.
[6]Xu X,Guo F,Lv X,et al.Abnormal changes in voltage-gated sodi-um channels NaV1.1,NaV1.2,NaV1.3,NaV1.6 and in calmodulin/ calmodulin-dependent protein kinaseⅡ,within the brains of spontaneously epileptic rats and tremor rats[J].Brain Res Bull,2013,96:1-9.
[7]Drexel M,Kirchmair E,Wieselthaler-H?lzl A,et al.Somatostatin and neuropeptide Y neurons undergo different plasticity in parahippocampal regions in kainic acid-induced epilepsy[J].J Neuropathol Exp Neurol,2012,71(4):312-329.
[8]Silva AP,Xapelli S,Pinheiro PS,et al.Up-regulation of neuropeptide Y levels and modulation of glutamate release through neuropeptide Y receptors in the hippocampus of kainate-induced epileptic rats[J].J Neurochem,2005,93(1):163-170.
[9]Mao X,Cao Y,Min D,et al.RP-LC with f l uorescence detection of amino acids in rat brain synaptosomes[J].Chromatographia,2011,73(1-2):157-163.
[10]Corvino V,Marchese E,Giannetti S,et al.The neuroprotective and neurogenic effects of neuropeptide Y administration in an animal model of hippocampal neurodegeneration and temporal lobe epilepsy induced by trimethyltin[J].J Neurochem,2012,122(2):415-426.
[11]G?tzsche CR,Nikitidou L,S?rensen AT,et al.Combined gene overexpression of neuropeptide Y and its receptor Y5 in the hippocampus suppresses seizures[J].Neurobiol Dis,2012,45(1):288-296.
[12]徐曉雪,徐承偉,張朝東.神經肽Y及其受體與癲癇[J].卒中與神經疾病,2013,20(4):248-250.
[13]Husum H,Gruber SH,Bolwig TG,et al.Extracellular levels of NPY in the dorsal hippocampus of freely moving rats are markedly elevated following a single electroconvulsive stimulation,irrespective of anticonvulsive Y1 receptor blockade[J].Neuropeptides,2002,36(5):363-369.
[14]Jinde S,Masui A,Morinobu S,et al.Differential changes in messenger RNA expressions and binding sites of neuropeptide Y Y1,Y2 and Y5 receptors in the hippocampus of an epileptic mutant rat:Noda epileptic rat[J].Neuroscience,2002,115(4):1035-1045.
[15]Meurs A,Portelli J,Clinckers R,et al.Neuropeptide Y increases in vivo hippocampal extracellular glutamate levels through Y1 receptor activation[J].Neurosci Lett,2012,510(2):143-147.
(編輯 陳姜)
Expressionsand Co-localizationsofNeuropeptide Y and Y1 Receptor in Brain ofTremor Rats
XUXiao-xue1,2,GUOFeng3,WANGQian-hui3,ZHANGChao-dong1,2,YANGJun1,2,ZHAOJiu-han1,2,CAIJi-qun3
(1.Department of Neurology,The First Hospital,China Medical University,Shenyang 110001,China;2.Institute of Neurology,China Medical University,Shenyang 110001,China;3.DepartmentofPharmaceuticalToxicology,SchoolofPharmacy,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo explore the expression and distribution of neuropeptide Y(NPY)and Y1 receptor(Y1R)in brain of Tremor rats(TRM).MethodsThe mRNA expression ofNPYandY1Rwas detected by RT-PCR.The concentration of NPY was detected by ELISA kit.The protein expression of Y1R was determined by Western blot in TRM hippocampus and temporal lobe cortex.The distribution and co-localization of these two proteins were analyzed using double-labeling immunofluorescence staining in temporal lobe cortex and hippocampal CA1,CA3,and DG.ResultsCompared with Wistar rats,increased NPY and decreased Y1R were observed in the hippocampus of TRM.However,both NPY and Y1R were up-regulated in TRM temporal lobe cortex.NPY and Y1R were present and co-localized throughout TRM brains,especially localized on the membranes of pyramidal cells and granule cells.ConclusionThe altered expressions of NPY and Y1R were observed in TRM hippocampus and temporallobe cortex,which may be involved in the generation ofTRMepileptiform activity.
epilepsy;neuropeptide Y;Y1 receptor;subtype;hippocampus;temporal lobe cortex
R742.1
A
0258-4646(2014)09-0794-05
國家自然青年科學基金(81001429)
徐曉雪(1983-),女,助理研究員,博士. E-mail:xiaoxue80cn@sina.com
2014-06-23
網絡出版時間:

