穿心蓮內酯對胃癌AGS細胞增殖侵襲的影響
歐陽德亮 ,胡 楊 ,王又保 ,黃明明 ,謝榮兵
(1.南華大學附屬第三醫院普外科,湖南衡陽421900;2.南華大學附屬南華醫院消化內科)
胃癌是我國最常見的消化系統惡性腫瘤之一。跟其他腫瘤類似,也是一個多因素、多步驟、多階段的復雜過程,涉及到宿主體內的基因型以及表型的變化。雖然早期手術治療可挽救部分患者的生命,但對于晚期患者而言,化療依然是主要治療手段。盡管目前用于胃癌化療的藥物眾多,但因副作用等因素限制了其使用。穿心蓮內酯(Andrographolide,AD)是一類具有消炎解毒功能的二萜類化合物,以往多用于臨床上各種感染性疾病的治療[1-2]。但近年有研究顯示,這種化合物對人類多種腫瘤細胞生長具有一定的抑制效應[3]。近年研究顯示,在腫瘤的發生發展過程中,Na+-K+-ATP酶可能參與腫瘤細胞的增殖[4]。此外,血管內皮生長因子(vascular endothelial growth factor,VEGF)和轉化生長因子β1(transforming growth factor-β1,TGF-β1)以及基質金屬蛋白酶(matrix metalloproteinase-9,MMP-9)等也廣泛參與癌細胞的黏附、侵襲及遷移。本研究旨在觀察穿心蓮內酯對胃癌細胞生長增殖的影響,并初步探討其可能的機制。
1 材料與方法
1.1 試劑
穿心蓮內酯(純度98%)購自Sigma-Aldrich化學制品公司,用 DMSO溶解使其成為濃度為15 mmol/L的貯存液。細胞培養基為Invitrogen產品,培養板購自Corning公司。其他試劑均購于上海生工。Trizol試劑購自Invitrogen公司。RT-PCR試劑盒購自大連寶生物公司。The SensoLyte MMP-9活性檢測試劑盒購自AnaSpec公司。
1.2 細胞培養
人胃癌細胞系AGS用含10%胎牛血清的RPMI 1640培養基中在37℃含有5%CO2的環境下培養,其中包含了100單位/mL的青霉素和100單位/mL的鏈霉素(pH 7.4)。每3天更換培養基或進行細胞傳代培養。用于各種實驗和分析的細胞密度約為105/mL。
1.3 Na+-K+-ATP酶活性分析
根據酶促反應釋放的無機磷(Pi)的含量反應ATP酶的活性。反應體系中含有20 mmol/L KCl、100 mmol/L NaCl、30 mmol/L Tris 緩沖液(pH 7.4)以及新鮮細胞線粒體分離物。當反應體系加入2 mmol/L ATP后,30℃孵育15 min,接著加入15%三氯乙酸終止反應。通過測量640 nm處的吸光度分析釋放的無機磷的含量。ATP酶活性的定義:1 mg蛋白質1 h內催化ATP生成1 μmol/L無機磷的量為1個單位ATP酶活性,并計算其相對活性,公式為:相對活性=處理組酶活性/對照組酶活性×100%。
1.4 細胞增殖分析
為了檢測細胞的生存能力,進行MTT分析。利用0.25 mg MTT/mL在37℃下孵育實驗細胞。利用全自動定量繪圖酶標儀通過測量570 nm(630作為參考)下的吸光度。細胞抑制率=(空白組OD值-處理組OD值)/空白組OD值×100%。
1.5 DNA斷裂的測量
采用ELISA測量DNA斷裂情況。細胞經不同濃度的穿心蓮內酯孵育之后,室溫下裂解癌細胞30 min,接著200 g下離心10 min。然后將20 μL上清液轉移至抗生蛋白鏈菌素包被的培養板中,并且每孔加入80 μL新配制的免疫試劑,在室溫下孵育2 h。利用PBS沖洗之后,加入底物溶液,并孵育15 min。利用全自動定量繪圖酶標儀測量405 nm處的吸光度(參考490 nm的波長)。計算斷裂DNA的相對含量=樣本吸光度/對照組吸光度×100%(樣本:穿心蓮內酯處理的細胞;對照組:未用穿心蓮內酯處理的細胞)。
1.6 VEGF和TGF-β1水平的測定
利用不同濃度的穿心蓮內酯預處理細胞48 h。利用PBS沖洗之后,接著用10 ng/mL的TNF-α孵育樣本18 h。利用ELISA工具測定VEGF和TGF-β1在細胞培養上清液中的水平。
1.7 MMP-9活性測定
細胞處理結束后,獲取上清,采用間接法測定MMP-9的酶活性。其步驟根據 AnaSpec公司的SensoLyte?490 MMP-9 Assay Kit提供的步驟進行。本試劑盒含有EDANS/DabcylPlusTM熒光共振能量轉移肽,在這條完整的肽當中,DabcylPlus將EDANS熒光淬火,而此肽被MMP-9特異性降解后,EDANS重新獲得熒光,在熒光酶標儀上測定其強度(與MMP-9的活性成正比,激發/發射波長分別為340 nm和490 nm),并計算各組與對照組的比值(相對活性)。
1.8 侵襲力分析
制備AGS細胞懸液(3×106/mL),同時將Matrigel鋪在 Transwell濾膜上(40 μL/孔),紫外照射12 h。Transwell的上室加入細胞懸液100 μL,下室加入500 μL完全培養基。5%CO2條件下培養24 h。取出小室,甲醇4℃固定10 min,并加入結晶紫染色5 min,PBS洗滌后擦去上表面細胞,并隨機選擇5個視野,計算穿膜細胞數目。
1.9 統計學分析
數據用均數±標準差表示,用SPSS 17.0統計軟件處理數據并進行方差分析(ANOVA),組間比較采用LSD分析。P<0.05為差異有顯著性。
2 結 果
2.1 不同濃度穿心蓮內酯對Na+-K+-ATP酶活性的影響
不同濃度的穿心蓮內酯作用AGS細胞24 h后,能在一定程度上抑制細胞內Na+-K+-ATP酶活性。其中1.0 μmol/L穿心蓮內酯能使酶活性降低至86%,3.0 μmol/L 時其活性為 59%,而 5.0 μmol/L穿心蓮內酯能使Na+-K+-ATP酶活性降低至48%,見圖1所示。
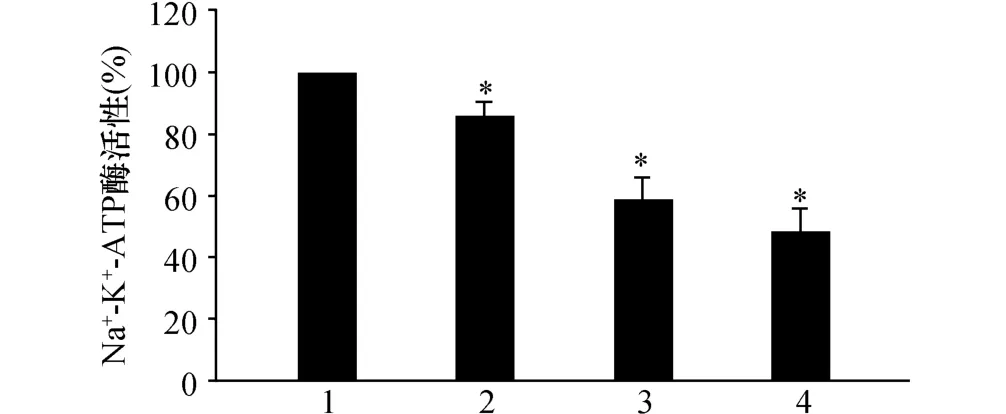
圖1 不同濃度穿心蓮內酯對Na+-K+-ATP酶活性的影響1:對照組;2:1.0 μmol/L穿心蓮內酯;3:3.0 μmol/L穿心蓮內酯;4:5.0 μmol/L穿心蓮內酯.與對照組(0 μmol/L)比較,*:P<0.05
2.2 穿心蓮內酯對AGS細胞生長增殖的影響
MTT結果顯示,在同一時間點,不同濃度的穿心蓮內酯能有效抑制AGS細胞生長增殖,且隨著濃度的增高抑制作用增強。在相同濃度作用下,隨作用時間的延長,對AGS細胞的抑制作用越明顯(表1)。
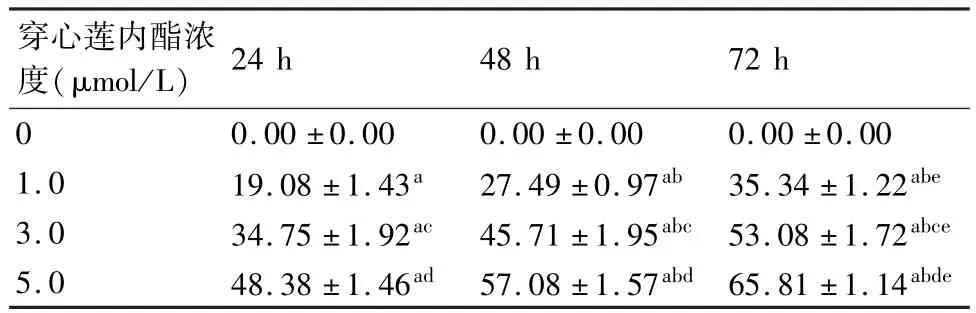
表1 穿心蓮內酯在不同濃度及不同時間作用下對AGS細胞抑制率的影響(%)
2.3 穿心蓮內酯對斷裂DNA含量的影響
如圖2所示,1.0 μmol/L穿心蓮內酯孵育48 h后能輕微增加斷裂DNA的含量。隨著濃度的增高,其斷裂DNA含量隨之增多。
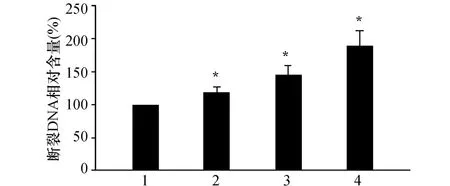
圖2 不同濃度穿心蓮內酯對斷裂DNA含量的影響 1:對照組;2:1.0 μmol/L穿心蓮內酯;3:3.0 μmol/L穿心蓮內酯;4:5.0 μmol/L穿心蓮內酯.與對照組(0 μmol/L)比較,*:P <0.05
2.4 穿心蓮內酯對AGS細胞中VEGF及TGF-β1含量的影響
ELISA結果顯示,隨著穿心蓮內酯濃度的增高,VEGF和TGF-β1的水平逐漸降低(P<0.05,表2)。
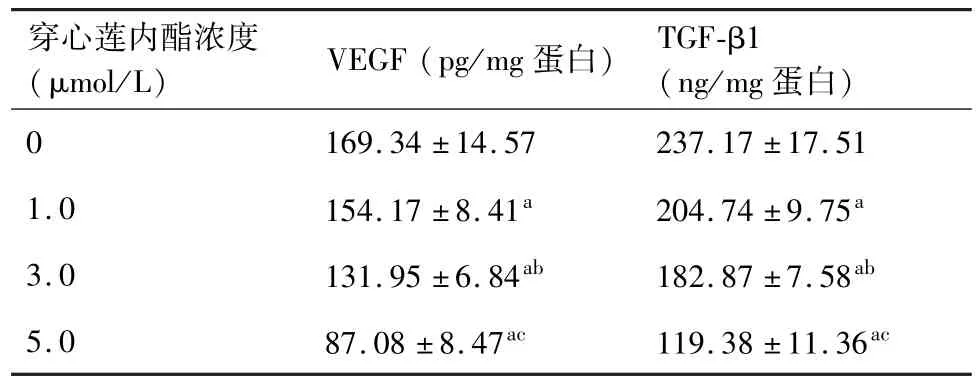
表2 不同濃度穿心蓮內酯對AGS細胞中VEGF及TGF-β1水平的影響
2.5 穿心蓮內酯對AGS細胞MMP-9酶活性的影響
MMP-9間接酶活性結果顯示,1.0、3.0、5.0 μmol/L穿心蓮內酯處理后,與對照組相比,MMP-9活性明顯降低。其中5.0 μmol/L穿心蓮內酯能將MMP-9的酶活性降低47.5%,見圖3。
2.6 穿心蓮內酯對AGS細胞侵襲的影響
不同濃度穿心蓮內酯作用AGS細胞6 h后,對細胞侵襲力的影響見圖4和表3所示,1.0~5.0 μmol/L穿心蓮內酯均能不同程度降低AGS細胞的侵襲力(P<0.05)。
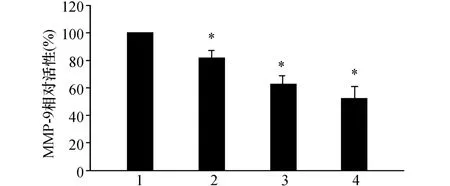
圖3 不同濃度穿心蓮內酯對MMP-9活性的影響 1:對照組;2:1.0 μmol/L 穿心蓮內酯;3:3.0 μmol/L 穿心蓮內酯;4:5.0 μmol/L穿心蓮內酯.與對照組(0 μmol/L)比較,*:P <0.05
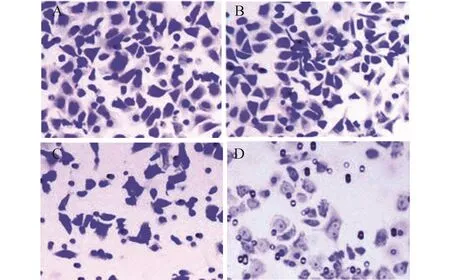
圖4 穿心蓮內酯對AGS細胞侵襲力的影響(×20)A:0 μmol/L 穿心蓮內酯;B:1.0 μmol/L 穿心蓮內酯;C:3.0 μmol/L穿心蓮內酯;D:5.0 μmol/L穿心蓮內酯
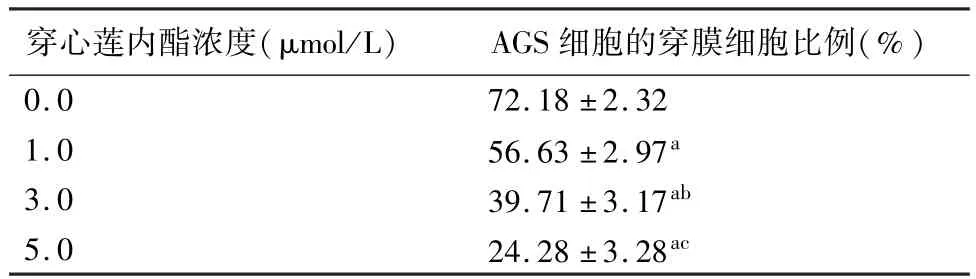
表3 穿心蓮內酯對AGS細胞侵襲力的影響
3 討 論
誘導細胞凋亡是癌癥治療的目標,而DNA斷裂是細胞凋亡的重要指標。本研究發現1.0~5.0 μmol/L的穿心蓮內酯處理后可顯著增加胃癌細胞斷裂DNA的含量,可能是由于穿心蓮內酯滲入胃癌細胞后破壞了質膜的完整性,最終引起細胞凋亡。Na+-K+-ATP酶為三羧酸循環的關鍵酶,是由一個α-亞單位和一個β-亞單位組成的異二聚體。而α-亞單位是一種跨膜蛋白,可用于細胞內Na+和細胞外K+的交換。因此,Na+-K+-ATP酶對于維持離子動態平衡很關鍵[5]。若外源性誘導該酶功能異常,則可觸發線粒體膜的瓦解而促進細胞凋亡的發生。有研究發現抑制Na+-K+-ATP酶的活性,能有效抑制腫瘤細胞的增殖、侵襲及轉移,其機制可能通過改變α-亞單位的穩定性而影響線粒體功能,最終導致凋亡的發生[6]。VEGF和TGF-β1是腫瘤發生發展過程中的血管生成因子。TGF-β1是包括胃癌在內的一種重要腫瘤生長調節物質[7-8]。研究表明,TGF-β1通過它的免疫抑制效應從而增強胃癌細胞的轉移[9]。本研究顯示經穿心蓮內酯處理后,VEGF和TGF-β1在胃癌細胞中含量明顯降低,這表明穿心蓮內酯可能在一定程度上減弱胃癌細胞中血管生成和纖維發生。癌細胞的侵襲和遷移是癌癥復發及遷移的關鍵進程。此轉移過程與MMP-9的活性密切相關。MMP-9是一種內肽酶,可降解細胞外基質成分,使得癌細胞進入脈管和淋巴系統[10],因此其在腫瘤中的作用已經日益受到重視[11]。本研究證實,穿心蓮內酯能顯著抑制MMP-9的活性,最終減弱胃癌細胞的侵襲和遷移。
總之,濃度為1.0~5.0 μmol/L的穿心蓮內酯能抑制Na+-K+-ATP酶的活性,從而可能誘導細胞凋亡的發生。此外,這種二萜化合物也能抑制VEGF和TGF-β1的產生并抑制MMP-9的活性,從而可能抑制血管的發生以及減少胃癌細胞的侵襲。盡管這些結果說明穿心蓮內酯可引起細胞凋亡或延緩胃癌的遷移,但是該藥物對于緩和胃癌進展的效應、作用方式以及適當的劑量,還需要進行進一步的體內研究。
[1]Zhu YY,Yu G,Zhang Y,et al.A novel andrographolide derivative AL-1 exerts its cytotoxicity on K562 cells through a ROS-dependent mechanism[J].Proteomics,2013,13(1):169-178.
[2]Hai-Mei L,Song-Yin H,Run-Mei L,et al.Andrographolide protects against lipopolysaccharide-induced vascular hyporeactivity by suppressing the expression of inducible nitric oxide in periaortic adipose[J].J Cardiovasc Pharmacol,2013,62(2):154-159.
[3]Zhang ZR,Al ZM,Wong MM,et al.Taxifolin enhances andrographolide-induced mitotic arrest and apoptosis in human prostate cancer cells via spindle assembly checkpoint activation[J].PLoS One,2013,8(1):e54577.
[4]王柏琦,程愛蘭.穿心蓮內酯對人鼻咽癌細胞增殖以及Na~+-K~+-ATP酶活性的影響[J].當代醫學,2012,18(26):27-28.
[5]Wang HY,O'Doherty GA.Modulators of Na/K-ATPase:a patent review[J].Expert Opin Ther Pat,2012,22(6):587-605.
[6]Rajasekaran SA,Huynh TP,Wolle DG,et al.Na,K-ATPase subunits as markers for epithelial-mesenchymal transition in cancer and fibrosis[J].Mol Cancer Ther,2010,9(6):1515-1524.
[7]Peng J,Tsang JY,Li D,et al.Inhibition of TGF-beta signaling in combination with TLR7 ligation re-programs a tumoricidal phenotype in tumor-associated macrophages[J].Cancer Lett,2013,331(2):239-249.
[8]Mimeault M,Batra SK.Hypoxia-inducing factors as master regulators of stemness properties and altered metabolism of cancer-and metastasis-initiating cells[J].J Cell Mol Med,2013,17(1):30-54.
[9]Gulubova M,Ananiev J,Yovchev Y,et al.The density of macrophages in colorectal cancer is inversely correlated to TGF-beta1 expression and patients'survival[J].J Mol Histol,2013,44(6):679-692.
[10]賀軍,丁成明,賀更生,等.ESM-1和MMP-3表達與肝癌侵襲轉移的關系[J].中南醫學科學雜志,2012,40(4):368-372.
[11]Zhao M,Gao Y,Wang L,et al.Overexpression of Integrin-linked kinase promotes lung cancer cell migration and invasion via NF-kappaB-mediated upregulation of matrix metalloproteinase-9[J].Int J Med Sci,2013,10(8):995-1002.

