板藍根及所含靛藍和靛玉紅強烈抑制小鼠腎主要有機陰離子轉運體Oat1,Oat2和Oat3
奇錦峰,孫 晨,王永輝,余文浩,韓 堅,林 梅,張 娜
(1.廣州中醫藥大學中藥學院藥理學教研室,廣東廣州 510006;2.河南省駐馬店市人民醫院藥劑科,河南駐馬店 463000;3.廣州市佛山南海中醫院西藥房,廣東廣州 528200)
板藍根及所含靛藍和靛玉紅強烈抑制小鼠腎主要有機陰離子轉運體Oat1,Oat2和Oat3
奇錦峰1,孫 晨1,王永輝2,余文浩1,韓 堅1,林 梅3,張 娜1
(1.廣州中醫藥大學中藥學院藥理學教研室,廣東廣州 510006;2.河南省駐馬店市人民醫院藥劑科,河南駐馬店 463000;3.廣州市佛山南海中醫院西藥房,廣東廣州 528200)
目的 探討板藍根顆粒劑(GRI)和飲片水煎劑(DRI)及其所含主要成分靛藍和靛玉紅對小鼠腎有機陰離子轉運體(OAT)中3個主要亞型Oat1,Oat2和Oat3的影響。方法 NIH小鼠分別ig給予GRI 0.615和2.460 g·kg-1,DRI 1.6和6.4 g·kg-1(生藥量),靛藍0.008和0.640 mg·kg-1,靛玉紅0.0192和1.5360 mg·kg-1,每組60只(雌雄對半),每天2次,連續5 d。同時設丙磺舒(0.05 g·kg-1)陽性對照組和兩種溶媒〔純水和0.5%羧甲纖維素鈉(CMC-Na)水溶液〕對照組及糊精加蔗糖(各1.5 g·kg-1)添加劑組。最后1次給予供試物后實施對-氨基馬尿酸(PAH,iv,0.03 g·kg-1)清除實驗,即在iv PAH后1.0,2.5,5.0, 7.5,10.0和20.0 min時每組分別各取10只小鼠(雌雄對半),安樂處死收集全血制備血清,并迅速摘取雙腎,右腎進行組織勻漿后測定PAH蓄積量,左腎組織用于提取總mRNA。每組另取10只小鼠(雌雄各半),同樣給藥處理,按Nakakariya法做腎切片進行攝取PAH實驗。用Kiguchi法測定血清和腎組織勻漿液中PAH濃度。以藥動學軟件(DAS 2.0)計算血清及腎組織中PAH的主要藥動學參數。以實時定量PCR法測定小鼠腎組織Oat1,Oat2及Oat3 mRNA表達。結果 與純水對照組比較,0.5%CMC-Na對照組各項檢測指標均無顯著差異。與兩種溶媒對照組相比,GRI 2.460 g·kg-1,靛藍 0.640 mg·kg-1和靛玉紅1.5360 mg·kg-1組消除半衰期(t1/2β)顯著延長(P<0.05);各供試物組分布容積(Vd)和清除率(Cl)均顯著減少(P<0.01),曲線下面積(AUC0→20min)均顯著增加(P<0.01);由采血時間段內各組腎組織中的PAH蓄積量所求得的AUC0→20min顯著大于同期對照組(P<0.05,P<0.01),且腎AUC0→20min與血液AUC0→20min的比值在各組間無顯著差異。各劑量供試物均可使腎切片攝取PAH的量顯著少于對照組(P<0.05,P<0.01)。與純水/CMC對照組相比,GRI 2.460 g·kg-1,DRI 6.4 g·kg-1,靛藍0.640 mg·kg-1,靛玉紅1.5360 mg·kg-1組小鼠腎組織Oat1,Oat2及Oat3 mRNA表達除靛玉紅組Oat2 mRNA(P<0.05)、GRI組Oat3 mRNA(P<0.01)表達水平被顯著上調外,其余均被顯著下調(P<0.05,P<0.01)。結論 GRI、DRI、靛藍、靛玉紅在所用劑量下對小鼠腎組織Oat1,Oat2及Oat3均有明顯抑制作用,GRI和DRI的這種抑制作用可能主要來自其所含的靛藍和靛玉紅成分。
板藍根;靛藍;靛玉紅;對-氨基馬尿酸;有機陰離子轉運體
板藍根(Radix Isatidis)別名靛青根、藍靛根或靛根,分為北板藍根和南板藍根,是中醫清熱解毒的常用中藥[1]。北板藍根來源于十字花科植物菘藍(Isatis tinctoria L.)和草大青(I.indigotica Fort.)的根;南板藍根為爵床科植物馬藍〔Baphicacanthus cusia(Nees)Brem.〕的根莖和根[1]。板藍根主要活性成分被認為是靛藍(indigo)和靛玉紅(indirubin),分別含0.0001~0.0957%和0.0012~0.1118%[2-4],此外,還含有其他幾十種成分[5-6]。近年來有不少大眾媒體報道,板藍根曾引發腎毒性等諸多不良反應[6-9],然而至今未見有正規的實驗研究或臨床調查報告證明板藍根本身或其所含主要化學成分如靛藍和靛玉紅確實能引發腎毒性。
有機陰離子轉運體(organic anion transporters,OAT)是溶質轉運體(solute carrier,SLC)超家族中 SLC22A基因家族的成員[10],其主要成員OAT1,OAT2和OAT3多在腎近曲小管上皮細胞基底膜側表達,介導眾多內、外源性有機陰離子型化合物(包括環境毒素、藥物及其代謝產物)從細胞外液或血液進入腎小管腔上皮細胞[10-11],再由其他外排性轉運體將它們分泌送入腎小管腔[11],以便經尿液排出體外,即OAT在哺乳動物排泄體內廢棄物及毒物方面具有不可替代的作用[12-13]。
研究發現,OAT一旦被進入體內的化學物質(包括藥物、毒物及飲食當中的某些成分)所抑制,將擾亂機體的正常生理活動乃至出現傷害作用[11],如β-內酰胺類中的頭孢曲松、抗病毒藥中的阿昔洛韋、抗腫瘤藥中的甲氨蝶呤和鉑類等的腎毒性均與OAT1和OAT3介導的有機陰離子的攝取功能受阻有關[14-16],而馬兜鈴酸所導致的腎毒性機制也約在4年前被證實是抑制OAT1和OAT3的結果[14-15]。
鑒于眾多研究表明,化學物質所引發的人類腎損害多與OAT被抑制有關[14-16],與人類 OAT1,OAT2和 OAT3相對應的同源小鼠Oat分別是Oat1,Oat2和Oat3[17],故本研究檢測了市售板藍根顆粒(granules of Radix Isatidis,GRI)和自制板藍根飲片水煎劑(decoction of Radix Isatidis,DRI)以及板藍根中含量較多的成分靛藍和靛玉紅對小鼠腎組織3個主要Oat亞型Oat1,Oat2和Oat3的轉運功能及其基因表達的影響。
1 材料與方法
1.1 藥物、試劑和儀器
GRI,廣州市香雪制藥股份有限公司,國藥準字Z44020344,批號201301203;DRI,廣州市采芝林藥業有限公司,經廣州中醫藥大學中藥學院黃海波教授鑒定為北板藍根;靛藍(純度98%)、靛玉紅(純度>95%)和對-氨基馬尿酸(para-aminohippuric acid,PAH)(純度98%),均為阿拉丁公司;丙磺舒(probenecid)(純度 98%),美國 Sigma公司;Tusda試劑(純度>98%),日本東京化成工業株式會社;靛藍、靛玉紅和丙磺舒等均用0.5%羧甲纖維素鈉(CMC-Na)溶液充分研磨成細膩的混懸液。蛋白質定量試劑盒,北京鼎國昌盛生物技術公司;總RNA提取試劑、PrimeScriptTMRT 試劑盒和SYBR?Premix Ex TaqTMⅡ,日本TaKaRa公司;特異性引物序列[18](表1)由上海生工生物工程有限公司合成;其他常用試劑均為市售分析純級。Himac CR22G高速冷凍離心機,日本日立制作所;AsOne數控組織勻漿機,日本 As One公司;WFG7200型紫外可見分光光度計,尤尼柯上海儀器有限責任公司;SmartSpec plus核酸蛋白檢測儀,美國Bio-Rad公司;ABI7500型實時熒光定量PCR儀,美國Applied Biosystems公司。
1.2 板藍根水提物的制備及板藍根類供試物所含靛藍和靛玉紅的定量
參照《中國藥典》2010版中“板藍根顆粒”的制法[1],取96 g板藍根飲片煎煮2次(每次加純水1 L),第1次2 h,第2次1 h,濾液合并后濃縮至0.3 L(其生藥含量為320 g·L-1),-20℃冰箱保存備用。DRI和GRI中靛藍和靛玉紅的定量參照文獻[19]進行。
1.3 動物、動物分組和給藥
12組SPF級NIH小鼠(雌雄對半),體質量22~30 g(廣州中醫藥大學實驗動物中心),動物合格證號SCXK(粵)2013-0020。飼養條件為室溫20~26℃,濕度50%~70%,明暗交替12 h/12 h,隨意攝食飲水。動物福利和實驗均符合相關實驗動物管理條例和實驗動物倫理要求。將受試小鼠隨機分為12個組,每組60只,純水對照組,0.5%CMC-Na對照組,糊精加蔗糖添加劑對照組(各1.5 g·kg-1),丙磺舒陽性對照組(0.05 g·kg-1),GRI 0.615和2.460 g·kg-1,DRI 1.6和6.4 g·kg-1(生藥量),靛藍 0.008和0.640 mg·kg-1,靛玉紅 0.0192和1.5360 mg·kg-1。各 劑 量 供 試 物 ig 給 予(20 mL·kg-1),每天2次,連續5 d。
1.4 PAH清除實驗[20]
最后1次給予供試物60 min后,所有受試小鼠均尾靜脈注射PAH 0.03 g·kg-1,然后在1.0,2.5,5.0,7.5,10.0及20.0 min時從各組分別取10只小鼠(雌雄各半),安樂處死取全血,室溫放置60 min后3000×g離心5 min,取血清-20℃保存;迅速摘取雙腎并即刻置-80℃保存待用。取出在-80℃冰箱中的小鼠右腎,剪成2 mm小塊放入電動勻漿器中,加入5倍量的磷酸緩沖液(pH 7.4)進行勻漿[21](20 s×5次,每杵間隔10 s),20 000×g離心30 min后棄沉淀,取上清液用Folin酚法測定蛋白質濃度。血清中及腎勻漿上清液中的PAH含量參考文獻[22]測定。
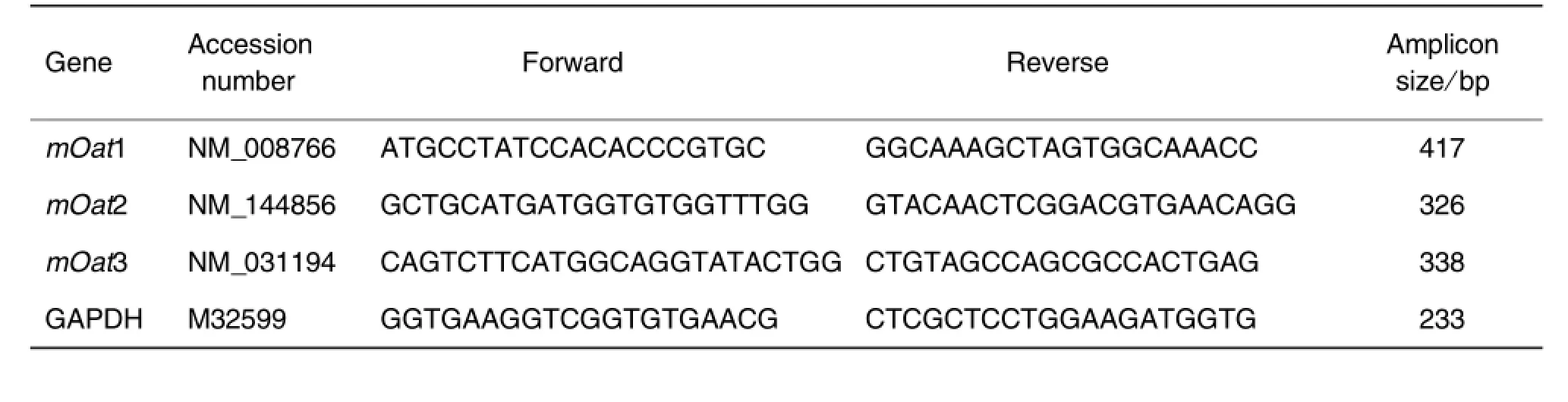
Tab.1 Primer sequences of mouse organic anion transporters(mOat)for reaI-time RT-PCR
1.5 腎切片攝取PAH實驗[21,23]
另取 SPF級 NIH小鼠(雌雄對半),每組10只,除未設糊精加蔗糖對照組外,分組和給藥同1.3。最后1次給藥后60 min處死小鼠,迅速摘取左腎,將其置于消過毒的瓷板上。用無菌手術刀片從腎門沿長軸將腎平均切成2份。每份沿長軸均等切成3條(約2 mm厚),再將其均等切成3塊。冰冷PBS涮洗后用濾紙吸干,放入12孔培養板(內有充足了氧氣的PBS 1 mL,含PAH 2 mmol·L-1,每孔放1個腎的切塊),置CO2培養箱,37℃,5% CO2中溫育20 min,每隔5 min震搖5 s。取出培養板后迅速加入250 μL 10%三氯醋酸溶液并震搖混勻以終止反應。上述孵育的腎組織塊的勻漿操作及其所含PAH濃度的測定同1.4。PAH的攝取量以g·L-1·g-1蛋白表示(即每升勻漿液中單位蛋白質所對應的PAH),并求出各組實際攝取量所占對照組的百分率。
1.6 用實時熒光PCR測定腎組織Oat mRNA水平
-80℃冰箱中取左腎提取總RNA,步驟嚴格按照RNA提取試劑盒說明書進行。用紫外分光光度法測定A260nm和A280nm,A260nm/A280nm比值在1.8~2.2之間的樣本用于進行實時熒光PCR。逆轉錄反應用PrimeScriptTMRT試劑盒進行。用ABI 7500實時定量PCR儀進行逆轉錄反應,反應條件為37℃15 min,85℃31 s,1個循環。PCR反應使用SYBR?Premix Ex TaqTMⅡ試劑盒,體系為20 μL,其中含10 μL SYBR?Premix Ex TaqTMⅡ,上、下游引物各0.8 μL,0.4 μL ROX Reference DyeⅡ,2 μL前述逆轉錄產物,用DEPC處理水補足至20 μL。每個待檢基因重復做3個反應孔。PCR反應條件為:95℃預變性30 s,然后進入循環階段,每個循環包括95℃變性15 s,56℃退火30 s,72℃延伸31 s,共40個循環。以GAPDH作為內參照,用2-△△Ct方法計算目的基因的相對表達水平。
1.7 統計學分析
血清中PAH的主要藥動學參數(t1/2β,Vd,Cl和AUC0-20min)及腎組織中PAH蓄積量的藥-時曲線下面積(AUC0-20min)由藥動學軟件(DAS2.0)算出[24]并由Bailer法[25-26]計算AUC及腎與血清AUC比值。所有定量數據均用表示。以SPSS17.0統計軟件對所求得藥動學參數進行單因素方差分析及最小顯著性檢驗(LSD)。以P<0.05為差異具有統計學意義。
2 結果
2.1 GRI和DRI中靛藍和靛玉紅的含量
靛藍和靛玉紅含量測定結果表明,本研究所用GRI中,每克藥材含靛藍3.03 μg,靛玉紅3.92 μg;DRI中每克藥材含靛藍29.45 μg,靛玉紅3.12 μg。
2.2 PAH清除實驗中藥動學參數的改變
由PAH標準溶液(濃度范圍0.0586~30.0000 mg·L-1,10個梯度)得標準曲線(Y=0.3937X-0.0025,R=0.9986),以此標準曲線換算出血清和2種腎組織勻漿液中PAH濃度(此法日內變動0.41%~9.52%,日間變動 4.65%~10.85%,重現性 90.81%~109.14%)。
小鼠體內PAH的藥-時曲線符合二室模型,可用等式Cs=Ae-at+Be-βt來描述雙指數濃度-時間曲線,其中Cs是在給PAH后時間t(min)時的血清PAH濃度(mg·L-1)。用藥動學軟件(DAS2.0)計算主要藥動學參數消除半衰期(tβ1/2)、分布容積(Vd)、清除率(Cl)和AUC0→20min(表2)。純水組、CMC-Na組與糊精加蔗糖組3個對照組之間所測藥動學參數均無差異;與純水對照組(或CMC-Na組)相比,GRI 2.460 g·kg-1、靛藍0.640 mg·kg-1和靛玉紅 1.5360 mg·kg-1組 t1/2β顯著延長(P<0.05),4種供試物各劑量組Vd和Cl均顯著減少 (P<0.01)而 AUC0→20min則 均 顯 著 增 加(P<0.01)。
2.3 小鼠腎組織中PAH蓄積量的改變
靜注PAH后由各采血點對應的腎組織內的PAH蓄積量所得AUC0-20min如表3所示。在純水、CMC-Na與糊精加蔗糖3個對照組之間無顯著性差異;與對照組相比,各劑量的板藍根及其關聯供試物組的AUC0-20min(即PAH蓄積量)如同丙磺舒組(標準抑制劑)一樣均顯著地升高(P<0.05)。腎AUC與血清 AUC比值[25-26]各組均在 0.325~0.431之間,說明血中PAH濃度升高后腎組織中的蓄積量也同比例增加,即各組內的增加量雖不同,但各自在血液和腎組織中增加的比例是相近的,提示該過程無代謝酶及其他轉運體參與。
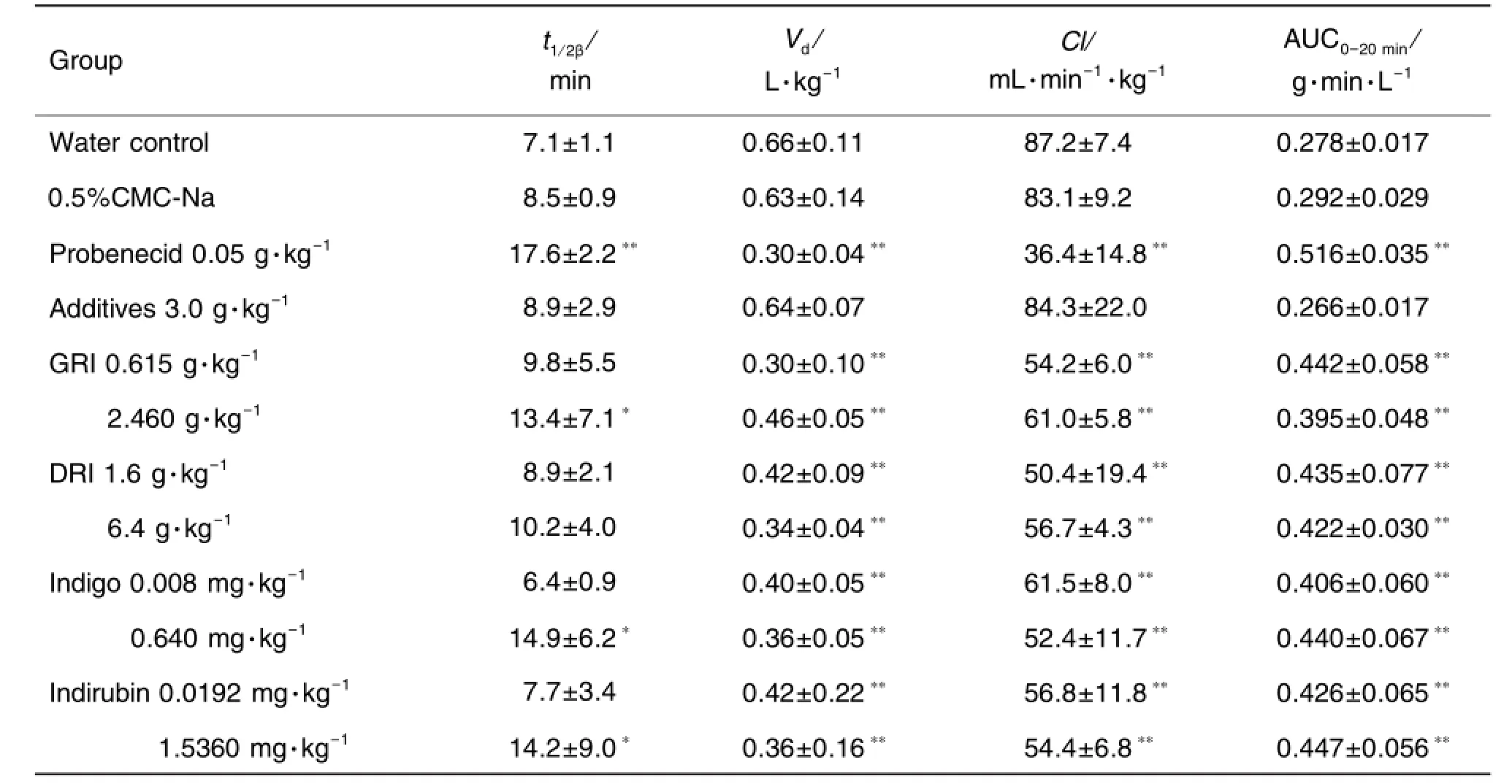
Tab.2 Effect of granuIes of Radix Isatidis(GRI),decoction of Radix Isatidis(DRI),indigo and indirubin on pharmacokinetic(PK)parameters of p-aminohippuric acid(PAH)
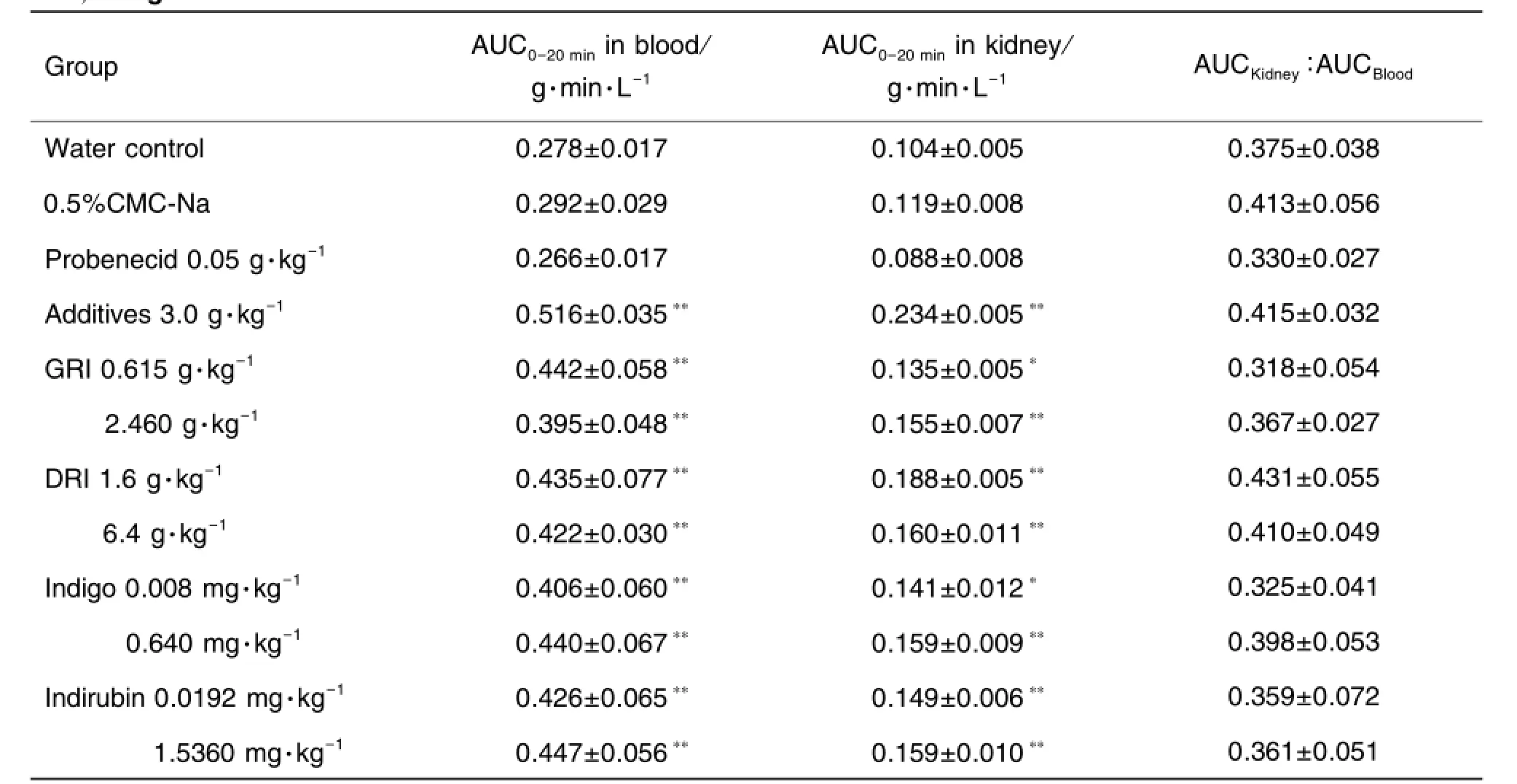
Tab.3 AUC0-20minof PAH in bIood and kidney and kidney-to-bIood AUC ratios of mice after treatment with GRI,DRI,indigo and indirubin
2.4 腎切片攝取PAH量的改變
各組受試小鼠左全腎切片孵育20 min后所攝取的PAH的定量結果如表4所示。所有供試物各劑量組的PAH攝取量均顯著低于純水和CMC-Na對照組(P<0.05,P<0.01)。GRI 2.460 g·kg-1和靛玉紅1.5360 mg·kg-1組所攝取的PAH與丙磺舒組類似,僅為對照組的50.8%和55.6%,說明腎近曲小管上皮細胞基底膜側的Oat被強烈抑制。
2.5 小鼠腎組織Oat1,Oat2及Oat3 mRNA表達水平的改變
各供試物組小鼠腎組織Oat1,Oat2及Oat3 mRNA表達水平如表5所示。與相應對照組比較,4種供試物分別在 2.460 g·kg-1,6.4 g·kg-1,0.640 mg·kg-1和1.5360 mg·kg-1時 Oat1,Oat2及Oat3 mRNA表達水平均顯著改變,除靛玉紅組Oat2 mRNA(P<0.05)和GRI組Oat3 mRNA(P<0.01)表達水平被顯著上調外,其他Oat mRNA表達均被顯著下調(P<0.05,P<0.01)。
3 討論
PAH是 OAT1,OAT2和 OAT3的共同底物[17],丙磺舒為OAT1,OAT2和OAT3的共同抑制劑[27]。本研究以PAH為探針藥、丙磺舒為陽性對照,分析對比了溶媒對照組和GRI、DRI、靛藍和靛玉紅組小鼠在PAH清除實驗中的主要藥動學參數(t1/2β,Vd,Cl和AUC等)和腎組織內的PAH蓄積量以及體外腎切片孵育后的PAH攝取量的差異,并以定量實時-PCR最終驗證了所測供試物對受試小鼠腎組織Oat基因的調控,以此推測板藍根及其所含靛藍和靛玉紅對人類腎主要OAT的可能影響。
有研究報道,小鼠Oat1,Oat2和Oat3與人類OAT1,OAT2和OAT3具有高度同源性[17,28-29],并且同樣分布于腎近曲小管基底膜上[13-18,30]。OAT在不同種屬動物的分布有些差異,在人類腎組織主要為OAT1和OAT3,而OAT2雖在腎組織有表達,但主要分布在肝,但在小鼠腎組織不僅有Oat1和Oat3,而且還有專屬性的Oat2[17]。因此,本研究一并檢測了Oat2及其對應mRNA。
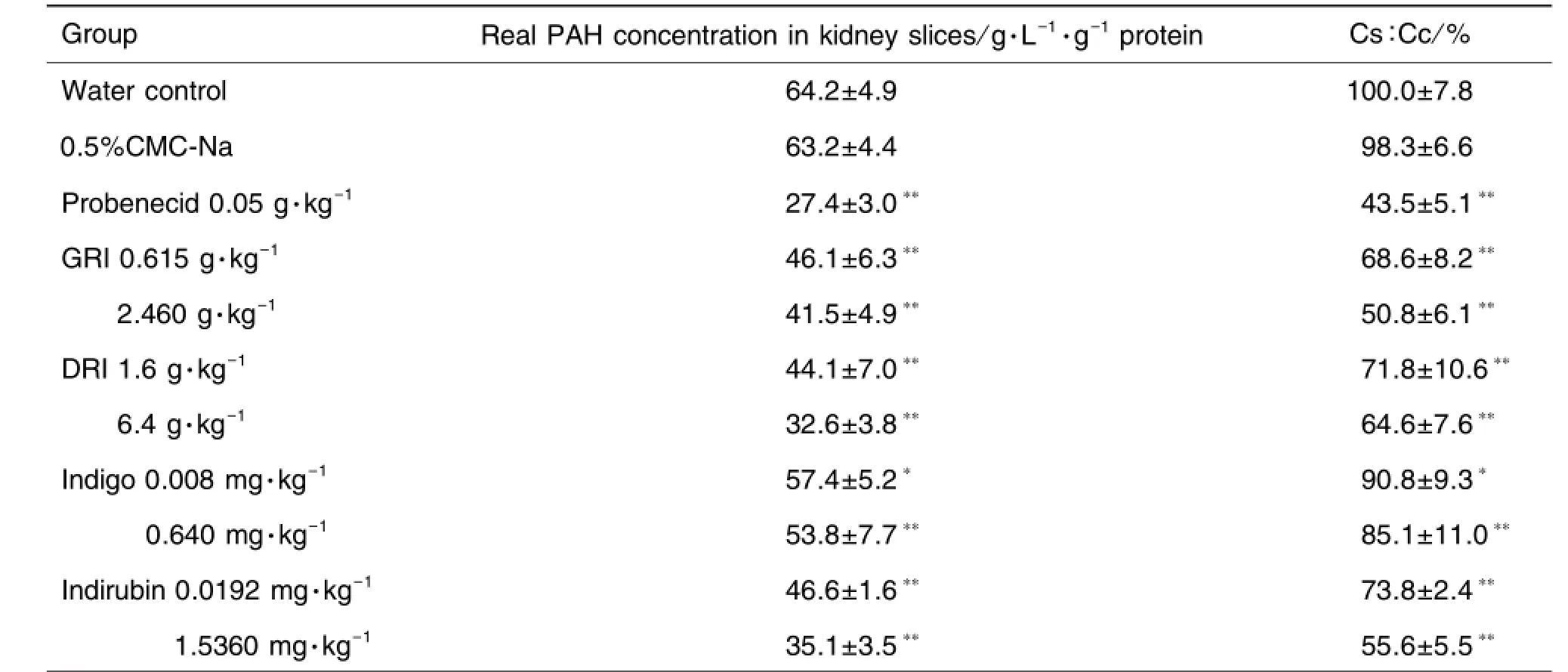
Tab.4 Effect of GRI,DRI,indigo and indirubin on PAH uptake by kidney sIices of mice
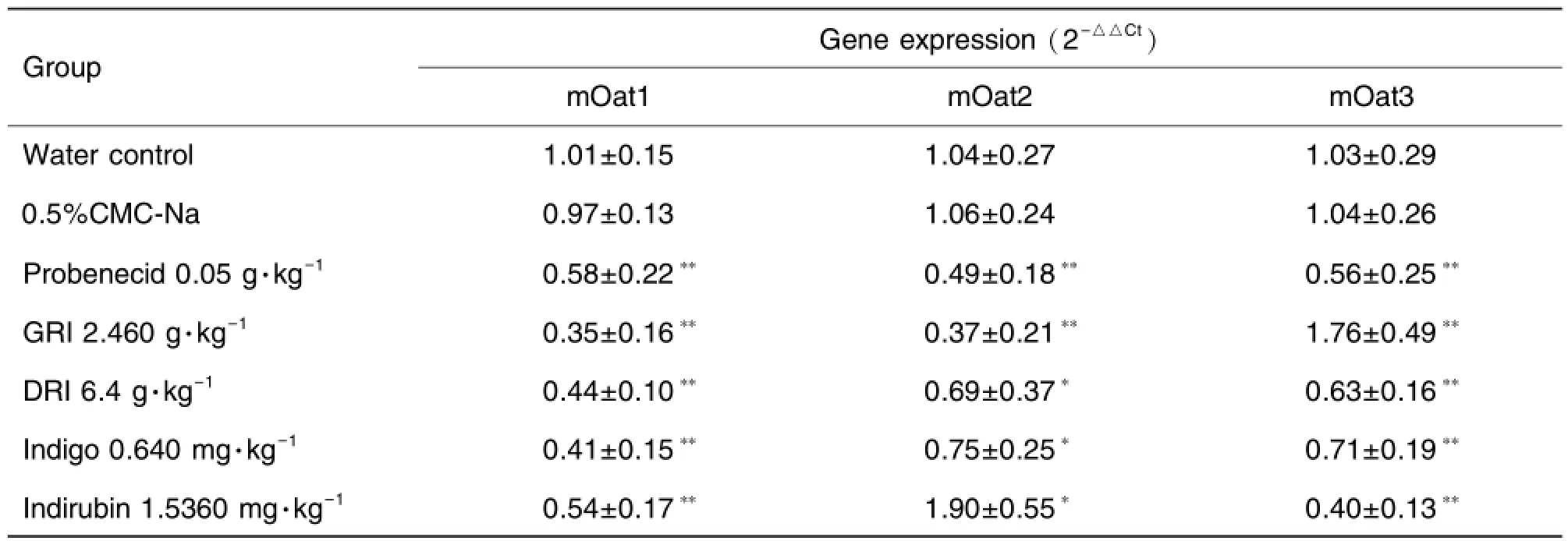
Tab.5 Expression of Oat1,Oat2 and Oat3 mRNA in kidney tissue of mice after treatment with GRI,DRI,indigo and indirubin
GRI臨床用量為5~10 g一次,一日3~4次(本研究取每人5 g),而板藍根飲片臨床用量為10~15 g[1](本研究取每人13 g)。本研究依據黃繼漢等[31]的建議將小鼠等效于臨床劑量,設為臨床用量的8倍,而將高劑量設為臨床用量的32倍,為此本研究劑量分別為GRI 0.615及2.460 g·kg-1(生藥量)和DRI 1.6及6.4 g·kg-1(生藥量)。
據報道,靛藍和靛玉紅具有抗菌作用[1-2],故長期以來靛藍和靛玉紅一直被作為GRI、板藍根及大青葉等藥材的活性成分及質控和工藝考察的指標[3-4]。然而板藍根藥材中,靛藍和靛玉紅的含量跨度范圍 很 大[2-9,19],分 別 為 0.000005% ~0.09574%(相差19 148倍)和0.0%~0.08639% (相差 8639倍)。因本研究假設靛藍的含量為0.0005%,靛玉紅的含量為0.0012%,故在所設DRI劑量 1.6和 6.4 g·kg-1中,靛藍含 0.008和0.032 mg·kg-1,靛玉紅含0.0192和0.0768 mg·kg-1。據報道,GRI中靛藍和靛玉紅的含量<0.001% (10 μg·g-1藥材)[2-9,19],由此推算,本研究所用GRI 0.615和2.460 g·kg-1中二者分別含 0.0062和0.0246 mg·kg-1(比本次所用劑量小1.3~62.4倍)。本研究測得本次所用DRI中靛藍含29.45 μg·g-1(0.002945%,比本次假設含量高5.9倍),靛玉紅含3.12 μg·g-1(0.000312%,是本次假設含量的0.3倍)。GRI中靛藍含3.03 μg·g-1(0.000303%,是本次假設含的0.6倍),靛玉紅含3.92 μg·g-1(0.000392%,是本次假設含量的0.3倍)。
雖然靛藍和靛玉紅的毒性很低(小鼠經口給藥,靛藍LD50>32 g·kg-1,而靛玉紅LD50為0.3 g·kg-1)[32],在一定劑量范圍內比較安全(靛玉紅在國內外已有多年被用于抗腫瘤藥物[33])。然而,本研究的多次重復實驗中二者所用劑量非常小,遠低于藥材及制劑中的實際含量,但其對Oat的抑制作用卻依然非常明顯,這不得不引起我們的注意。板藍根中另含有幾十種其他成分,因其大多含量很少,來源困難,故本研究未觀察它們對Oat的抑制作用。雖不能排除這些成分也可能參與抑制Oat,但從靛藍和靛玉紅在本研究中所用劑量的效應來看,板藍根抑制Oat的作用可能主要來自靛藍和靛玉紅。因此推測,凡含有靛藍和靛玉紅的草藥中可能均會影響腎Oat的功能。
GRI中除其水提物外作為添加劑還有糊精和蔗糖[1],文獻檢索中未發現此兩種物質對藥物代謝酶和轉運體有影響,但因一些藥代酶及轉運體對許多化合物非常敏感,本研究在PAH清除實驗中仍然增設了糊精加蔗糖對照組(二者1∶1混合物,各1.5 g·kg-1),以驗證它們是否參與GRI抑制Oat的作用。本研究結果表明,糊精加蔗糖組小鼠的各項PK參數與純水對照組或CMC-Na對照組比較,均無統計學差異。因而在腎切片攝取PAH實驗和PCR實驗中均省略了該對照組。
為了選擇合適的采血時間范圍,在預實驗中分別給受試小鼠口服純水和丙磺舒1次,90 min后尾靜脈注入PAH 30 mg·kg-1,在注射PAH后1.0,2.5,5.0,7.5,10,12.5,15,20,25,30,40,50,60 min時分別采血并定量血中PAH含量,作出完整的PAH藥-時曲線圖。結果顯示,其AUC在丙磺舒組明顯大于純水組,說明丙磺舒抑制了腎Oat對PAH的攝取和排泄,使血中的PAH殘留量增加。另外,血中PAH濃度在30 min前各采血點兩組間均有明顯差異,因此,在正式實驗中本研究在0~20 min區間設計了6個采血點。
通常認為AUC是最重要的PK參數,因此本研究也參照文獻[34-35]對不同劑量各供試物組的血清AUC及腎組織AUC予以了關注。與對照組相比,各劑量供試物組血清 AUC全部增加(增加39%~59%),然而各組間腎組織AUC對血清AUC比值均無顯著差異。這說明PAH幾乎不受除OAT以外的其他轉運體或代謝酶的影響。當血中濃度升高時,腎組織中濃度也以相似的比例升高,而AUC比值(腎組織/血清)在各組間幾乎相同,均在0.31~0.43范圍變化。
本研究在正式腎切片攝取PAH實驗前,對孵育液中最佳PAH濃度和最佳孵育時間等進行了考察。結果表明,PAH濃度在1.0~2.0 mmol·L-1范圍時較合適,而孵育時間則以20 min為宜,時間過長反而呈下降趨勢(數據略)。當腎小管表皮細胞的基底膜上的OAT被抑制時探針藥PAH被攝入腎小管的量就減少[13]。因此,PAH清除實驗是通過體內方法測定血中PAH藥動參數及腎組織(勻漿)中PAH蓄積量來反映腎小管上OAT的功能,而腎切片攝取PAH實驗則是用體外方法驗證OAT的功能是否受阻。
實時熒光PCR實驗結果表明,與相應對照組比較,GRI、DRI、靛藍和靛玉紅4種供試物均顯著改變了腎組織Oat1,Oat2及Oat3 mRNA表達水平,除靛玉紅組Oat2 mRNA和GRI組Oat3 mRNA表達水平被顯著上調外,其他Oat mRNA表達均被顯著下調。由此進一步表明,GRI、DRI、靛藍和靛玉紅可明顯抑制小鼠Oat的功能。至于靛玉紅上調Oat2 mRNA表達、GRI上調Oat3 mRNA表達,可能是Oat2和Oat3 mRNA表達與對應轉運體蛋白表達水平不一致所致[36-39]。
本研究結果表明,小鼠給予GRI、DRI、靛藍和靛玉紅4種供試物后,在PAH清除實驗中,t1/2β延長25%~89%,Vd減少34%~54%,Cl下降25%~42%,AUC0→20min增加39%~59%,腎組織中 PAH蓄積量大幅增加;體外孵育的腎切片對PAH的攝取量明顯減少,Oat1,Oat2及Oat3 mRNA表達明顯改變,即上述作用與丙磺舒相似。由此提示,板藍根及其所含靛藍、靛玉紅可強烈抑制Oat1,Oat2和Oat3的功能。
對于板藍根及其主要成分抑制OAT1,OAT2和OAT3各亞型的程度,它們在基因水平上對小鼠腎Oat所產生的抑制作用是否與某些核受體如組成型雄烷受體和孕烷X受體等或微小RNA等有關,以及對有機陽離子轉運體的影響及其動力學參數尚待研究。
致謝:本校2009級畢業實習生陳怡蘭、曹小會、趙亞雷、王雪榮、張敏、王藝璇、曾思娜、李永斌、李麗君等參加了部分實驗工作,在此表示謝意。
[1] ChinesePharmacopoeiaCommission.Chinese Pharmacopoeia,Vol 1(中華人民共和國藥典一部)[S].Beijing,Chinese Medical Science and Technology Press,2010.800-801.
[2] Fan LF,Zhang LT,Yuan ZF,Xu HJ,He W. HPLC determination contents of indigo and indirubin in Radix Isatidis[J].Chin J Pharm Anal(藥物分析雜志),2008,28(4):540-543.
[3] Sun LX,Tang H,Yin P,Ning LL,Bi KS.Determination of the content of indigo and indirubin in the indigowoad root and leaves by RP-HPLC[J].J Shenyang Pharm Univ(沈陽藥科大學學報),2000,17(3):191-193.
[4] Jiang J,Sun M,Yang BL,Wang B,Jiang GB. Study on testing model for indigotin and indirubin contents of compound indigowoad root granule using NIRS[J].J Anhui Agri Sci(安徽農業科學), 2009,37(32):15676-15678.
[5] Xiao SS,Jin Y,Sun YQ.Recent progress in the studies of chemical constituents,pharmacological effects and quality control methods on the roots of Isatis indigotica[J].J Shenyang Pharm Univ(沈陽藥科大學學報),2003,20(6):455-459.
[6] Zhang GQ.Study on efficacy and adverse effect of Banlangen[J].Sun Yatsen Univ Forum(中山大學學報論叢),2007,27(18):293-296.
[7] Zhou LL.Talking about the adverse reactions and the rational use of medicine[J].Chin J Curr Tradit West Med(中華現代中西醫雜志),2005,12(3): 1114.
[8] Huang JT.Review on chemical components and pharmacological effect of Banlangen[J].Chin J Mod Drug Appl(中國現代藥物應用),2009,3 (15):197-198.
[9] Li YF,Zhang LH,Zhao JR.Adverse effects of Banlangen[J].Chin J Clin Ration Drug Use(臨床合理用藥),2011,4(11A):92-93.
[10] Hediger MA,Johnson RJ,Miyazaki H,Endou H. Molecular physiology of urate transport[J].Physiology(Bethesda),2005,20:125-133.
[11] Sekine T,Miyazaki H,Endou H.Molecular physiology of renal organic anion transporters[J].Am J Physiol Renal Physiol,2006,290(2):F251-F261.
[12] Duan P,You G.Novobiocin is a potent inhibitor for human organic anion transporters[J].Drug Metab Dispos,2009,37(6):1203-1210.
[13] Burckhardt G,Burckhardt BC.In vitro and in vivo evidence of the importance of organic anion transporters(OATs)in drug therapy[J].Handb Exp Pharmacol,2011,(201):29-104.
[14] Bakhiya N,Arlt VM,Bahn A,Burckhardt G,Phillips DH,Glatt H.Molecular evidence for an involvement of organic anion transporters(OATs)in aristolochic acid nephropathy[J].Toxicology,2009,264(1-2):74-79.
[15] Babu E,Takeda M,Nishida R,Noshiro-Kofuji R,Yoshida M,Ueda S,et al.Interactions of human organic anion transporters with aristolochic acids [J].J Pharmacol Sci,2010,113(2):192-196.
[16] Hagos Y,Wolff NA.Assessment of the role of renal organic anion transporters in drug-induced nephrotoxicity[J].Toxins(Basel),2010,2(8): 2055-2082.
[17] Klaassen CD, Aleksunes LM.Xenobiotic, bile acid,and cholesterol transporters:function and regulation[J].Pharmacol Rev,2010,62(1): 1-96.
[18] Sweet DH,Miller DS,Pritchard JB,Fujiwara Y,Beier DR,Nigam SK.Impaired organic anion transport in kidney and choroid plexus of organic anion transporter 3(Oat3(Slc22a8))knockout mice[J].J Biol Chem,2002,277(30):26934-26943.
[19] Ma L,Sun Q,Li Y,Xiao XH.HPLC determination of indigo and indirubin in Radix Isatidis and Banlangen granules[J].Chin J Pharm Anal(藥物分析雜志),2010,30(9):1642-1645.
[20] Sweeney DE,Vallon V,Rieg T,Wu W,Gallegos TF,Nigam SK.Functional maturation of drug transporters in the developing,neonatal,and postnatal kidney[J].Mol Pharmacol,2011,80(1): 147-154.
[21] Kiguchi M,Sudo J.Comparative study of colorimetric method using diazotization reaction and high-performance liquid chromatographic method in determination of para-aminohippuric acid[J].J Toxicol Sci,1987,12(3):301-307.
[22] Nakakariya M,Shima Y,Shirasaka Y,Mitsuoka K,Nakanishi T,Tamai I.Organic anion transporter OAT1 is involved in renal handling of citrulline[J]. Am J Physiol Renal Physiol,2009,297(1):F71-F79.
[23] Cristofori P,Zanetti E,Fregona D,Piaia A,Trevisan A.Renal proximal tubule segment-specific nephrotoxicity:an overview on biomarkers and histopathology[J].Toxicol Pathol,2007,35(2):270-275.
[24] Chen ZY,Zheng QS,Sun RY.Functions of the DAS software for pharmacological calculation[J]. Chin J Clin Pharmacol Ther(中國臨床藥理學與治療學),2002,7(6):562-564.
[25] Bailer AJ.Testing for the equality of area under the curves when using destructive measurement techniques[J].J Pharmacokinet Biopharm,1988,16 (3):303-309.
[26] Chew WK,Segarra I,Ambu S,Mak JW.Significant reduction of brain cysts caused by Toxoplasma gondii after treatment with spiramycin coadministered with metronidazole in a mouse model of chronictoxoplasmosis[J].Antimicrob Agents Chemother,2012,56(4):1762-1768.
[27] Drug Development and Drug Interactions:Table of Substrates,Inhibitorsand Inducers[EB/OL]. (2006-05-01)[2014-11-06]http://www.fda.gov/ Drugs/DevelopmentApprovalProcess/Development-Resources/DrugInteractionsLabeling/ucm093664.htm
[28] Burckhardt G,Wolff NA.Structure of renal organic anion and cation transporters[J].Am J Physiol Renal Physiol,2000,278(6):F853-F866.
[29] Ohtsuki S,Kikkawa T,Mori S,Hori S,Takanaga H,Otagiri M,et al.Mouse reduced in osteosclerosis transporter functions as an organic anion transporter 3 and is localized at abluminal membrane of blood-brain barrier[J].J Pharmacol Exp Ther,2004,309(3):1273-1281.
[30] Buist SC,Klaassen CD.Rat and mouse differences in gender-predominant expression of organic anion transporter(Oat1-3;Slc22a6-8)mRNA levels[J].Drug Metab Dispos,2004,32(6):620-625.
[31] Huang JH,Huang XH,Chen ZY,Zheng QS,Sun RY.Dose conversion among different animals and healthy volunteers in pharmacological study[J]. Chin J Clin Pharmacol Ther(中國臨床藥理學與治療學),2004,9(9):1069-1072.
[32] MaterialSafetyData Sheet(MSDS)[EB/OL]. (2002-08-16)[2014-1-30]http://www.ilpi.com/msds/
[33] Buolamwini JK.Cell cycle molecular targets in novel anticancer drug discovery[J].Curr Pharm Des,2000,6(4):379-392.
[34] US-FDA.Center for Drug Evaluation and Research (CDER),Guidance for Industry,Drug Interaction Studies-Study Design,Data Analysis,Implications for Dosing,and Labeling Recommendations[EB/ OL].(2012-05-01)[2004-01-30]http://www.fda. gov/Drugs/GuidanceComplianceRegulatory-Information/Guidances/default.htm
[35] US-FDA.Drug Development and Drug Interactions: Possible Models for Decision Making[EB/OL]. (2006-03-24)[2004-01-30]http://www.fda.gov/ Drugs/DevelopmentApprovalProcess/DevelopmentResources/DrugInteractionsLabeling/ucm093583. htm
[36] Villar SR,Brandoni A,Anzai N,Endou H,Torres AM.Altered expression of rat renal cortical OAT1 and OAT3 in response to bilateral ureteral obstruction[J].Kidney Int,2005,68(6):2704-2713.
[37] Kojima R,Sekine T,Kawachi M,Cha SH,Suzuki Y,Endou H.Immunolocalization of multispecific organicanion transporters, OAT1, OAT2, and OAT3,in rat kidney[J].J Am Soc Nephrol,2002,13(4):848-857.
[38] Kimura H,Takeda M,Narikawa S,Enomoto A,Ichida K,Endou H.Human organic anion transporters and human organic cation transporters mediate renal transport of prostaglandins[J].J Pharmacol Exp Ther,2002,301(1):293-298.
[39] Bahn A, Ljubojevic M, Lorenz H, Schultz C,Ghebremedhin E,Ugele B,et al.Murine renal organic anion transporters mOAT1 and mOAT3 facilitate the transport of neuroactive tryptophan metabolites[J].Am J Physiol Cell Physiol,2005,289 (5):C1075-C1084.
Inhibition of Radix Isatidis and its constituents indigo and indirubin on major organic anion transporters Oat1,Oat2 and Oat3 in mouse kidneys
QI Jin-feng1,SUN Chen1,WANG Yong-hui2,YU Wen-hao1,HAN Jian1,LIN Mei3,ZHANG Na1
(1.Department of Pharmacology,College of Traditional Chinese Materia Medica,Guangzhou University of Traditional Chinese Medicine,Guangzhou 510006,China;2.Pharmacy Department,Zhumadian First People′s Hospital,Zhumadian 463000,China;3.Pharmacy Department,Nanhai Hospital of Traditional Chinese Medicine,Foushan 528200,China)
OBJECTIVE To investigate the inhibition of Radix Isatidis and its major constituents indigo and indirubin on three principal subtypes of organic anion transporters(OATs),Oat1,Oat2 and Oat3 in vivo in mice.METHODS Granules of Radix Isatidis(GRI)0.615 and 2.46 g·kg-1,decoction of Radix Isatidis(DRI)1.6 and 6.4 g·kg-1,indigo 0.008 and 0.64 mg·kg-1and indirubin 0.0192 and 1.536 mg·kg-1were ig given to the NIH mice(60 mice per group),twice a day,for 5 d while four control groups were set up,including vehicle of water,0.5%sodium carboxymethyl cellulose(CMC),positive control probenecid(0.05 g·kg-1)and additives of sucrose plus dextrin(1.5 g·kg-1each)groups.After the last dosing of the test samples,para-aminohippuric acid(PAH)clearance test was conducted.All the mice were iv given PAH 0.03 g·kg-1and 1,2.5,5,7.5,10 and 20 min later before 10 mice per group were euthanized to collect whole blood and the kidneys were quickly removed.Each right kidney was homogenized to analyze the PAH accumulations and each left kidney to extract total mRNA for analysis of Oat1,Oat2 and Oat3 gene expressions using quantitative real-time PCR.The concentrations of PAH in sera and in kidney homogenates were determined by the method of Kiguchi.Major pharmacokinetic parameters of PAH in sera were calculated by pharmacokinetic software(DAS2.0).PAH uptake test for kidney slices was performed on another group of NIH mice according to the method of Nakakariya.RESULTS There was no significant difference between water control group and 0.5%CMC group in all the examined items.Compared with the vehicle control groups(water and 0.5%CMC group),elimination half time (t1/2β)of PAH in GRI 2.46 g·kg-1,indigo 0.64 mg·kg-1and indirubin 1.536 mg·kg-1groups was significantly prolonged(P<0.05),the total clearance(Cl)and volume of distribution(Vd)were obviously reduced(P<0.01)and the area under the curve(AUC0-20min)of PAH in all the tested groups was significantly increased(P<0.01).AUC0-20minobtained from renal PAH accumulations within the checked time was significantly higher(P<0.05,P<0.01)than in the vehicle control group.But there was in no significant difference between all the study groups in kidney-to-plasma AUC ratios.PAH uptake results by kidney slices were significantly lower(P<0.05,P<0.01)than in vehicle control group in every two dosages of all the four samples tested.Compared with vehicle control group,the mRNA expressions of Oat1,Oat2 and Oat3 were obviously(P<0.05,P<0.01)and abnormally regulated in the groups of GRI 2.46 g·kg-1,DRI 6.4 g·kg-1,indigo 0.64 mg·kg-1and indirubin 1.536 mg·kg-1.CONCLUSION The renal Oat1,Oat2 and Oat3 of mice are significantly inhibited by GRI,DRI,indigo and indirubin.The inhibitory function of Radix Isatidis probably stems from indigo and indirubin contained in it.
Radix Isatidis;indigo;indirubin;para-aminohippuric acid;organic anion transporters
QI Jin-feng,E-mail:qijinfeng2005@aliyun.com,Tel:13711301907
R285.1
:A
:1000-3002(2014)06-0878-09
10.3867/j.issn.1000-3002.2014.06.010
2014-04-21 接受日期:2014-10-26)
(本文編輯:齊春會)
奇錦峰(1956-),男,醫學博士,研究員,碩士生導師,主要從事藥代動力學(藥物相互作用)研究。
奇錦峰,E-mail:qijinfeng2005@aliyun.com,Tel:13711301907

