繅絲蠶蛹蛋白酶解產物體外抗氧化能力研究
,,,,*
(1. 西南大學食品科學學院,重慶市農產品加工及貯藏重點實驗室,重慶 400716; 2. 家蠶基因組生物學國家重點實驗室,重慶 400716)
蠶蛹含有豐富的蛋白質,干蠶蛹中蛋白質含量高達45% ~ 55%,其中人體必需的8種氨基酸占總氨基酸的40%左右,是人類理想的蛋白質來源[1]。但繅絲蠶蛹有很重、很難除盡的腥味,不能被消費者直接接受;其次,蠶蛹蛋白的水溶性較差,不利于在生產中應用;再次,由于蠶蛹中存在約30ku的大分子蛋白,會引起部分人出現過敏反應,據估計,中國每年大約有1000人因食用蠶蛹蛋白而過敏,甚至出現休克癥狀[2]。因此,有必要對繅絲蠶蛹進行酶解,制備生物活性肽,提高繅絲蠶蛹蛋白的利用價值。
人類的衰老現象及許多慢性疾病都和人體內的自由基水平失衡有關,外源性的抗氧化劑可幫助人們維持體內自由基的平衡[3]。通過對具有抗氧化活性的天然食物進行研究有可能開發出有效的抗氧化藥物和保健食品。研究發現植物蛋白、動物蛋白以及微生物蛋白中能水解分離出抗氧化肽[4]。閔建華等[5]以水解度和DPPH·清除能力為指標,趙鐘興[6]、李高揚等[7],以DPPH·清除能力為指標,盧楠等[8]以總還原能力為指標對酶解過程進行分析,優化了蠶蛹蛋白酶解的最佳工藝,并對水解產物多肽的體外抗氧化活性進行了研究。生物活性肽是近年來研究的熱點,為了提高蠶蛹蛋白酶解產物的抗氧化活性,本文選用了不同的酶酶解繅絲蠶蛹蛋白并對酶解產物的抗氧化能力進行了探討,期望為蠶蛹的深加工和綜合利用提供理論依據和實驗基礎。

表1 五種酶最適水解條件表 Table 1 The table of five enzymes optimal hydrolyse conditions
1 材料與方法
1.1材料與儀器
繅絲蠶蛹 由重慶合川太和絲廠提供;脫脂蠶蛹蛋白(≥77. 31%) 自制,將干燥的繅絲蠶蛹粉碎,用索氏提取器用石油醚作溶劑抽提12h以去除其中的脂肪,剩余物干燥、粉碎而得脫脂蠶蛹蛋白粉;蠶蛹蛋白水解專用酶、中性蛋白酶 南寧東恒華道生物科技有限公司;木瓜蛋白酶、風味酶、胰酶 廣西南寧龐博生物工程有限公司;二苯代苦味酰基(DPPH) Sigma公司;其他常用試劑均為分析純。
pHs - 3C酸度計 上海三信儀表廠;5810型臺式高速離心機 Eppendorf;UV - 2405分光光度計 日本島津公司。
1.2實驗方法
1. 2. 1 繅絲蠶蛹蛋白的酶解 根據前期研究結果,選取以下5種單酶或雙酶對脫脂的繅絲蠶蛹蛋白進行酶解,酶解條件[9]如表1所示。采用恒溫水浴維持水解溫度不變,酶解過程中不斷滴加1mol/L的NaOH或HCl溶液維持pH穩定,4h后停止酶解,沸水浴10min滅酶,迅速冷卻至室溫后用純水補足在酶解過程散失的水分,4000r/min離心15min,收集上清液,冷凍備用進行抗氧化能力的研究。
1. 2. 2 酶解產物還原力的測定 參考Oyaizu[10]的鐵氰化鉀還原法將酶解所得的繅絲蠶蛹蛋白酶解液稀釋100倍進行測定,同時作試劑空白。
將繅絲蠶蛹蛋白酶解液稀釋10倍進行超氧陰離子清除率的測定。以1. 0mL蒸餾水加入2. 5mL的0. 1mol/L Tris - HCL緩沖溶液(pH8. 2,其中含1mmol/L EDTA)調零,加入10μL 50mmol/L的鄰苯三酚(25℃水浴預熱)迅速混勻,在320nm處每隔30s讀取吸光度1次,5min后結束測定。作吸光值隨時間變化的回歸方程,其斜率為鄰苯三酚自氧化速率V1。
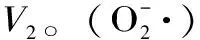
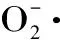
式中:V1- 對照組鄰苯三酚自氧化速率;V2- 樣品組鄰苯三酚自氧化速率。
1. 2. 4 酶解產物對羥自由基(·OH)清除能力的測定 根據參考文獻[13 - 14]的方法將繅絲蠶蛹蛋白酶解液稀釋10倍進行對·OH清除率的測定。
1. 2. 5 酶解產物對二苯代苦味酰基自由基(DPPH·)清除能力的測定 測定方法根據參照文獻[15]略加修改而得。
將繅絲蠶蛹蛋白酶液稀釋100倍進行對DPPH·清除率的測定。用乙醇配制20μg/L DPPH·溶液,避光保存備用。分別取3. 0mL繅絲蠶蛹蛋白酶解稀釋液于試管中,加入3. 0mL20μg/L DPPH·溶液,搖勻,放置30min后在517nm處測定其吸光值。在相同反應體系下分別測定樣品組、樣品空白組、空白對照組的吸光值。DPPH·的清除率計算公式如下:
式中:A1- 空白對照組的吸光值;A2- 樣品組的吸光值;A3- 樣品空白組的吸光值。
每項實驗重復3次以上,實驗結果取平均值,采用Excel 2003、SPSS17. 0進行數據分析,Origin8. 0軟件做圖。
2 結果與分析
2.1五種酶對繅絲蠶蛹蛋白的水解作用
五種酶在最佳的水解條件下與繅絲蠶蛹蛋白作用,計算繅絲蠶蛹蛋白的水解度,結果如圖1所示:
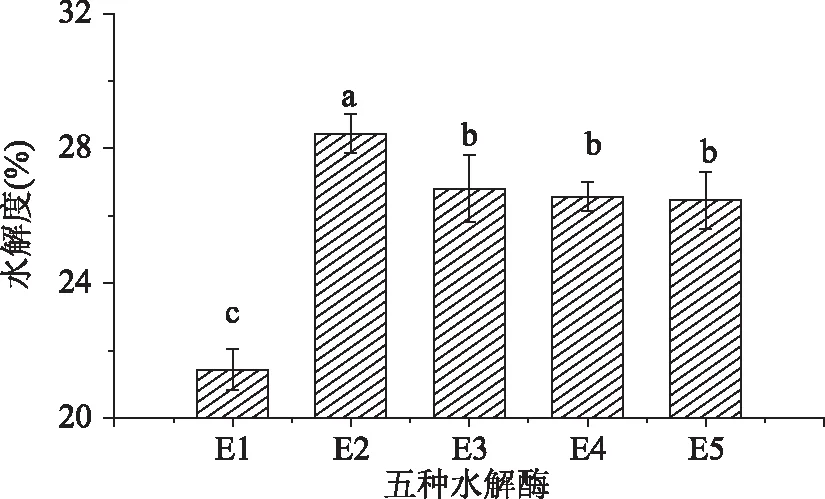
圖1 五種水解酶水解度的比較Fig. 1 Comparison of five kinds of hydrolytic enzyme hydrolysis注:上標為水解度的顯著性分析,不同字母表示不同酶解液的水解度具有顯著性差異(p<0. 05),圖2 ~ 圖5同。
從圖1可以看出,五種酶對繅絲蠶蛹蛋白的水解度均達到了20%以上,其中E2的水解作用最大,水解度為28. 44%,E3、E4、E5的水解作用次之,水解度分別為26. 81%、26. 57%、26. 46%。而E1的水解作用較低,水解度為21. 44%。雙酶水解度較單一酶水解度高,這可能是因為雙酶之間發生了協同作用,促進了蠶蛹蛋白的水解。
以這5種酶酶解繅絲蠶蛹得到的水解產物為樣本,研究它們的體外抗氧化能力。
2.2繅絲蠶蛹蛋白酶解物還原力評價
多項研究表明,抗氧化活性與還原力存在正相關性[16 - 18]。還原力可表示抗氧化物質提供電子的能力,還原能力強的物質可以與自由基反應,通過提供電子使自由基變為穩定的物質,從而阻斷自由基的鏈式反應,為實驗材料清除活性氧等自由基或發揮抗氧化作用提供可能[19]。將繅絲蠶蛹蛋白酶解液稀釋100倍測定其還原力,實驗結果如圖2所示:
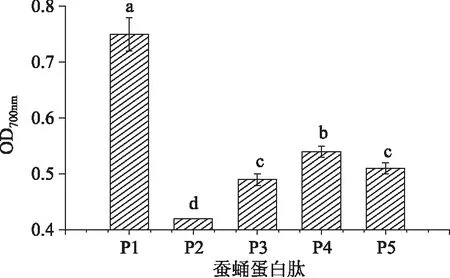
圖2 五種蠶蛹蛋白酶解物還原力的比較Fig. 2 Comparison of reducing power capability of five Silk reeling silkworm pupa protein hydrolysate
還原力主要用于評價抗氧化劑在氧化還原反應過程中整體的抗氧化能力[20]。以吸光值表示還原力,吸光度越高,還原能力越強。由圖2可以看出,P1(蠶蛹蛋白水解專用酶酶解產物)的還原力最高,在700nm處的吸光度達到0. 75,顯著(p<0. 05)高于雙酶酶解生成多肽的還原力。雙酶酶解生成的多肽中,P4(胰酶+中性蛋白酶酶解產物)還原力最高,在700nm處的吸光度為0. 54,P3(蠶蛹蛋白水解專用酶+木瓜蛋白酶酶解產物)和P5(胰酶+風味酶酶解產物)的還原力顯著(p<0. 05)低于P4,700nm處的吸光度分別0. 49和0. 51,P2(蠶蛹蛋白水解專用酶+風味酶酶解產物)的還原力最低,700nm處的吸光度為0. 42。
由上可知,只采用E1酶解蠶蛹蛋白得到的多肽還原力高于復合酶酶解得到的多肽。
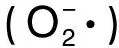
超氧陰離子自由基本身不太活潑,但可通過歧化反應和其它反應途徑產生OH·,是生物體系中自由基產生的根源[21]。人體內的超氧陰離子一旦與羥基自由基(OH·)結合,其產物會導致細胞DNA損壞,破壞人類機體功能,而且其衍生的自由基也具有細胞毒性,會導致細胞DNA損傷及細胞膜損傷[22]。5種繅絲蠶蛹蛋白酶解原液稀釋10倍后對超氧陰離子的清除效果的實驗結果如圖3所示:
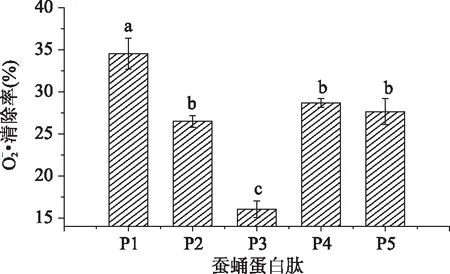
圖3 五種繅絲蠶蛹蛋白酶解物對清除率的比較Fig. 3 Comparison of superoxide anion radical scavenging activity of five Silk reelingsilkworm pupa protein hydrolysate
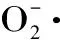
2.4繅絲蠶蛹蛋白酶解物對·OH的清除能力
·OH是已知的存在于需氧生物代謝過程中的最強的氧自由基,幾乎可以和所有的生物大分子發生不同類型的反應,其危害最大,能夠引起生物膜、蛋白質和DNA的氧化損傷,導致細胞衰老、死亡和機體病變[18,23 - 24]。考察將五種繅絲蠶蛹蛋白酶解物稀釋10倍對·OH的清除效果,實驗結果如圖4所示:
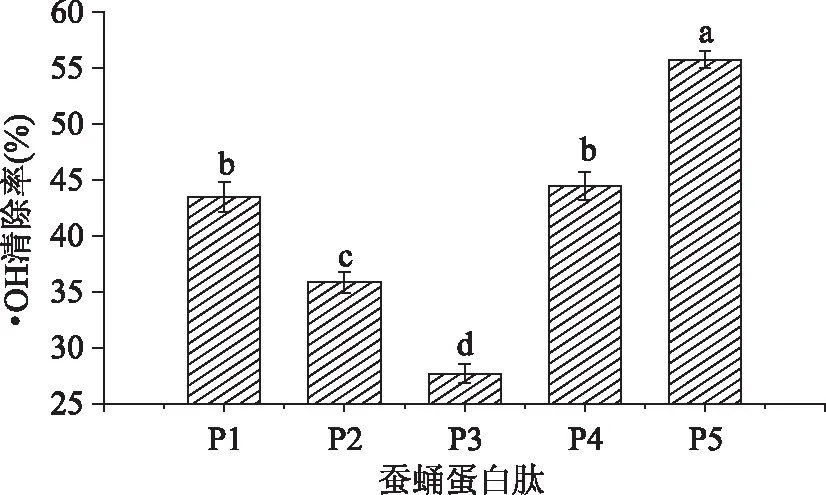
圖4 五種繅絲蠶蛹蛋白酶解物對·OH的清除率的比較Fig. 4 Comparison of hydroxyl radical scavenging activity of five Silk reeling silkworm pupa protein hydrolysate
由圖4可見,稀釋10倍的P5對·OH的清除率顯著(p<0. 05)高于其他組,清除率為55. 77%;稀釋10倍的P1和P4對·OH的清除率次之,分別為43. 77%和44. 52%;稀釋10倍的P3對·OH的清除率最低,僅為27. 72%。相同濃度的酶解物對·OH的清除力比對O-2·的清除力高,這可能是因為·OH極強的氧化能力更易于使肽類被氧化,同時肽類還能與Fe2+鰲合,從而減緩了Fenton反應產生·OH。
由上可知,采用E5酶解蠶蛹蛋白得到的多肽比其他復合酶酶解得到的多肽具有更強的·OH清除能力。
2.5繅絲蠶蛹蛋白酶解物對DPPH·的清除能力
DPPH·是一種較為穩定的以氮為中心的自由基,氮原子上有一個孤對電子,若孤對電子被配對,其乙醇溶液在517nm 處的吸光值減小,溶液顏色的變淺程度與配對電子數成正相關。因此,通過測定517nm 處的吸光值可以評價樣品對芳香自由基的清除能力[25]。考察將五種繅絲蠶蛹蛋白酶解物稀釋100倍對DPPH·清除能力,實驗結果如圖5所示:
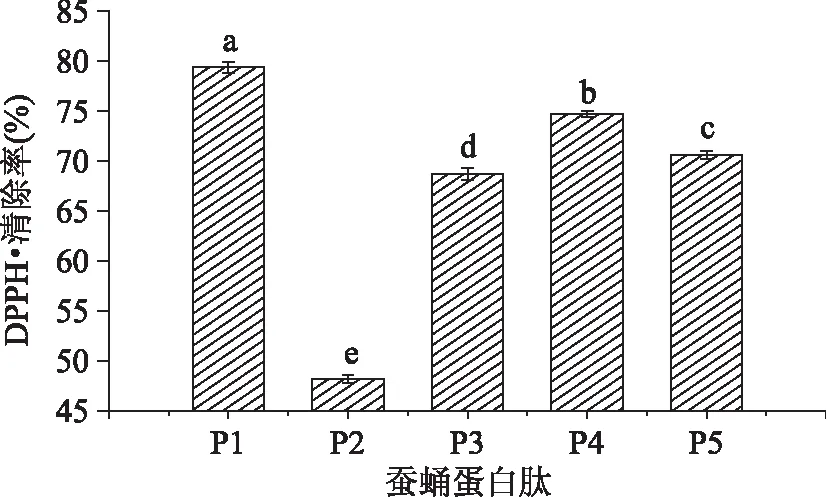
圖5 五種繅絲蠶蛹蛋白酶解物對DPPH·清除率的比較Fig. 5 Comparison of DPPH· radical scavenging activity of five Silk reeling silkworm pupa protein hydrolysate
由圖5可見,不同酶解物對DPPH·清除率具有顯著(p<0. 05)差異,稀釋100倍的P1對DPPH·的清除率顯著(p<0. 05)高于雙酶酶解生成的產物,清除率為79. 38%;稀釋100倍的P4、P5、P3和P2對DPPH·的清除率依次減小,分別為74. 70%、70. 62%、68. 71%和48. 20%,其中P1、P3、P4、P5對DPPH·的清除力均高于采用堿性蛋白酶水解產物對DPPH·最大的清除率(63. 40%)[5]。蠶蛹蛋白水解產物對DPPH·具有很強的清除能力,這可能是因為水解產物直接捕獲或與DPPH·相結合,通過還原作用把電子與質子傳遞給DPPH·氮原子上的單電子生成DPPH2,或者與DPPH·處于平衡狀態的DPPH+發生氧化還原反應并還原DPPH+的氮 - 氮雙鍵使其分解成三硝基苯胺[26],從而達到清除DPPH·的作用。
由上可知,只采用E1酶解繅絲蠶蛹蛋白比其他復合酶水解得到的產物具有更強的DPPH·清除能力。
3 結論
3.1在最佳的水解條件下,E2的水解作用最大,水解度為28. 44%,E3、E4、E5的水解作用次之,水解度分別為26. 81%、26. 57%、26. 46%,而E1的水解作用較低,水解度為21. 44%。
因此可采用E1酶解多肽作為抗氧化肽分離純化的原料。這為蠶蛹的深加工綜合利用及抗氧化肽的廣泛應用提供理論依據和實驗基礎。
[1]董燁平,吳瓊英. 蠶蛹蛋白開發與利用現狀[J]. 農產品加工(學刊),2010(6):17 - 20
[2]Ji K M,Zhan Z K,Chen J J,etal. Anaphylactic shock caused by silkworm pupa consumption in China[J]. Allergy,2008(10):1407 - 1408.
[3]黃進,楊國宇,李宏基,等. 抗氧化劑作用機制研究進展[J]. 自然雜志,2003,26(2):74 - 77.
[4]Zhang T,Li Y H,Miao M,etal. Purification and characterisation of a new antioxidant peptide from chickpea(Cicer arietium L. )protein hydrolysates[J]. Food Chemistry,2011,128(1):28 - 33.
[5]閔建華,李建科,陳婷. 蠶蛹多肽的制備工藝及其體外抗氧化活性[J]. 食品科學,2009,30(14):123 - 126.
[6]趙鐘興,廖丹葵,孫建華,等. 蠶蛹蛋白酶解產物體外抗氧化和降血壓活性篩選及響應面工藝優化[J]. 食品科學,2011,32(23):186 - 190.
[7]李高揚,崔堂兵,陳亮,等. 蠶蛹蛋白酶解制備抗氧化肽的初步研究[J]. 現代食品工業科技,2011,27(7):810 - 814.
[8]盧楠,廖鮮艷,翁新楚. 蠶蛹抗氧化肽的制備及其體外抗氧化活性評價[J]. 上海大學學報,2013,19(2):215 - 219.
[9]張海祥,魏兆軍,周樂春,等. 響應曲面法優化動物蛋白酶水解脫脂蠶蛹蛋白的工藝[J]. 食品科學,2009,30(24):188 - 192.
[10]Oyaizu M. Studies on products of the browning reaction. Antioxidative activities of browning reaction products prepared from glucosamine[J]. Japanese Journal of Nutrition[Eiyogaku Zasshi],1986(6):307 - 315.
[11]王戈莎. 大米多肽的分離純化及其抗氧化活性的研究[D]. 無錫:江南大學,2008.
[12]周徐慧. 漢麻籽蛋白抗氧化肽的制備及其活性研究[D]. 無錫:江南大學,2008.
[13]李銳達. 乳清抗氧化肽的制備及其生物活性研究[D]. 哈爾濱:東北林業大學,2010.
[14]王璇. 黑豆肽的制備及其抗氧化活性研究[D]. 鄭州:河南工業大學,2012.
[15]代衍峰. 抗氧化玉米肽的制備及其功能與結構關系的研究[D]. 無錫:江南大學,2008.
[16]Duh P D. Antioxidant activity of burdock(Arctium lappa Linne):Its scavenging effect on free - radical and active oxygen[J]. Journal of the American Oil Chemists Society,1998(4):455 - 461.
[17]Chang H - Y,HO Y - L,Sheu M - J,etal. Antioxidant and free radical scavenging activities of Phellinus merrillii extracts[J]. Botanical Studies,2007(4):407 - 417.
[18]Li Y,Jiang B,Zhang T,etal. Antioxidant and free radical - scavenging activities of chickpea protein hydrolysate(CPH)[J]. Food Chemistry,2008(2):444 - 450.
[19]Ferreira I C F R,Baptista P,Vilas - boas M,etal. Free -radical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal:Individual cap and stipe activity[J]. Food Chemistry,2007(4):1511 - 1516.
[20]Kou X,Gao J,Xue Z,etal. Purification and identification of antioxidant peptides from chickpea(Cicer arietinum L. )albumin hydrolysates[J]. Lwt - Food Science and Technology,2013(2):591 - 598.
[21]Halliwell B,Gutteridge J M C. Role of free - radicals and catalytic metal - ions in human - disease - an overview[J]. Methods In Enzymology,1990,1 - 85.
[22]Faraggi M,Houee - levin C. Some aspects of the chemistry and biology of the superoxide radical anion[J]. Journal De Chimie Physique Et De Physico - Chimie Biologique,1999(1):71 - 84.
[23]許申鴻. 一種測定·OH產生與清除的新化學發光體系[J]. 分析測試學報,2000(2):11 - 13.
[24]Je J Y,Qian Z J,Byun H G,etal. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry,2007(5):840 - 846.
[25]Shimada K,Fujikawa K,Yahara K,etal. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry,1992(6):945 - 948.
[26]李鉉軍,崔勝云. 抗環血酸清除DPPH自由基的作用機理[J]. 食品科學,2011,32(1):86 - 90.

