二十二碳六烯酸對白介素1β誘導的動脈平滑肌細胞增殖和遷移的影響及機制探究
拓步雄 李超民 葉明霞 劉 薇 李 慧
解放軍第四五一醫院心血管內科,陜西西安710054
二十二碳六烯酸對白介素1β誘導的動脈平滑肌細胞增殖和遷移的影響及機制探究
拓步雄 李超民 葉明霞 劉 薇 李 慧▲
解放軍第四五一醫院心血管內科,陜西西安710054
目的探討二十二碳六烯酸(DHA)對白介素1β(IL-1β)誘導的動脈平滑肌細胞增殖和遷移的影響及機制。方法血管平滑肌細胞(VSMCs)培養及傳代后,分為對照組、IL-1β組、DHA組、IL-1β和DHA處理組四組,其中對照組細胞加入50μL磷酸鹽緩沖液(PBS);IL-1β組細胞加入10 ng/mL IL-1β;DHA組細胞加入80μmol/L DHA;IL-1β和DHA處理組加入10 ng/mL IL-1β和80μmol/L DHA,培養48 h后,噻唑藍(MTT)法和Transwell法檢測VSMCs的增殖和遷移情況;qRT-PCR和Western blotting技術檢測基質金屬蛋白酶(MMP)-2、MMP-9、組織金屬蛋白酶抑制劑(TIMP)-1、TIMP-2和Notch3的表達情況。結果VSMCs的增殖率和遷移能力經IL-1β處理后顯著增高,而IL-1β和DHA處理組顯著低于IL-1β處理組(F=25.537,P=0.003);MMP-2、MMP-9、TIMP-1、TIMP-2的表達量經IL-1β處理后顯著增高,而經IL-1β和DHA共處理后顯著低于IL-1β組(MMP-2:F= 34.286,P=0.000;TIMP-2:F=21.034,P=0.009;MMP-9:F=31.732,P=0.000;TIMP-1:F=18.213,P=0.021);IL-1β組細胞Notch3表達量顯著降低,IL-1β和DHA處理組中Notch3的表達水平則顯著高于IL-1β處理組(F=39.235,P= 0.000)。結論DHA可通過Notch信號通路抑制VSMCs的增殖和遷移。
二十二碳六烯酸;白介素1β;基質金屬蛋白酶-2;基質金屬蛋白酶-9;組織金屬蛋白酶抑制劑-1;組織金屬蛋白酶抑制劑-2;Notch3
血管壁結構的改變是高血壓病理改變的普遍特征。目前普遍認為,高血壓基本病理改變是血管重塑。動脈壁中膜肥厚是高血壓血管壁增厚的主要原因,這與血管平滑肌細胞(vascular smooth muscle cells,VSMCs)的增殖和遷移密切相關。研究表明多不飽和脂肪酸如二十碳五烯酸和二十二碳六烯酸(Docosahexaenoic Acid,DHA)可降低心血管疾病的發病率和病死率[1]。DHA除了具有很好的降血脂作用外,還可以通過影響內皮細胞和VSMCs的生物學行為進而調節血壓。在炎性反應中DHA可降低VSMCs的增殖和遷移[2-3]。研究表明,在高血壓、血管再狹窄和動脈粥樣硬化過程中VSMCs的增殖和遷移與基質金屬蛋白酶(matrixmetalloproteinase,MMP)降解細胞外基質密切相關[4]。當血管損傷后炎癥因子高表達,上調MMP-2和MMP-9,使細胞外基質大量降解,加速了VSMCs向血管內膜遷移,導致血管壁增厚,引起血壓上升,血栓形成[5-6]。目前,有關DHA的降血壓機制的研究尚不多見。本文通過研究DHA對VSMCs增殖及遷移的影響,以及對基質金屬蛋白酶及其抑制劑含量的變化探討了DHA對高血壓的影響及機制。

表1 引物列表
1 材料與方法
1.1 材料與儀器
雄性SD大鼠,山東綠葉制藥有限公司動物實驗中心提供,合格證號:20030020;干粉培養基(DMEM),美國Gibco公司生產;Trizol,加拿大Invitrogen公司提供;Quantscript RT kit,總RNA提取試劑盒購自于Takara公司;瓊脂糖購自于BioWest公司;RIPA裂解液,購自于美國Millipore公司;DHA、噻唑藍(MTT)、二甲基亞砜(DMSO)和胰蛋白酶購自于Sigma公司;水套式二氧化碳孵箱,美國Nuaire公司生產;超凈工作臺,蘇州凈化設備公司生產;PCR儀:MJResearch INC生產。
1.2 方法
1.2.1 細胞培養8周齡的雄性大鼠,頸椎脫臼處死,取胸主動脈,放入磷酸鹽緩沖液(PBS)中清洗。剝去動脈外膜及內膜,取血管的中層組織洗凈后剪成1mm2大小的組織塊,按組織貼塊法接種于200mL/L胎牛血清的DMEM培養液中,于5%CO2、37℃下培養24 h。待細胞達到80%的融合后,用2.5 g/L的胰蛋白酶消化傳代。
1.2.2 實驗分組處理消化細胞并收集細胞懸液,將細胞以1×105/孔接種于24孔細胞培養板中,然后將細胞隨機分為四組:對照組細胞加入50μLPBS培養48 h; IL-1β組細胞加入10 ng/mL IL-1β共培養48 h;DHA組細胞加入80μmol/L DHA培養48 h;IL-1β和DHA處理組細胞加入10 ng/mL IL-1β和80μmol/L DHA培養48 h。
1.2.3MTT檢測細胞增殖細胞增殖采用MTT法進行檢測。細胞消化后通過計數板計數,將細胞以1×104/孔的密度接種至96孔培養板中。接種12 h后,按上述分組方法進行培養。每組做6個重復。培養48 h后每孔加入5 g/L的MTT 20μL,37℃恒溫箱中培養4 h,去上清,每孔加入200μL DMSO,振搖20 min,用紫外分光光度計測定570 nm下的光密度值(OD)。
1.2.4 Transwe l l法檢測細胞侵襲在24孔Transwell上室聚碳酸酯膜(膜孔徑8μm)上涂1 g/L的matrigel 70μL,37℃,60 min使之在微孔濾膜上重組為基底膜結構。取對數生長期的VSMCs,以DMEM培養液[不加胎牛血清(FBS)],調整細胞懸液中細胞數為l×105/mL,取200μL細胞懸液接種于Transwell上室內,下室加入10%FBS的DMEM培養液500μL,37℃,5%CO2培養24 h后,將濾膜上層細胞用棉簽抹去,濾膜以甲醇固定,然后用結晶紫染色15min。100倍光鏡下選擇膜上、下、左、右、中5個不同視野的穿過膜細胞數,求平均值。
1.2.5 qRT-PCR檢測VSMCs細胞分組處理48 h后,利用PBS清洗細胞3遍,然后胰酶消化收集細胞,依據試劑盒說明,采用Trizol(Invitrogen,CA)抽提法提取總RNA,提取出的RNA用紫外分光光度計測OD值,以確定RNA的濃度和純度;采用Quantscript RT kit反轉錄合成cDNA,PCR擴增。PCR擴增條件:94℃,1.5min;94℃,1 min;64℃,1 min;72℃,1 min 40個循環,最后在72℃下延伸10 min,同樣的方法擴增內參基因三磷酸甘油醛脫氫酶(GAPDH)。引物信息見表1。
1.2.6 Wes te rn b l ot t ing檢測蛋白表達細胞分組處理48 h后,利用PBS清洗細胞3遍,然后胰酶消化收集細胞,用RIPA細胞蛋白裂解液提取細胞中的蛋白,二辛可酸(BCA)法測定蛋白濃度。蛋白樣品經SDS-PAGE電泳,上樣量為40μg/行,電泳完畢后,電轉移至PVDF膜進行如下處理:牛血清白蛋白(BSA)封閉過夜,一抗(1∶1000比例稀釋)室溫撫育2 h,磷酸鹽吐溫緩沖液(PBST)洗滌3次,辣根過氧化物酶(HRP)-IgG(1∶100比例稀釋)室溫撫育2 h,PBST洗滌3次,電化學發光(ECL)顯色,暗室曝光。
1.3 統計學方法
采用統計軟件SPSS 13.0對實驗數據進行分析,計量資料數據以均數±標準差(x±s)表示,兩兩比較采用t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 VSMCs的增殖情況
MTT法檢測VSMCs的增殖情況,結果顯示,DHA組VSMCs的相對增殖率與對照組比較,差異無統計學意義(P>0.05);而IL-1β組VSMCs的相對增殖率顯著增高(P<0.05);IL-1β和DHA共處理組VSMCs的相對增殖率與IL-1β組VSMCs的相對增殖率相比顯著下降(P<0.01)。見圖1。

圖1 不同處理組血管平滑肌細胞的相對增殖率
2.2 VSMCs的遷移情況
Transwell法檢測VSMCs的遷移,結果顯示,DHA組VSMCs的穿膜均數為(18.24±5.31)個,與對照組[(22.17±4.58)個]比較,差異無統計學意義(P>0.05);IL-1β組VSMCs的穿膜均數高達(64.72±21.35)個,顯著高于對照組,差異有統計學意義(P<0.05);當經IL-1β處理的VSMCs與DHA共培養時,VSMCs的穿膜數量為(38.94±8.45)個,顯著低于IL-1β組VSMCs的穿膜數量,差異有統計學意義(P<0.05)。
2.3 VSMCs中MMP-2、TIMP-2、MMP-9和TIMP-1的表達
Western blotting檢測MMP-2、TIMP-2、MMP-9及TIMP-1在VSMCs中的表達,結果顯示,與對照組比較,DHA組VSMCs中MMP-2、TIMP-2、MMP-9、TIMP-1的表達量和MMP-2/TIMP-2、MMP-9/TIMP-1的比值改變不顯著,差異無統計學意義(P>0.05);而IL-1β組的VSMCs中MMP-2、TIMP-2、MMP-9、TIMP-1的表達量和MMP-2/TIMP-2、MMP-9/TIMP-1的比值顯著增高,差異有統計學意義(P<0.05)。當經IL-1β處理的VSMCs與DHA共培養48 h后,細胞中的MMP-2、MMP-9的表達量和MMP-2/TIMP-2、MMP-9/TIMP-1的比值與IL-1β組相比有顯著降低,差異有統計學意義(P<0.05)。見圖2、3。
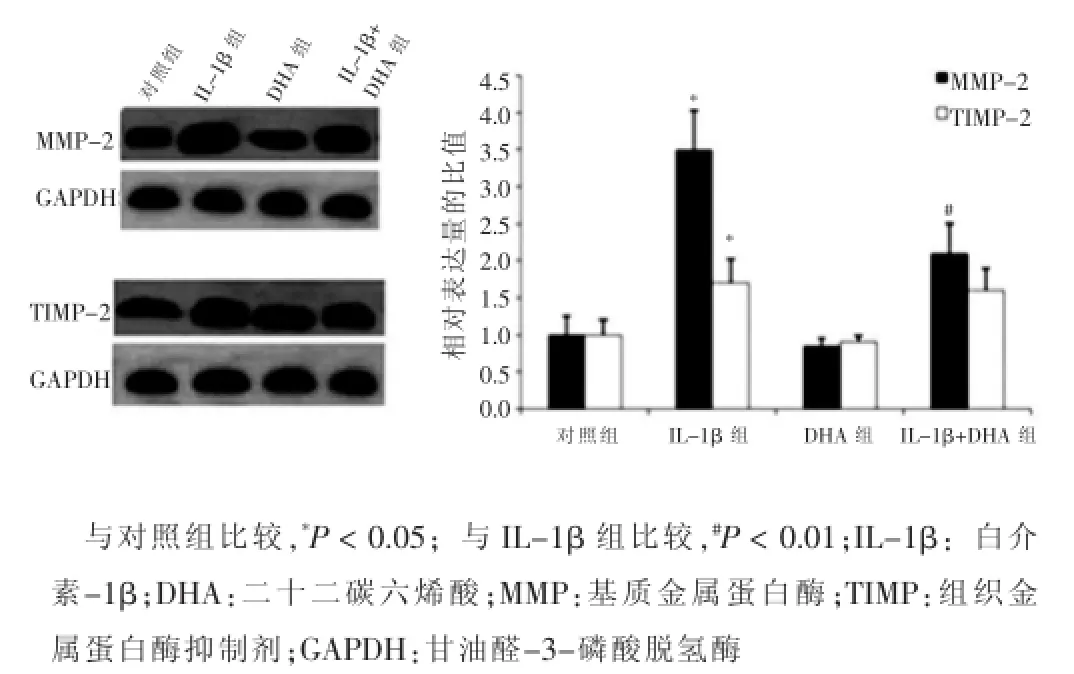
圖2 不同處理組血管平滑肌細胞中MMP-2和TIMP-2的表達
2.4 Notch信號通路關鍵調控因子Notch3在VSMCs中的表達
DHA組VSMCs中Notch3的表達量與對照組比較,差異無統計學意義(P>0.05);Notch3在IL-1β組VSMCs中的表達量顯著低于對照組,差異有統計學意義(P<0.05);當經IL-1β處理的VSMCs與DHA共培養48 h后,VSMCs中的Notch3表達量與IL-1β組相比顯著增高,差異有統計學意義(P<0.05),提示DHA對VSMCs增殖和遷移的抑制作用是通過Notch信號通路實現的。見圖4。
3 討論
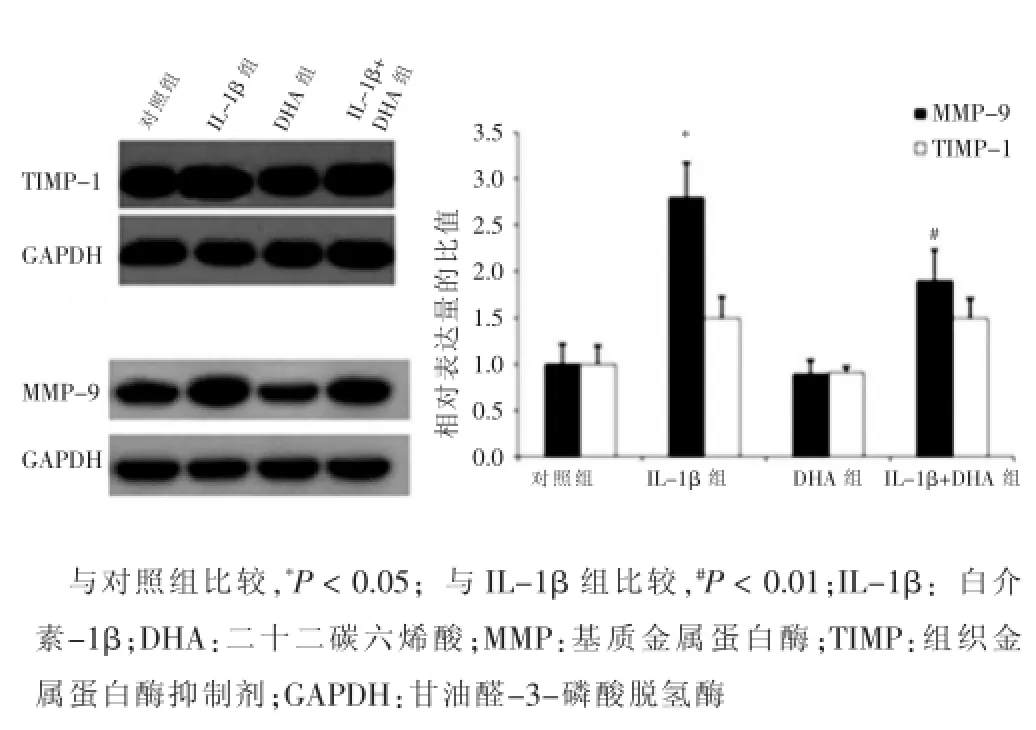
圖3 不同處理組血管平滑肌細胞中MMP-9和TIMP-1的表達
VSMCs是構成血管壁的重要組成成分,其增殖過度是導致多種心血管疾病,尤其是高血壓、動脈粥樣硬化、血管再狹窄等的關鍵環節[7-8]。正常成熟的血管中VSMCs處于分化狀態,當局部血管在炎癥因子等刺激作用下損傷后,局部釋放大量細胞因子和生長因子,使位于中膜的VSMCs表型發生改變,導致細胞收縮功能消失,并由中膜向內膜遷移、增殖,同時分泌大量的細胞外基質(extra-cellularmatrix,ECM)。本實驗用炎癥因子IL-1β對VSMCs進行了處理,誘導VSMCs細胞發生炎性反應,引起其大量增殖,然后用DHA進行處理,比較不同處理組VSMCs中MMP-2和MMP-9及其抑制劑的表達差異,并對Notch信號途徑中的主要調控因子Notch3進行了檢測,探討DHA對VSMCs增殖和遷移的影響及機制。
MMPs是一類可降解ECM的鋅蛋白酶家族,以酶原的形式分泌,由其他蛋白酶或炎癥因子激活,在組織重構及ECM的動態平衡中發揮著重要作用[9]。TIMPs是MMPs的主要抑制劑,主要由肌成纖維細胞、VSMCs、激活的星形膠質細胞等分泌,其分泌為基本的生理所需,隨MMPs的表達而表達,二者維持在一定的比例,調節ECM的動態平衡,若二者的比例失衡,將引起多種病理反應。本研究發現經IL-1β誘導的VSMCs的增殖及遷移能力顯著增高,且MMP-2、MMP-9、TIMP-1和TIMP-2的表達量顯著上調,MMP-2/TIMP-2、MMP-9/TIMP-1的比值均顯著增高,比例失調。與DHA共培養后VSMCs的增殖及遷移能力顯著下降,MMP-2和MMP-9的表達量及MMP-2/TIMP-2、MMP-9/TIMP-1的比值都表現為顯著下調。說明VSMCs的增殖及遷移與MMP-2/TIMP-2、MMP-9/TIMP-1的比例失衡具有相關性,DHA可以降低MMP-2和MMP-9的表達量,從而降低MMP-2/TIMP-2、MMP-9/TIMP-1的比值,對抑制VSMCs的增殖及遷移發揮重要的作用。
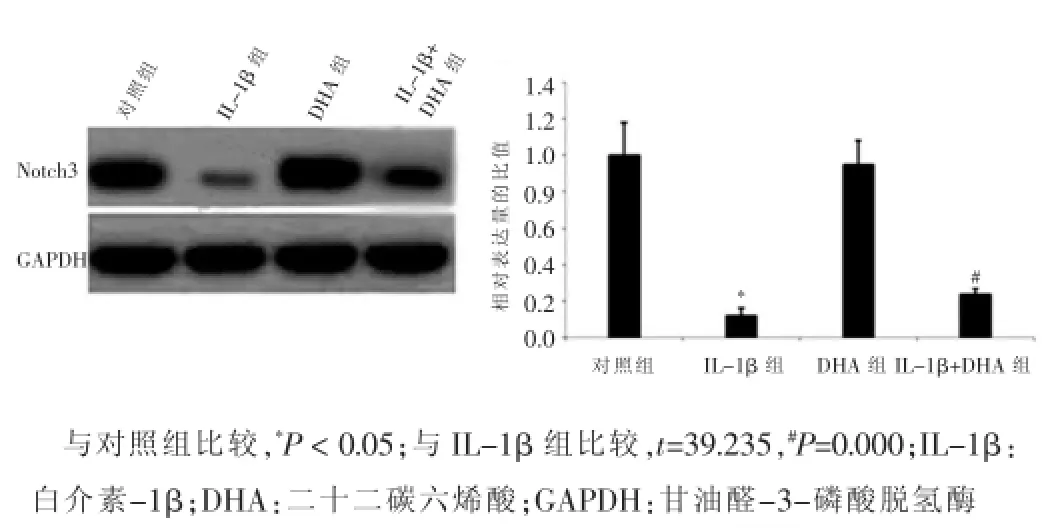
圖4 不同處理組血管平滑肌細胞中Notch3的表達
Notch信號通路一條最初發現于果蠅、高度保守的信號轉導途徑,廣泛存在于各種生物體內。Armulik等[10]的研究發現Notch信號通路在調節VSMCs形態和功能中發揮重要作用。本研究發現:經IL-1β處理的VSMCs中低表達Notch3;經IL-1β處理的VSMCs與DHA共培養后Notch3的表達量表現為顯著增高,VSMCs的增殖和遷移能力也顯著降低,說明Notch3在DHA抑制平滑肌細胞增殖和遷移中發揮重要作用。
DHA對VSMCs生理功能的調節作用已被多個研究所報道[11-12]。有研究認為ω-3不飽和脂肪酸特別是DHA一方面極易與膜磷脂或三酰甘油相融合并增加VSMCs膜固醇類的流動從而對與胞膜密切相關的信號分子產生影響[13],而另一方面對細胞膜離子通道進行調控,最終調節細胞內的信號轉導[14]。
綜上所述,本研究發現DHA可以降低炎性反應所引起的VSMCs中MMP-2和MMP-9的高表達,調節MMP-2/TIMP-2、MMP-9/TIMP-1的比例,抑制VSMCs的增殖和遷移,在高血壓的病理過程中發揮重要作用。同時,本研究發現DHA發揮調節作用的過程中Notch3起到了關鍵性的作用,此結果提示DHA作用的發揮可能是通過Notch信號通路實現的。
[1]NO authors.Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction:results of the GISSI-Prevenzione trial.Gruppo Italiano per lo Studio della Sopravvivenza nell'infarto miocardico[J].Lancet,1999,354(9177):447-455.
[2]Abeywardena MY,Head RJ.Longchain n-3 polyunsaturated fatty acids and blood vessel function[J].Cardiovasc Res,2001,52(3):361-371.
[3]Robinson JG,Stone NJ.Antiatherosclerotic and antithrombotic effects of omega-3 fatty acids[J].Am J Cardiol,2006,98(4A):39-49.
[4]Galis ZS,Khatri JJ.Matrixmetalloproteinases in vascular remodeling and atherogenesis:the good,the bad,and the ugly[J].Circ Res,2002,90(3):251-262.
[5]Bond M,Chase AJ,Baker AH,etal.Inhibition of transcription factor NF-kappaB reducesmatrixmetalloproteinase-1,-3 and-9 production by vascular smoothmuscle cells[J]. Cardiovasc Res,2001,50(3):556-565.
[6]WangM,Zhao D,SpinettiG,et al.Matrixmetalloproteinase 2 activation of transforming growth factor-beta1(TGF-beta1)and TGF-beta1-typeⅡreceptor signaling within the aged arterialwall[J].Arterioscler Thromb Vasc Biol,2006,26(7):1503-1509.
[7]Hattori Y,Hattori S,Sato N,et al.High-glucose-induced nuclear factorκB activation in vascular smooth muscle cells[J].Cardiovase Res,2000,46(1):188-197.
[8]趙娟,王紅,于傘鑫,等.Urantide對大鼠血管平滑肌細胞增殖的影響[J].吉林大學學報:醫學版,2011,37(6):1079-1082.
[9]Oheake Y,Tojo H,SeikiM.Multifunctional roles of MTl-MMP in myofiber formation and morphostaticmaintenance of skeletalmuscle[J].JCell Sic,2006,119(18):3822-3832.
[10]Armulik A,Abramsson A,Betsholtz C.Endothelial/pericyteinteractions[J].Circ Res,2005,97(6):512-523.
[11]Botham KM,Wheeler-Jones CP.Postprandial lipoproteins and the molecular regulation of vascular homeostasis[J]. Prog Lipid Res,2013,52(4):446-464.
[12]Song J,Kwon N,Lee MH,etal.Association of serum phospholipid PUFAswith cardiometabolic risk:beneficial effect of DHA on the suppression of vascular proliferation/ inflammation[J].Clin Biochem,2014,47(6):361-368.
[13]Dusserre E,PulciniT,Bourdillon MC,etal.ω-3 Fatty acids in smooth muscle cell phospholipids increase membrane cholesterol efflux[J].Lipids,1995,30(1):35-41.
[14]Hirafuji M,Machida T,Hamaue N,et al.Cardiovascular protective effects of n-3 polyunsaturated fatty acids with special emphasis on docosahexaenoic acid[J].JPharmacol Sci,2003,92(4):308-316.
Effect and mechanism study of Docosahexaenoic Acid for vascular smooth muscle cells proliferation and m igration induced by IL-1β
TUO Buxiong LIChaomin YEMingxia LIUWei LIHui▲
Department of Cardiology,the 451st Hospital of PLA,Shaanxi Province,Xi′an 710054,China
Objective To study the effect and mechanism study of Docosahexaenoic Acid(DHA)for vascular smooth muscle cells(VSMC)proliferation and migration induced by interleukin(IL-1β).Methods Subcultured VSMCswere divided into four groups:control group,DHA group,IL-1βgroup and IL-1βcombined with DHA group.Cells were cocultured with 50μL PBS in control group,with 10 ng/mL IL-1βin IL-1βgroup,with 80μmol/L DHA in DHA group,with 10 ng/mL IL-1βand 80μmol/L DHA in IL-1βcombined with DHA group for 48 h.MTT and Transwell methodswere used to detect VSMCs proliferation andmigration.qRT-PCR and Western blottingmethodswere used to measure the expression ofmatrixmetalloproteinase(MMP)-2,MMP-9,tissue inhibitor ofmetalloproteinase(TIMP)-1, TIMP-2 and Notch3.Results The proliferation and migration of VSMCs significantly increased in IL-1βgroup,while the proliferation andmigration ability of VSMCs significantly decreased compared with IL-1βgroup(F=25.537,P=0.003). In IL-1βgroup,the expression of MMP-2,MMP-9,TIMP-1 and TIMP-2 significantly increased(P<0.05),whereas the expression of MMP-2,MMP-9,TIMP-1 and TIMP-2 in IL-1βcombined with DHA group significantly decreased compared with IL-1βgroup(MMP-2:F=34.286,P=0.000;TIMP-2:F=21.034,P=0.009;MMP-9:F=31.732,P=0.000; TIMP-1:F=18.213,P=0.021).The expression of Notch3 in IL-1βgroup was significantly lower,while in the IL-1β combined with DHA group the expression of Notch3 was significantly higher than that in the IL-1βgroup(F=39.235, P=0.000).Conclusion DHA can inhibit VSMCs proliferation and migration through the Notch signaling pathway.
Docosahexaenoic Acid;IL-1β;MMP-2;MMP-9;TIMP-1;TIMP-2;Notch3
R544.1
A
1673-7210(2014)09(c)-0021-05
2014-05-25本文編輯:衛軻)
▲通訊作者

