腫瘤干細胞相關信號轉導途徑與鱗狀細胞癌的研究進展
夏 珊,趙梓綱,解 方,賀 晶
Makino等最早提出腫瘤干細胞(cancer stem cells,CSCs)的假說,推測腫瘤產生可能是由于CSCs導致[1]。1997年Bonnet等首次實驗證實急性髓細胞白血病患者體內含有CSCs。隨后各項研究證實了CSCs存在于腫瘤實體中,與干細胞相似,具有以下特性:(1)失控的自我更新能力,CSCs能夠無限地分裂產生與自身相同的子細胞,并有自我更新的能力,維持腫瘤細胞的生長;(2)高致瘤性,核型分析或畸胎瘤實驗等表明,CSCs的致瘤性高于一般干細胞或其他細胞;(3)多向分化特性,CSCs在特定條件下能夠誘導分化成為異質性子代瘤細胞,從而形成新的腫瘤;(4)化療過程的耐藥性,CSCs能夠表達ABC家族膜轉運蛋白,該蛋白能夠將機體代謝產物、藥物、毒性物質等排出細胞外,從而致使機體對許多化療藥物產生多重耐藥性。腫瘤中CSCs數量很少,比例不足5%,但其對腫瘤的存活、增殖、轉移、復發和化療耐藥性有著重要作用,是腫瘤細胞群生命力的支柱[2-3]。近年來,很多對CSCs的研究結果表明,CSCs的相關信號轉導途徑(如Wnt/β-catenin、JAK-STATs、Hh、PIP3等)對鱗狀細胞癌的發生和發展有著重要影響[4-6]。本文主要對影響鱗狀細胞癌發生、發展的CSCs內信號轉導途徑進行闡述,以期為鱗狀細胞癌的治療開辟新的途徑。
1 鱗癌干細胞
鱗狀細胞癌屬于皮膚表皮細胞的一種皮膚腫瘤,臨床被稱為皮樣癌[7]。在皮膚與結膜交界處多發,其中比較常見的有頭頸部鱗狀細胞癌和食管鱗狀細胞癌等。目前臨床和研究傾向于認為成體組織干細胞是CSCs的起源細胞,機制可能為:腫瘤細胞是正常細胞至少4~7次突變后累積導致的,一般情況下,正常細胞不會有這么長的壽命,而且不具有累計多次的突變,而干細胞很長的壽命以及累計的突變最終形成CSCs,進而生成腫瘤。腫瘤分化程度可能與腫瘤起源的干細胞的增殖分化階段也有關。目前研究提示,鱗狀細胞癌可能起源于鱗狀干細胞增殖分化過程的任何階段[8]。假如干細胞分化過程早期階段發生腫瘤,那么便呈現為低分化的特性;若起源于干細胞分化過程后期階段,則腫瘤呈現為高分化的特性;而良性腫瘤一般起源于干細胞分化鏈的晚期階段。干細胞分化成熟過程中的任何一個階段都可被阻斷,最終形成腫瘤分化程度各異性。目前研究者普遍認為,干細胞定居于一個特異性的微環境中,稱之為“壁龕(niche)”中。有研究發現,在原發性頭頸部鱗狀細胞癌中有類似情況的微環境,大多數CSCs在血管周圍一定范圍內,通過血管內皮細胞能夠分泌IL-6等相關因子,激活STAT3、ERK 和Akt等信號通路,使得腫瘤細胞遷移能力增強,同時CSCs受到保護[9]。CSCs進入細胞周期后,可轉變為成熟細胞,為維持干細胞池和產生有特定功能的子代細胞起到關鍵性的作用,而這一過程受到了Wnt,JAK-STATs和hedgehog等信號途徑的調控[10]。
2 Wnt信號轉導途徑
Wnt 蛋白是一種富含半胱氨酸的糖蛋白,其信號轉導途徑有兩種,包括經典途徑和非經典途徑,經典途徑決定細胞命運,非經典途徑控制細胞運動及組織極性[11]。當Wnt蛋白與Frizzled(FZD)家族跨膜蛋白受體和低密度脂蛋白受體關聯蛋白輔助性受體結合后,可激活Wnt/β-連環蛋白(β-catenin 信號通路),為Wnt經典信號轉導途徑。當FZD家族受體和ROR2/RYK聯合受體結合可以引發相關反應,激活Wnt非經典信號轉導途徑[12]。Wnt信號通路及其有關的其他通路在胚胎的早期發育、器官形成、組織再生等過程中發揮著重要作用,因此,Wnt 信號通路失調可導致多種惡性腫瘤的發生[13]。正常的成熟細胞β-catenin表達水平低,經典Wnt信號通路處于關閉狀態;而CSCs處于活化狀態時,β-catenin降解產生障礙,細胞質中游離β-catenin逐漸增多,可與TCF/LEF-1結合進入細胞核,進而激活下游靶基因c-myc、cyclin D1進行轉錄,從而致使腫瘤的發生和發展[14]。張衛民等[15]利用免疫組織化學方法研究Wnt-1、APC和β-catenin在口腔黏膜鱗狀細胞癌中的表達,初步揭示了Wnt信號傳導通路組成蛋白Wnt-1、APC和β-catenin在口腔鱗狀細胞癌分化和增殖中的作用。結果如表1所示,Wnt-1、APC和β-catenin在高分化鱗狀細胞癌細胞膜中呈高表達,而在中、低分化的鱗狀細胞癌細胞膜中表達較低,揭示了Wnt信號轉導途徑對鱗狀細胞癌的增殖和分化起著重要作用。
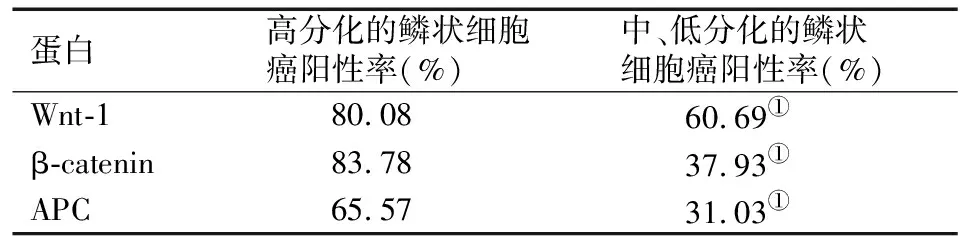
表1 Wnt信號轉導組成蛋白與鱗狀細胞癌增殖和分化的關系
相關研究證實Wnt信號通路可能與鱗狀細胞癌預后及放化療的敏感程度有密切關系。有研究者通過免疫組織化學檢測121例鱗狀細胞癌患者標本發現,Axin蛋白表達的量與食管癌浸潤深度呈負相關;單因素分析結果表明,食管癌預后相關不良因素與Axin蛋白表達水平降低有關[16]。現階段研究表明,WISP-1、WIF-1、DKK1等的異常表達可能是根治性術后食管癌患者不良預后指標。研究發現,食管癌細胞株順鉑敏感性與干擾素誘導跨膜蛋白-1(interferon induced transmembrane protein 1,IFITM1)有關,并且LEF-1和β-catenin的異常是導致食管癌細胞放療無效的重要因素[17]。
3 JAK-STATs信號轉導途徑
JAK-STATs通路是一條由細胞因子刺激的信號轉導通路,在細胞凋亡、增殖和分化過程中起著重要的調節作用,維持人類胚胎干細胞的自我更新[18-19]。最新報道,STATs 蛋白中某些亞型與腫瘤形成、發展高度相關[20]。
激活的STAT1屬于STATs 蛋白一類,能夠抑制細胞生長,介導細胞凋亡[21]。JAK-STAT1信號轉導途徑可在分子水平調節細胞的增殖和分化以及凋亡過程,在腫瘤發展過程中具有重要作用。對剔除STAT1基因小鼠的研究表明,細胞能夠在IFN-γ誘導下,通過使STAT1磷酸化而凋亡。鱗狀細胞癌由于下調了抗原呈遞機制,逃避細胞毒性T細胞的捕獲,而STAT1信號通路受到IFN-γ激活,從而使腫瘤細胞恢復對CTL的敏感性[22]。
Onishi等[23]應用免疫定位研究發現,JAK、Src信號和EGFR信號在鱗狀細胞癌中起著重要作用,其介導新生的上皮鈣黏著蛋白,誘導STAT3磷酸化,形成STAT3-Y705,促進上皮細胞的過度增殖和惡性轉化。此外,STAT3能激活Bcl-xl、Mcl-1、cyclin D1等抗凋亡基因,進而延長腫瘤細胞的生存周期。Boehm等[24]發現,在頭頸部鱗狀細胞癌中,Bcl-XL抗凋亡蛋白通過對細胞色素C的釋放的影響,進而影響細胞凋亡。
4 Hh信號轉導途徑
Hh基因編碼的一種高度保守的分泌性糖蛋白,具有3種不同亞型,分別編碼Shh、Ihh和Dhh蛋白。而跨膜蛋白PTCH1為Hh受體[25]。PTCH1負調控Hh途徑,與配體結合可抑制受體活性。Hh缺乏時,PTCH1與SMO結合,抑制SMO活性;存在Hh信號時,Hh與PTCH1結合,SMO釋放至胞漿中,作用于轉錄因子GlI,影響細胞增殖;而HHIP和SUFU復合體為該通路的抑制環節[26]。
研究發現,Hh信號通路中的一些蛋白或下游信號,如BMI1陽性和GlI-1陽性等與鱗狀細胞癌患者經新輔助放射化療后的早期復發及預后不良的相關性顯著,其平均DFS和OS等均有顯著性差異,提示Hh通路的激活參與惡性腫瘤CRT后的再生和發展[27]。Zhu等[28]分別檢測100例新輔助放化療鱗狀細胞癌活檢標本的PTCH1和GLI-1,結果發現大部分標本中PTCH1和GLI-1表達量有了很大的升高,二者表達水平與腫瘤大小,局部進展和腫瘤對放化療反應程度具有顯著相關性。單因素分析結果表明,PTCH1和GLI-1高表達與腫瘤局部復發快、DFS和OS差異有很大的關系。
5 其他信號轉導途徑以及交叉作用
鱗狀細胞癌最常見遺傳病變機制是EGFR過表達和p53基因突變,Notch信號通路參與上述兩者的負調控,且影響Wnt通路,并受到Wnt通路的影響[29]。Isohata等指出,大多數鱗狀細胞癌共表達EMT信號和Hh信號基因,首次提出EMT和Hh信號相互交叉的作用。PTK6具有使GSK3和Akt磷酸化程度降低的能力,進而激活β-catenin蛋白。TE-10細胞系和TE-1細胞系體外研究證實,PIP3途徑在N-Shh、Gβγ及表皮生長因子的刺激下,能夠在Hh信號轉導通路中發揮重大作用;MAPK和PIP3協同作用,可使Shh通路促進鱗狀癌細胞存活、增殖。He等[30]還發現,Wnt信號通路可被Hh通路經sFRP-1作用而抑制。
【參考文獻】
[1] Yu Z,Pestell TG,Lisanti MP,et al.Cancer stem cells[J].The International Journal of Biochemistry & Cell Biology,2012,44(12):2144-2151.
[2] Liu C,Kelnar K,Liu B,et al.The microRNA miR-34a inhibits prostate cancer stem cells and metastasis by directly repressing CD44[J].Nature Medicine,2011,17(2):211-215.
[3] Ito T,Zimdahl B,Reya T.aSIRTing control over cancer stem cells[J].Cancer Cell,2012,21(2):140-142.
[4] Rosner M,Fabian ID.Squamous cell carcinoma[M]//Arun D,Singh MD,Bertil E.Clinical Ophthalmic Oncology.[S.l.]:Springer Berlin Heidelberg,2014:43-51.
[5] Stransky N,Egloff AM,Tward AD,et al.The mutational landscape of head and neck squamous cell carcinoma[J].Science,2011,333(6046):1157-1160.
[6] Clark CA,McEachern MD,Shah SH,et al.Curcumin inhibits carcinogen and nicotine-induced mammalian target of rapamycin pathway activation in head and neck squamous cell carcinoma[J].Cancer Prevention Research,2010,3(12):1586-1595.
[7] Lo WL,Yu CC,Chiou GY,et al.MicroRNA-200c attenuates tumor growth and metastasis of presumptive head and neck squamous cell carcinoma stem cells[J].The Journal of Pathology,2011,223(4):482-495.
[8] Clay MR,Tabor M,Owen JH,et al.Single-marker identification of head and neck squamous cell carcinoma cancer stem cells with aldehyde dehydrogenase[J].Head & Neck,2010,32(9):1195-1201.
[9] Marijuán PC,del Moral R,Navarro J.On eukaryotic intelligence:signaling system's guidance in the evolution of multicellular organization[J].Biosystems,2013,114(1):8-24.
[10] Gorissen M,de Vrieze E,Flik G,et al.STAT genes display diffe-rential evolutionary rates that correlate with their roles in the endocrine and immune system[J].Journal of Endocrinology,2011,209(2):175-184.
[11] Holland JD,Klaus A,Garratt AN,et al.Wnt signaling in stem and cancer stem cells[J].Current Opinion In Cell Biology,2013,25(2):254-264.
[12] Biddle A,Liang X,Gammon L,et al.Cancer stem cells in squamous cell carcinoma switch between two distinct phenotypes that are preferentially migratory or proliferative[J].Cancer Research,2011,71(15):5317-5326.
[13] Takebe N,Harris PJ,Warren RQ,et al.Targeting cancer stem cells by inhibiting Wnt,Notch,and Hedgehog pathways[J].Nature Reviews Clinical Oncology,2011,8(2):97-106.
[14] Wend P,Loddenkemper C,Brinkmann V,et al.Wnt/β-catenin activity is essential to turn the epigenetic state to “ON” in salivary gland stem cells to create cancer stem cells[J].Journal of Stem Cells & Regenerative Medicine,2010,6(2):134.
[15] 張衛民,高巖.Wnt 信號傳導通路組成蛋白與口腔鱗狀細胞癌的分化和增殖[J].中華口腔醫學雜志,2005,40(6):491-494.
[16] 沐雨,李蘇宜.腫瘤干細胞相關信號通路與食管鱗癌的研究進展[J].世界華人消化雜志,2013,21(5):373-380.
[17] 荊薇,張曄,劉云鵬,等.ERK 通路對胃癌細胞順鉑敏感性的調節作用[J].世界華人消化雜志,2009,17(28):2931-2935.
[18] Klampfer L.Signal transducers and activators of transcription(STATs):novel targets of chemopreventive and chemotherapeutic drugs[J].Current Cancer Drug Targets,2006,6(2):107-121.
[19] Lo HW,Hsu SC,Ali-Seyed M,et al.Nuclear interaction of EGFR and STAT3 in the activation of the iNOS/NO pathway[J].Cancer Cell,2005,7(6):575-589.
[20] Yao X,Zhu F,Zhao Z,et al.Arctigenin enhances chemosensitivity of cancer cells to cisplatin through inhibition of the STAT3 signaling pathway[J].Journal of Cellular Biochemistry,2011,112(10):2837-2849.
[21] Demyanets S,Kaun C,Rychli K,et al.Oncostatin M-enhanced vascular endothelial growth factor expression in human vascular smooth muscle cells involves PI3K-,p38 MAPK-,Erk1/2-and STAT1/STAT3-dependent pathways and is attenuated by interferon-γ[J].Basic Research In Cardiology,2011,106(2):217-231.
[22] Leibowitz MS,Andrade Filho PA,Ferrone S,et al.Deficiency of activated STAT1 in head and neck cancer cells mediates TAP1-dependent escape from cytotoxic T lymphocytes[J].Cancer Immunology Immunotherapy,2011,60(4):525-535.
[23] Onishi A,Chen Q,Humtsoe JO,et al.STAT3 signaling is induced by intercellular adhesion in squamous cell carcinoma cells[J].Experimental Cell Research,2008,314(2):377-386.
[24] Boehm AL,Sen M,Seethala R,et al.Combined targeting of epidermal growth factor receptor,signal transducer and activator of transcription-3,and Bcl-XL enhances antitumor effects in squamous cell carcinoma of the head and neck[J].Molecular Pharmacology,2008,73(6):1632-1642.
[25] Chiou SH,Yu CC,Huang CY,et al.Positive correlations of Oct-4 and Nanog in oral cancer stem-like cells and high-grade oral squamous cell carcinoma[J].Clinical Cancer Research,2008,14(13):4085-4095.
[26] Chen YC,Chen YW,Hsu HS,et al.Aldehyde dehydrogenase 1 is a putative marker for cancer stem cells in head and neck squamous cancer[J].Biochemical And biophysical Research Communications,2009,385(3):307-313.
[27] 朱振龍,楊艷紅,張鈺,等.食管鱗狀細胞癌中 PINCH 蛋白的表達及意義[J].腫瘤防治研究,2006,33(8):555-557.
[28] Zhu W,You Z,Li T,et al.Correlation of hedgehog signal activation with chemoradiotherapy sensitivity and survival in esophageal squamous cell carcinomas[J].Japanese Journal of Clinical Oncology,2011,41(3):386-393.
[29] 馬沛卿,薛麗燕,謝永強,等.早幼粒細胞白血病蛋白在食管鱗狀細胞癌及癌前病變中的表達與臨床意義[J].國際腫瘤學雜志,2011,38(6):471-475.
[30] He J,Sheng T,Stelter AA,et al.Suppressing Wnt signaling by the hedgehog pathway through sFRP-1[J].Journal of Biological Chemistry,2006,281(47):35598-35602.

