霧化吸入小劑量右美托咪定對大鼠單肺通氣炎性反應的影響
朱小兵 劉志群 吳論
研究表明,單肺通氣可誘發炎性反應[1]。大劑量右美托咪定靜脈注射可減輕肺部炎性反應[2,3],但是其可導致高血壓或心動過緩。霧化吸入給藥可使藥物直接作用于細支氣管和肺泡表面,迅速發揮效應。本研究擬評價霧化吸入小劑量右美托咪定對大鼠單肺通氣炎癥反應的影響。
1 材料與方法
1.1 動物選擇與分組 健康雄性Wistar大鼠36只,體重300~350 g,采用隨機數字表法分為3組(n=12):對照組(C組)、靜脈輸注右美托咪定組(V組)和霧化吸入右美托咪定組(I組)。每組12只。
1.2 大鼠單肺通氣模型的建立 參照文獻[4]采用的方法采用大潮氣(V=20 ml/kg,50次/min)單肺通氣2 h建立右肺單肺通氣大鼠模型。實驗室溫度為25℃,大鼠實驗前禁食12 h,自由進水。腹腔注射3%戊巴比妥50 mg/kg麻醉下,股靜脈穿刺置管,注射肝素400 U/kg后,輸注林格氏液20 ml·kg-1·h-1,股動脈穿刺置管監測脈搏和有創血壓,體表血氧探頭檢測血氧飽和度。沿頸部正中縱向切開,暴露氣管,于第1環狀軟骨下緣氣管切開,置入氣管導管(自制)約2 cm,將大鼠置于右側臥位。于左側胸第五肋間開胸,去除第五肋部分肋骨,暴露肺葉。于暴露肺葉后將氣管導管推進至3.0~4.0 cm處,使導管進入右側支氣管,給予維庫溴銨2 mg/kg,接呼吸機(江灣型微型動物呼吸機),機械通氣,VT=20ml/kg,RR=50次/min,I:E=1:1,PEEP=0,FiO2=100%,可見左側肺葉不張,開始計時,機械通氣2.5 h,復張時將氣管導管退回至2 cm處,調節VT至10 ml/kg,RR 60次/min,約5 min后肺復張較好。其OLV過程有時有少量漏氣,可觀察到非通氣側肺有點狀通氣,如漏氣較嚴重時需要對導管稍作調整。術中維持血壓在80/60~140/110mm Hg(1 mm Hg=0.133 kPa),血氧飽和度維持在98%~100%,心率200~400次/min。
1.3 分組處理 單肺通氣前10 min,C組靜脈注射0.9%氯化鈉溶液4 ml;V組經10 min靜脈輸注右美托咪定6 μg·kg-1·h-1(用0.9%氯化鈉溶液稀釋至4 ml);I組采用自制裝置氧氣驅動經10 min霧化吸入右美托咪定0.1 μg/kg+0.9%氯化鈉溶液4 ml,氧流量為2~4 L/min。
1.4 觀察指標 于給藥前(T0)、單肺通氣120 min(T1)、和恢復雙肺通氣30 min(T2)時,采集動脈血樣,采用雙抗體夾心ELISA法測定血漿腫瘤壞死因子α(TNF-α)、白介素-6(IL-6)和白介素-10(IL-10)的濃度,于T3時處死大鼠,取左肺組織,4℃0.9%氯化鈉溶液沖洗,濾紙吸干表面的水分,稱濕重(W),然后放入80℃電熱恒溫干燥箱烘干,24 h后稱干重(D),計算肺組織W/D比。取右肺置于4%多聚甲醛中固定48 h,脫水后石蠟包埋,制成厚6 μm的連續切片,取3張相鄰的切片,分別進行HE染色光鏡(Olympus,日本)下觀察肺組織病理學結果。
1.5 統計學分析 應用SPSS 13.0統計軟件,計量資料以±s表示,組內比較采用重復測量方差分析,組間比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 病理 光鏡下可見C組肺泡壁增厚、斷裂,肺泡融合成片狀,肺泡擘和肺問質大量炎性細胞浸潤,彌漫性的充血水腫伴有片狀出血壞死灶,肺泡腔內有滲出物(并有血性滲出物)。I組和V組可見少量肺泡壁和肺問質輕微增厚,少量炎性細胞和紅細胞浸潤。見圖1。
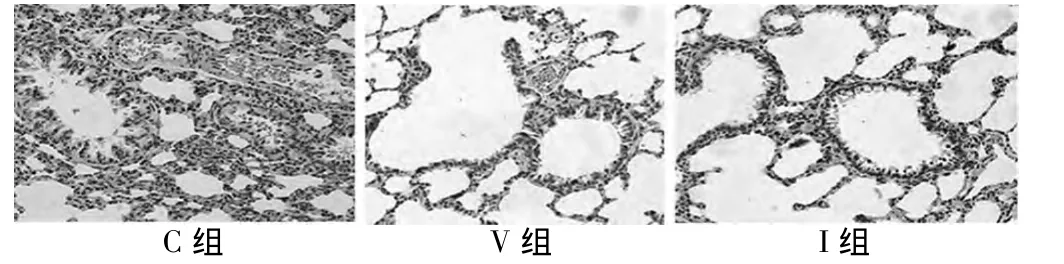
圖1 3組大鼠肺組織染色比較(HE×400)
2.2 3組觀察指標比較 與T0比較,3組T1和T2時血漿和肺組織TNF-α、IL-6、IL-10的濃度或含量升高(P<0.05);與C組比較,V組和I組血漿和肺組織T1、T2時TNF-α、IL-6的濃度或含量降低,IL-10升高,W/D比降低(P<0.05);V組和I組各時點血漿和肺組織TNF-α、IL-6和IL-10的濃度或含量、W/D比差異無統計學意義(P>0.05)。見表1~3。
表1 3組大鼠血漿TNF-α、IL-6及IL-10濃度比較n=12,±s
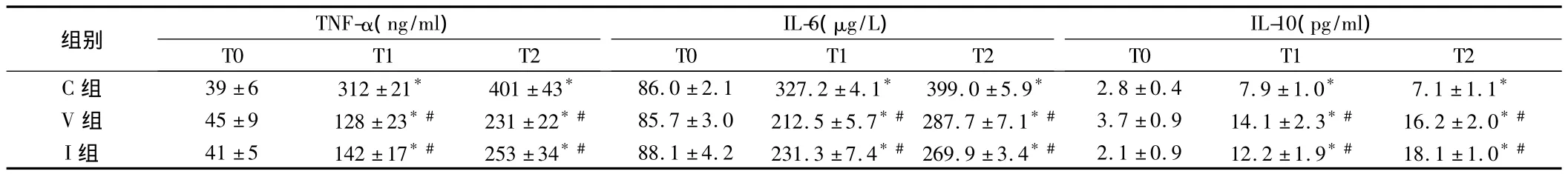
表1 3組大鼠血漿TNF-α、IL-6及IL-10濃度比較n=12,±s
注:與T0比較,*P<0.05;與C組比較,#P<0.05
組別TNF-α(ng/ml)IL-6(μg/L)IL-10(pg/ml)T0T1T2 C組39±6312±21*401±43*86.0±2.1327.2±4.1*399.0±5.9*2.8±0.47.9±1.0*7.1±1.1 T0T1T2T0T1T2*V組45±9128±23*#231±22*#85.7±3.0212.5±5.7*#287.7±7.1*#3.7±0.914.1±2.3*#16.2±2.0*#I組41±5142±17*#253±34*#88.1±4.2231.3±7.4*#269.9±3.4*#2.1±0.912.2±1.9*#18.1±1.0*#
表2 3組大鼠肺組織TNF-α、IL-6及IL-10含量比較n=12,±s
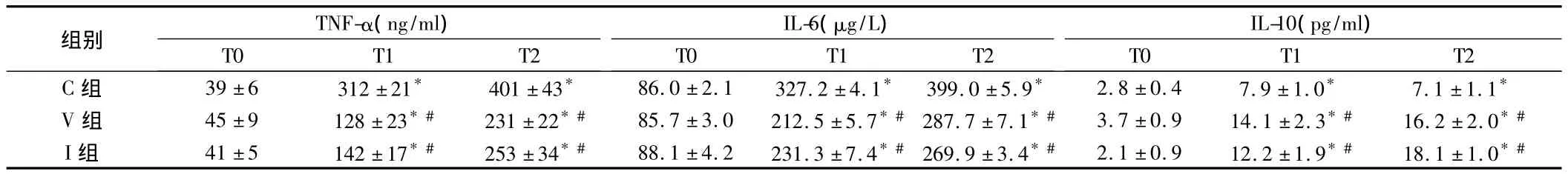
表2 3組大鼠肺組織TNF-α、IL-6及IL-10含量比較n=12,±s
注:與T0比較,*P<0.05;與C組比較,#P<0.05
組別TNF-α(ng/ml)IL-6(μg/L)IL-10(pg/ml)T0T1T2 C組39±6312±21*401±43*86.0±2.1327.2±4.1*399.0±5.9*2.8±0.47.9±1.0*7.1±1.1 T0T1T2T0T1T2*V組45±9128±23*#231±22*#85.7±3.0212.5±5.7*#287.7±7.1*#3.7±0.914.1±2.3*#16.2±2.0*#I組41±5142±17*#253±34*#88.1±4.2231.3±7.4*#269.9±3.4*#2.1±0.912.2±1.9*#18.1±1.0*#
3 討論
本研究參照文獻[4]制作單肺通氣大鼠模型,病理結果顯示C組肺泡壁增厚、斷裂,肺泡融合成片狀,肺泡擘和肺間質大量炎性細胞浸潤,彌漫性的充血水腫伴有片狀出血壞死灶,肺泡腔內有滲出物(并有血性滲出物),I組和V組可見少量肺泡壁和肺問質輕微增厚,少量炎性細胞和紅細胞浸潤,提示本實驗單肺通氣模型制作成功。
表3 3組大鼠肺組織W/D比的比較n=12,±s

表3 3組大鼠肺組織W/D比的比較n=12,±s
注:與C組比較,*P<0.05
組別W/D比5.1±0.19 V組3.9±0.26*I組4.0±0.22 C組*
促炎因子TNF-α和IL-6被認為是前炎性介質,具有觸發進一步炎性反應的作用;IL-10作為抗炎因子,可抑制促炎細胞因子的表達。本研究參照文獻[2]和預實驗結果選擇右美托咪定靜脈輸注劑量和霧化吸入給藥劑量和時間,結果顯示,與T0比較,各組T1和T2時血漿TNF-α、IL-6、IL-10的濃度升高,提示單肺通氣可導致大鼠炎性反應;與C組比較,V組T1、T2時血漿TNF-α、IL-6的濃度降低,IL-10濃度升高,W/D比降低,提示靜脈輸注大劑量右美托咪定可抑制大鼠單肺通氣導致炎癥反應,結果與文獻[5,6]報道一致。
本研究結果表明,霧化吸入右美托咪定0.1 μg/kg后,與C組比較,I組T1和T2時血漿TNF-α、IL-6的濃度降低,IL-10濃度升高,W/D比降低,且V組和I組各時點血漿TNF-α、IL-6和IL-10的濃度、W/D比差異無統計學意義,霧化吸入小劑量右美托咪定亦可抑制大鼠單肺通氣導致炎性反應,且與靜脈輸注大劑量右美托咪定效果相似。這可能與氧氣驅動霧化吸入法,形成霧粒體積很小,易使藥物直接作用于細支氣管及肺泡表面,從而迅速發揮作用有關。
綜上所述,霧化吸入小劑量右美托咪定可抑制單肺通氣大鼠導致的炎癥反應,與靜脈注射大劑量右美托咪定效果相似。
1 Bastin AJ,Sato H,Davidson SJ,et al.Biomarkers of lung injury after onelung ventilation for lung resection.Respirology,2011,16:138-145.
2 忽新剛,阮祥才,于霖,等.鹽酸右旋美托咪啶對呼吸機所致肺損傷大鼠ERK1/2激活的影響.南方醫科大學學報,2011,31:1252-1555.
3 Yang CH,Tsai PS,Wang TY,et al.Dexmedetomidine-ketamine combination mitigates acute lung injury in haemorrhagic shock rats.Resuscitation,2009,80:1204-1210.
4 Tekinbas C,Ulusoy H,Yulug E,et al.One-lung ventilation:for how long?J Thorac Cardiovasc Surg,2007,134:405-410.
5 Yang CL,Tsai PS,Huang CJ.Effects of dexmedetomidine on regulating pulmonary inflammation in a rat model of ventilator-induced lung injury.Acta Anaesthesiol Taiwan,2008,46:151-159.
6 Yang CL,Chen CH,Tsai PS,et al.Protective effects of dexmedetomidine ketamine combination against ventilator-induced lung injury in endotoxemia rats.J Surg Res,2011,167:273-281.

