小兒牛黃清心散對幼年大鼠驚厥性腦損傷的保護作用
李文娟, 蔣 莉, 陳恒勝, 陳小璐
(重慶醫科大學附屬兒童醫院 兒童發育疾病研究省部共建教育部重點實驗室 兒科學重慶市重點實驗室 重慶市兒童發育重大疾病診治與預防國際科技合作基地,重慶 400014)
小兒牛黃清心散對幼年大鼠驚厥性腦損傷的保護作用
李文娟, 蔣 莉*, 陳恒勝, 陳小璐
(重慶醫科大學附屬兒童醫院 兒童發育疾病研究省部共建教育部重點實驗室 兒科學重慶市重點實驗室 重慶市兒童發育重大疾病診治與預防國際科技合作基地,重慶 400014)
目的 研究小兒牛黃清心散對幼年大鼠驚厥性腦損傷的保護作用。 方法 21 日齡 SD大鼠按隨機數字表法分為5組:正常對照組,模型對照組,小兒牛黃清心散高、中、低劑量組。除正常對照組外,各組分別給予生理鹽水、小兒牛黃清心散灌胃, 給藥 1 d 后, 給予戊四唑 (70mg/kg) 腹腔注射, 定時取腦組織標本行病理檢查、 免疫組化檢測IL-1β和膠質纖維性蛋白 (GFAP) 在腦組織中的表達及采用 TUNEL染色法檢測大腦皮層和海馬 CA1 神經元的凋亡情況。 結果 小兒牛黃清心散高劑量組中各時間點大腦皮層和海馬 IL-1β和 GFAP表達、 凋亡指數較模型對照組顯著減少,與正常對照組比較無顯著差異;小兒牛黃清心散中劑量組上述各指標均較模型對照組減少,但仍高于正常對照組;小兒牛黃清心散低劑量組與模型對照組比較無顯著差異。結論 小兒牛黃清心散可呈劑量依賴性對由戊四唑引起的驚厥性幼鼠腦損傷起保護作用。
小兒牛黃清心散;戊四唑;驚厥;腦損傷;腦保護;幼年大鼠
驚厥是小兒時期最常見的神經系統急癥,在兒童中的發生率高達 3% ~5%, 且與成人相比, 小兒驚厥更易出現嚴重驚厥和驚厥持續狀態 ( status convulsion, SC)[1]。既往研究 證實, SC可造成腦損傷,出現皮層及海馬神經元凋亡,神經元缺失,膠質疤痕形成及苔蘚纖維樣變。近年眾多研究表明, 免疫系統也參與腦損傷的病理過程[2]。 IL-1β作為一種炎癥介質參與驚厥性腦損傷的啟動過程[3],不僅介導驚厥持續狀態后神經元壞死的發生[4], 還可通過 IL-1R/IκB/NFκB信號通路介導星形膠質細胞 ( Astrocyte, Ast)增生活化[5]。 膠質 纖 維 性 蛋 白 ( glial fibriliary acidic protein,GFAP)是 Ast特有的細胞骨架蛋白, GFAP是反映星形膠質細胞狀態的有效指標[6], 中樞神經系統受損時 Ast會發生反應性增生, GFAP表達上調。
小兒牛黃清心散是我國著名的中成藥之一,主要是由天麻、膽南星等十四味中藥配伍而成。前期研究表明,小兒牛黃清心散有劑量依賴性的預防大鼠驚厥的作用,但其對驚厥性腦損傷是否有保護作用,目前尚不清楚。本實驗通過檢測小兒牛黃清心散先干預再予戊四唑腹腔注射后不同時間點各組幼鼠大腦組織中皮層及海馬神經元凋亡及 IL-1β、 GFAP表達動態變化的情況, 旨在探討小兒牛黃清心散對驚厥幼鼠神經元的保護作用及相關機制。
1 材料與方法
1.1 實驗動物 健康 SPF級 21 日齡 SD大鼠 240只, 雌雄各半, 體質量 (45 ±5) g, 由重慶醫科大學 動 物 實 驗 中 心 提 供。 動 物 許 可 證 號 syxk(渝) 20040001。
1.2 主要試劑及器材 小兒牛黃清心散 (山東方健制藥有限公司提供, 國藥準字 Z37020495); 戊四唑 ( pentylenetetrazole,PTZ, 美國 Sigma公司);IL-1β抗體 ( Santacruze公司) ; GFAP抗體 ( 美國Sigma公司); 組化試劑盒 ( 北京 中杉金橋公司)TUNEL試劑盒 (美國 Roche公司); BX-51 熒光顯微鏡及成像系統 (日本 Olympus公司)。
1.3 動物分組及模型制備 21 日齡 SD大鼠按隨機數字表法分為5組:正常對照組,模型對照組,小兒牛黃清心散高、中、低劑量組。各組分別給予生理鹽水 2 mL, 小兒牛黃 清 心 散 16、 8、 0.3 g/(kg·d)分早晚 2 次灌胃, 給藥 1 d, 灌胃結束后 30 min, 給 予戊四唑 ( 70 mg/kg) 腹 腔 注 射,在戊四唑注射后 4 h、 12 h、 24 h、 48 h、 72 h、 7 d時間點, 留取腦組織標本 (每個時間點8只, 若有死亡者補充至8只)。
1.4 尼氏染色觀察各組腦組織的病理變化 各組腦組織各時間點切片行尼氏染色,觀察皮層及海馬神經元壞死情況。
1.5 DNA原位末端標記法 (TUNEL法) 檢測胰腺組織細胞凋亡 按試劑盒說明書操作,腦組織細胞核中有棕黃色顆粒者為凋亡細胞,每張切片在400 倍高倍鏡下隨機選取 5 個視野,計算凋亡細胞數和細胞總數, 凋亡指數 (AI) = (凋亡細胞數/總細胞數) ×100%
1.6 腦組織中 GFAP和 IL-1β的表達 采用 SABC免疫組化染色法檢測。具體方法參照既往報道[7],以包漿中出現棕黃色顆粒細胞為 GFAP、 IL-1β陽性細胞。 使用 Olympus自動圖像采集系統, 每張切片在光學顯微鏡下以相同倍數 (400) 于腦組織皮層和海馬各區分別隨機計數5個不相重疊的高倍鏡視野, 應用 Image Pro Plus 5.0 專業圖像分析軟件對其測量累計光密度值 ( integrated opitical density,IOD) 進行圖像分析。
SPSS 17.0 軟件進行統計學處理,多個樣本均數比較采用方差分析, 以 SNK-q 檢驗進行均數間多重比較。
2 結果
2.1 各組大鼠腦組織病理變化 正常 SD大鼠神經元細胞核大而圓,呈淡藍色,中央有清楚核仁。模型對照組腦組織切片出現明顯神經元變性、 死亡, 以24 h最為顯著, 如圖 1所示,高倍鏡視野下海馬 CA1區和皮層中可見單個或散在的變性、壞死細胞,變性細胞腫脹,體積增大,胞核偏位,死亡的細胞核深染、核體積縮小,核溶解。高劑量干預組各時間點未見明顯壞死。中劑量干預組可見壞死神經元較模型對照組明顯減少;低劑量干預組可見壞死神經元與模型對照組無明顯差異。

圖 1 各組大鼠 24 h時間點腦組織中皮層及海馬神經元尼氏染色 ( ×200 倍)Fig.1 Nissl staning of neurons in cortex and hippocam pus of the brain tissues at time point of24 hours in each group( ×200)
2.2 各組大鼠腦組織中皮層及海馬神經元的凋亡情況 與正常對照組相應時間點相比,模型對照組大鼠的腦組織于 SC后12 h 時間點海馬CA1 區和皮層 TUNEL陽性細胞數開始顯著增加, 表現為有明顯的染色質聚集、胞質濃縮、細胞核皺縮、周圍空泡形成及單個圓形凋亡小體,并在 48 h達高峰(P<0.05)。 高劑量干預組各時間點海馬 CA1 區及皮層 TUNEL陽性細胞數與模型組各時間點比較,差異有統計學意義,與正常對照組比較,差異無統計學意義。 中劑量干預組中 12、 24、 48 h 各亞組TUNEL陽性細胞數均較模型組顯著下降 (P<0.05), 但仍顯著高于正常對照組 (P<0.05), 低劑量干預組與模型對照組比較,未見統計學差異。見表1 ~2, 圖 2 ~圖 3。
表1 各組各時間點皮層神經元凋亡指數情況 (%,)Tab.1 Apoptotic index of neurons in cortex at different time points in each group(%,)

表1 各組各時間點皮層神經元凋亡指數情況 (%,)Tab.1 Apoptotic index of neurons in cortex at different time points in each group(%,)
注: 與正常對照組比較,°P<0.05; 與模型對照組比較,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常對照組組別 動物數/只8 1.16 ±0.27 1.14 ±0.26 1.16 ±0.27 1.16 ±0.32 1.36 ±0.25 1.28 ±0.31模型對照組 8 1.18 ±0.29 8.73 ±1.35° 12.36 ±2.38° 43.05 ±3.21° 28.3 ±2.75° 6.3 ±0.80°高劑量干預組 8 1.19 ±0.21 1.31 ±0.23* 1.28 ±0.18* 1.18 ±0.15* 1.15 ±0.23* 1.16 ±0.19*中劑量干預組 8 1.17 ±0.32 5.21 ±0.54* 8.35 ±1.42* 22.3 ±2.62* 11.6 ±1.83* 3.94 ±0.62*低劑量干預組8 1.16 ±0.19 8.37 ±1.63 11.59 ±2.12 41.3 ±2.14 22.4 ±1.35 6.2 ±0.42
表2 各組各時間點海馬 CA1 區神經元凋亡指數情況 (%,)Tab.2 Apoptotic index of neurons in CA1 region of the hippocam pus at d ifferent time points in each group( %,)
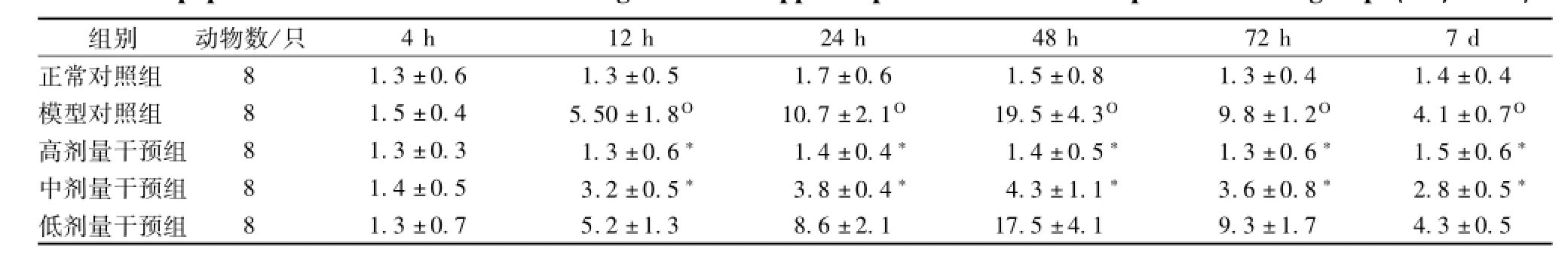
表2 各組各時間點海馬 CA1 區神經元凋亡指數情況 (%,)Tab.2 Apoptotic index of neurons in CA1 region of the hippocam pus at d ifferent time points in each group( %,)
注: 與正常對照組比較,°P<0.05; 與模型對照組比較,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常對照組1.3 ±0.6 1.3 ±0.5 1.7 ±0.6 1.5 ±0.8 1.3 ±0.4 1.4 ±0.4模型對照組 8 1.5 ±0.4 5.50 ±1.8° 10.7 ±2.1° 19.5 ±4.3° 9.8 ±1.2° 4.1 ±0.7°高劑量干預組 8 1.3 ±0.3 1.3 ±0.6* 1.4 ±0.4* 1.4 ±0.5* 1.3 ±0.6* 1.5 ±0.6*中劑量干預組 8 1.4 ±0.5 3.2 ±0.5* 3.8 ±0.4* 4.3 ±1.1* 3.6 ±0.8* 2.8 ±0.5*低劑量干預組8 1.3 ±0.7 5.2 ±1.3 8.6 ±2.1 17.5 ±4.1 9.3 ±1.7 4.3 ±0.5 8組別 動物數/只
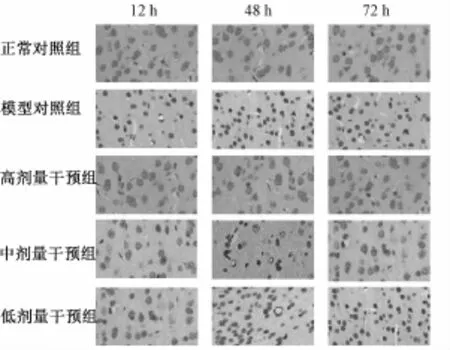
圖 2 各組各時間點皮層神經元凋亡情況 ( ×200 倍)Fig.2 Apoptotic neurodegeneration of neurons in cortex at different time points in each group( ×200)

圖 3 各組各時間點海馬 CA1 區神經元凋亡情況 ( ×200倍)Fig.3 Apoptotic neurodegeneration of neurons in the CA1 region of hippocampus at different time points in each group( ×200)
2.3 各組腦組織中 IL-1β、 GFAP的表達 免疫組化結果如表3~6所示。 結果顯示正常對照組皮層和海馬 CA1 區中 IL-1β的表達極弱, 模型對照組大鼠 IL-1β表達在 SC后 12 h 海馬 CA1 區 IL-1β陽性細胞增多, 以 24 h 最為顯著, 48 h 開始減少, IOD值也均有增高。高劑量干預組相應時間點與模型組相比, IOD差值有統計學意義 (P<0.05), 與正常對照組比較,未見統計學差異。中劑量干預組中12、 24、 48 h 組 IL-1β陽性細胞數均較模型組明顯減少,但仍高于正常對照組,差異有統計學意義(P<0.05);低劑量干預組與模型對照組比較,各時間點均無顯著差異 (P>0.05)。
表 3 各組大鼠不同時間點的皮層中 IL-1β的 IOD值變化的情況 ()Tab.3 Changes of IOD value of IL-1βin the cor tex at different time points in each group()

表 3 各組大鼠不同時間點的皮層中 IL-1β的 IOD值變化的情況 ()Tab.3 Changes of IOD value of IL-1βin the cor tex at different time points in each group()
注: 與正常對照組比較,°P<0.05; 與模型對照組比較,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常 對照 組 8 0.014 5 ±0.000 6 0.015 1 ±0.000 9 0.014 7 ±0.000 7 0.015 0 ±0.001 1 0.015 3 ±0.000 8 0.014 9 ±0.0組別 動物數/只01 2模型 對照 組 8 0.015 3 ±0.000 7 0.031 5 ±0.001 2°0.057 3 ±0.004 2°0.051 1 ±0.003 9°0.043 8 ±0.002 7°0.031 7 ±0.001 5°高劑 量干 預組 8 0.014 7 ±0.000 6 0.015 3 ±0.001 7*0.014 8 ±0.000 7*0.015 4 ±0.001 5*0.015 2 ±0.001 3*0.014 6 ±0.001 1*中劑 量干 預組 8 0.015 1 ±0.000 8 0.022 6 ±0.001 5*0.039 9 ±0.002 4*0.037 2 ±0.002 1*0.026 5 ±0.001 3*0.021 7 ±0.001 2*低劑 量干 預組 8 0.015 6 ±0.000 9 0.032 3 ±0.001 7 0.056 9 ±0.003 1 0.051 3 ±0.003 6 0.043 2 ±0.002 7 0.032 9 ±0.001 6
表 4 各組大鼠不同時間點海馬 CA1 區中 IL-1β的 IOD值變化的情況 ()Tab.4 Changes of IOD value of IL-1βin the CA1 region of the hippocam pus at different time points in each group()

表 4 各組大鼠不同時間點海馬 CA1 區中 IL-1β的 IOD值變化的情況 ()Tab.4 Changes of IOD value of IL-1βin the CA1 region of the hippocam pus at different time points in each group()
注: 與正常對照組比較,°P<0.05; 與模型對照組比較,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常 對照 組 8 0.015 2 ±0.001 7 0.015 7 ±0.000 9 0.016 1 ±0.000 7 0.014 8 ±0.001 2 0.015 6 ±0.000 8 0.015 4 ±0.組別 動物數/只001 1模型 對照 組 8 0.015 8 ±0.001 3 0.064 1 ±0.003 5°0.115 8 ±0.017 4°0.093 3 ±0.012 6°0.069 4 ±0.007 7°0.056 2 ±0.002 9°高劑 量干 預組 8 0.016 1 ±0.001 8 0.015 9 ±0.001 5*0.015 6 ±0.001 7*0.014 9 ±0.002 1*0.015 5 ±0.001 3*0.015 8 ±0.001 1*中劑 量干 預組 8 0.015 9 ±0.001 5 0.037 7 ±0.003 1*0.062 5 ±0.005 3*0.057 7 ±0.004 6*0.038 3 ±0.003 5*0.029 9 ±0.002 4*低劑 量干 預組 8 0.016 2 ±0.001 9 0.063 5 ±0.005 2 0.109 7 ±0.012 4 0.092 2 ±0.011 7 0.065 8 ±0.005 9 0.055 3 ±0.004 7
表 5 各組大鼠不同時間點皮層中 GFAP的 IOD值變化的情況 ()Tab.5 Changes of IOD value of GFAP in the cortex at different tim e points in each group()

表 5 各組大鼠不同時間點皮層中 GFAP的 IOD值變化的情況 ()Tab.5 Changes of IOD value of GFAP in the cortex at different tim e points in each group()
注: 與正常對照組比較,°P<0.05; 與模型對照組比較,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常 對照 組 8 0.241 3 ±0.009 2 0.241 5 ±0.008 6 0.241 8 ±0.008 3 0.242 0 ±0.007 9 0.242 3 ±0.006 5 0.238 6 ±0組別 動物數/只.007 5模型 對照 組 8 0.270 5 ±0.011 7°0.397 3 ±0.013 0°0.469 0 ±0.012 9°0.563 6 ±0.109 5°0.599 7 ±0.113 1°0.630 2 ±0.128 2°高劑 量干 預組 8 0.252 3 ±0.009 5*0.258 3 ±0.006 7*0.243 2 ±0.012 2*0.251 7 ±0.008 7*0.238 9 ±0.009 5*0.249 5 ±0.007 8*中劑 量干 預組 8 0.260 2 ±0.023 1*0.314 5 ±0.023 2*0.382 7 ±0.031 9*0.435 9 ±0.027 4*0.492 7 ±0.039 5*0.513 8 ±0.047 5*低劑 量干 預組 8 0.269 8 ±0.013 5 0.388 5 ±0.012 7 0.463 8 ±0.021 3 0.557 8 ±0.049 9 0.601 2 ±0.110 3 0.627 7 ±0.088 2
表 6 各組大鼠不同時間點海馬 CA1 區中的 GFAP的 IOD值變化的情況 ()Tab.6 Changes of IOD value of GFAP in the CA1 region of the hippocam pus at different time points in each group()

表 6 各組大鼠不同時間點海馬 CA1 區中的 GFAP的 IOD值變化的情況 ()Tab.6 Changes of IOD value of GFAP in the CA1 region of the hippocam pus at different time points in each group()
注: 與正常對照組比較,°P<0.05; 與模型對照組比較,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常 對照 組 8 0.213 9 ±0.008 7 0.218 7 ±0.013 8 0.215 8 ±0.013 1 0.231 6 ±0.075 0.227 1 ±0.006 3 0.226 3 ±0.組別 動物數/只012 1模型 對照 組 8 0.268 1 ±0.012 1°0.343 7 ±0.017 5°0.437 5 ±0.023 2°0.559 3 ±0.040 9°0.601 3 ±0.041 7°0.640 7 ±0.058 5°高劑 量干 預組 8 0.214 9 ±0.006 5*0.228 9 ±0.015 7*0.216 9 ±0.013 4*0.240 6 ±0.095*0.228 3 ±0.007 3*0.229 7 ±0.015 4*中劑 量干 預組 8 0.234 7 ±0.007 2*0.279 1 ±0.008 3*0.315 7 ±0.024 5*0.392 2 ±0.031 8*0.419 5 ±0.039 7*0.452 9 ±0.041 3*低劑 量干 預組 8 0.257 3 ±0.016 3 0.339 2 ±0.027 1 0.428 9 ±0.023 7 0.547 8 ±0.031 1 0.599 6 ±0.042 2 0.641 2 ±0.087 5
正常對照組皮層和海馬 CA1 區星型膠質細胞胞漿中 GFAP有少量表達, 模型對照組大鼠皮層和海馬 CA1 區在各時間點有不同程度的棕黃色陽性細胞表達, 其免疫反應累積光密度 (IOD) 值在驚厥后4 h開始稍有升高,后逐漸增高,7 d時間點最為明顯,與正常對照組對應時間點比較顯著增多(P<0.05)。 高劑量干預組相應時間點與模型組相比, IOD值顯著減少 (P<0.05), 與正常對照組比較無顯著差異 (P>0.05); 而中劑量干預組大鼠皮層及海馬 CA1 區 GFAP蛋白表達在各時間點較模型組均有下降 (P<0.05), 但仍高于正常對照組 (P<0.05); 低劑量干預組與模型對照組比較, 各時間點均無顯著差異 (P>0.05)。
3 討論
近年來, 有研究報道促炎因子如 IL-1β的激活可能 在 癇 性 發 生 中 起 著 重 要 作 用[8],脂 多 糖(LPS) 誘導的炎癥性反應會加重癲癎大鼠模型的癎性發生[9]。 IL-1β主要由腦內的膠質細胞, 血腦屏障的內皮細胞, 神經元, 淋巴細胞[10]通過自分泌和旁分泌的途徑產生, IL-1β既可通過引起中樞神經系統潛在的神經毒性分子如花生四烯酸及其代謝產物、一氧化氮等的釋放[11]而產生神經毒性作用, 使神經元凋亡并壞死, 還能夠通過 IL-1 受體和 toll樣受體系統的激活發揮作用[12], 刺激膠質細胞活化從而調節神經遞質,突觸傳遞,神經元的興奮性和自發放電的產生[13]。 因此,越來越多研究證實抗炎治療可能是治療癲癎的靶點之一[14]。
小兒牛黃清心散是我國著名的中成藥之一,主要是由天麻、膽南星、黃連、赤芍、大黃、全蝎、水牛角濃縮粉、 僵蠶 (麩炒)、 牛黃、 琥珀、 雄黃、冰片、朱砂、金礞石 (煅)這十四味中藥組合而成。 研究表明, 其成分中含有的牛黃[15]、 大黃[16]等有抗炎的作用。因此,推測小兒牛黃清心散可能通過抗炎機制發揮腦保護的生物學作用。
本研究發現模型對照組大鼠在 SC后12 h 海馬CA1 區及皮層 IL-1β的表達開始明顯增多, 24 h 最為顯著, 48 h開始減少, 7 d 下降, 但未至正常,同時該組大鼠皮層和海馬神經元在驚厥發作后12 h時開始凋亡率增高、 壞死增加, 這說明 IL-1β可能參與了驚厥性腦損傷的啟動的過程, GFAP的表達從4 h開始增多,余時間點均持續性增高,這與文獻報道[7]相符。 而 48 h ~7 d 時間點時 IL-1β的表達下調,提示可能與膠質細胞在增生后期的分泌功能下降有關。
在給予小兒牛黃清心散干預后,發現各相同時間點的高劑量小兒牛黃清心散干預組大鼠大腦皮層和海馬病理形態較好,凋亡和壞死的發生顯著減少, IL-1β及 GFAP的表達明顯下降, 與正常對照組未見明顯差異;而中劑量小兒牛黃清心散干預組的大鼠的大腦皮層和海馬壞死及凋亡減輕, IL-1β及 GFAP的表達減少但未至正常; 低劑量干預組與模型對照組的腦組織病理變化相似。提示高劑量的小兒牛黃清心散可有效減少驚厥性腦損傷,中劑量的小兒牛黃清心散可減輕幼年大鼠的驚厥性腦損傷,而低劑量的小兒牛黃清心散對驚厥性腦損傷并無顯著保護作用。
因此, 小兒牛黃清心散可能通 過下調 IL-1β,減少大腦皮層和海馬神經元壞死凋亡,抑制膠質細胞活化產生的下游損傷通路,發揮腦保護作用。在后續實驗中,將進一步闡明其中的可能機制。
[ 1 ] Haut SR, Velísková J, MoshéS L.Susceptibility of immature and adult brains to seizure effects[ J] .Lancet Neurol, 2004,3(10): 608-617.
[ 2 ] Holopainen IE.Seizures in the developing brain : celluar and molecular mechanisms of neuronal damage, neurogenisis and cellular reorganization [ J] .Neuro Chem Int, 2008, 52 (6 ):935-947.
[ 3 ] Patel H C, Ross FM, Heenan L E, et al.Neurodegenerative actions of interleukin-l in the rat brain aremediated through increasesin seizure activity[ J] .JNeurosci Res, 2006, 83( 3 ):385-391.
[ 4 ] Allan SM, Tyrrell P J, Rothwell N J.Interleukin-1 and neuronal injury[J] .Nat Rev Immunol, 2005, 5(8) : 629-640.
[ 5 ] Moynagh P N.Interleukin-1 signalling in astrocytes, a key contributor to inflammation in the brain [ J] .J Anat, 2005, 207(3): 265-269.
[ 6 ] Martinian L, Boer K, Middeldorp J, etal.Expression patterns of glial fibrillary acidic protein (GFAP) -delta in epilepsy-associated lesional pathologies[ J].Neuropathol Appl Neurobiol,2009, 35(4): 394-405.
[ 7 ] Ravizza T, RizziM, Perego C.Inflammatory response and glia activation in developing rat hippocampus after status epilepticus[ J] .Epilepsia, 2005, 46(5) : 113-117.
[ 8 ] Ravizza T, Balosso S, Vezzani A.Inflammation and prevention of epileptogenesis[ J] .Neurosci Lett, 2011, 497 ( 3 ):223-230.
[ 9 ] Auvin S, Mazarati A, Shin D, et al.Inflammation enhances epileptogenesis in the developing rat brain[ J] .Neurobiol Dis,2010, 40(1): 303-310.
[10 ] Vezzani A, Baram T Z.New roles for interlukin-1beta in the mechanisms of epilepsy[ J].Epilepsy Cur, 2007, 7 ( 2 ):45-50.
[11 ] Patel H C, Boutin H, Allan SM.Interleukin-1 in the brain:mechanisms of action in acute neurodegeneration[ J].Ann N Y Acad Sci, 2003, 992: 39-47.
[12 ] Devinsky O, VezzaniA, Najjar S , etal.Glia and epilepsy:excitability and inflamation [ J] .Trends Neurosci, 2013, 36(3): 174-184.
[13 ] Clasadonet J, Haydon PG.Astrocytes and epilepsy[ J] .Epilepsia , 2010, 51( Suppl5) : 53.
[14 ] Pitk?nen A, Lukasiuk K.Mechanisms of epileptogenesis and potential treatment targets[ J] .Lancet Neurol, 2011, 10( 2 ):173-186.
[15] 趙艷紅, 阮金秀.牛黃及其代用品的藥理作用及臨床應用[J].軍事醫學科學院院刊, 2007, 31(2): 175-178.
[16] 陳 燕, 趙 輝, 謝 銳.大黃的藥理及臨床研究近況[J], 西南國防醫藥, 2005, 15(2): 178-180.
Neuroprotective effect of Xiaoer Niuhuang Qingxin Pow der on brain injury of pentylenetetrazole-induced seizure in developing rats
LIWen-juan, JIANG Li*, CHEN Heng-sheng, CHEN Xiao-lu
(Ministry of Education Key Laboratory of Child Development and Disorders, Key Laboratory of Pediatrics in Chongqing, Chongqing International Scienceand Technology Cooperation Center for Child Development and Disorders, Children’ s Hopital of Chongqing Medical University, Chongqing 400014, China)
AIM To study the neuroprotective effect of Xiaoer Niuhuang Qingxin Powder on brain injury of pentylenetetrazole-induced seizure.METHODS Juvenile Sprague-Dawley rats aged twenty one dayswere equally randomized into five groups, the normal group, model group, high-dose, middle-dose, and low-dose of Xiaoer Niuhuang Qingxins Powder group, which were given orally with saline and Xiaoer Niuhuang Qingxin Powder, respectively,except for the normal group, for one day.After the injection of pentylenetetrazole,rats in all groups were sacrificed in proper times for the pathological inspection of brain tissues.The expressions of IL-1 βand glial fibrillary acidic protein (GFAP) in the cortex and CA1 region of the hippocampuswere also observed and neuron apoptosis were examined by TUNEL assay.RESULTS No significant difference was observed between the highdose group and the normal group in the expressions of IL-1 βand GFAP and the apoptotic index, but thar in the middle-dose group were higher than these of the normal group and lower than these of the model group ( P<0.05) .No significant difference were observed between the low-dose and the model group in them.CONCLUSION Xiaoer Niuhuang Qingxin Powder can protect the rat immature brain from the seizures injury caused by pentylenetetrazole in dose dependentmanner.
Xiaoer Niuhuang Qingxin Powder; pentylenetetrazole; convulsions; brain injury;neuroprotection, immature rat
R285.5
: A
: 1001-1528(2014)05-0892-06
10.3969/j.issn.1001-1528.2014.05.002
2013-08-18
李文娟 (1987—) , 女, 碩士生, 研究方向: 未成熟腦驚厥性腦損傷與腦保護作用。 Tel: 13983467430, E-mail: 627775752 @qq.com
*通信作者: 蔣 莉 (1964—) , 女, 教授, 研究方向: 小兒神經系統疾病基礎與臨床。 Tel: (023 ) 63621892, E-mail: dr_jiangli@ 126.com

