EMS不同處理濃度與時間對頭花蓼的誘變效應初報


摘 要 研究了不同誘變時間(12 h、24 h、36 h、48 h、72 h)和誘變濃度(0、0.2%、0.4%、0.6%、0.8%)下,化學誘變劑甲基磺酸乙酯(EMS)對頭花蓼的誘變效應。結果表明,EMS誘變頭花蓼種子的半致死劑量LD50為0.6%EMS處理24 h, 0.8 % EMS處理12 h。經過處理的頭花蓼種子播種成苗后存在廣泛變異,且變異類型豐富,主要表現為:葉片增大、葉片縮小、葉片變薄、葉面積增加、葉比重提高,此5項指標與對照相比差異達極顯著;植株生長速度加快、花青素含量降低,此2項指標與對照相比差異顯著;此外還有葉片皺縮、葉片表皮毛增加等類型。
關鍵詞 頭花蓼;EMS;誘變;濃度;時間;變異
中圖分類號:Q319+.2 文獻標志碼:A 文章編號:1673-890X(2014)10-046-05
知網出版網址:http://www.cnki.net/kcms/detail/50.1186.S.20140611.1610.017.html 網絡出版時間:2014-6-11 16:10:00
頭花蓼(Persicaria capitata)又名四季紅,隸屬于蓼科(Polygonaceae)蓼屬(Polygonum)頭狀蓼組,為多年生草本植物,主產于貴州,在重慶南川、涪陵、北碚、武隆、巴南等地均有分布[1]。頭花蓼耐貧瘠土壤,花色粉紅且花期較長,可用于觀賞;作為貴州地區少數名族常用藥,頭花蓼在治療痢疾、腎盂腎炎、尿路結石等疾癥方面,具有一定效果[2]。此外,楊艷等[3]的研究表明,當土壤中Cd處理濃度達到50 mg/kg時,頭花蓼地上部分對Cd的遷徙總量可達100.09 μg/plant,達到植物富集標準,說明頭花蓼可以作為修復Cd污染的先鋒植物。針對當前園林土壤重金屬嚴重污染的情況,頭花蓼作為一種景觀地被植物種質資源,在園林中的應用顯得極為重要。
頭花蓼是一種具有綜合利用開發價值的園林植物。目前,對頭花蓼的研究主要集中在對其化學成分的分析上,而在誘變育種方向的研究較少。為充分發掘其潛在價值,本研究以甲基磺酸乙酯(EMS)為誘變劑,研究不同濃度EMS和處理時間對頭花蓼種子發芽以及成苗的影響,同時希望篩選出一批有育種價值的突變材料,以期為頭花蓼的選育及園林應用奠定基礎。
1 材料與方法
1.1 材料
頭花蓼成熟種子,采自西南大學園林植物遺傳育種基地,采集后種子在干燥避光處存放[3]。
甲基磺酸乙酯(EMS)購自美國SIGMA公司。
1.2 方法
1.2.1 EMS誘變處理方法
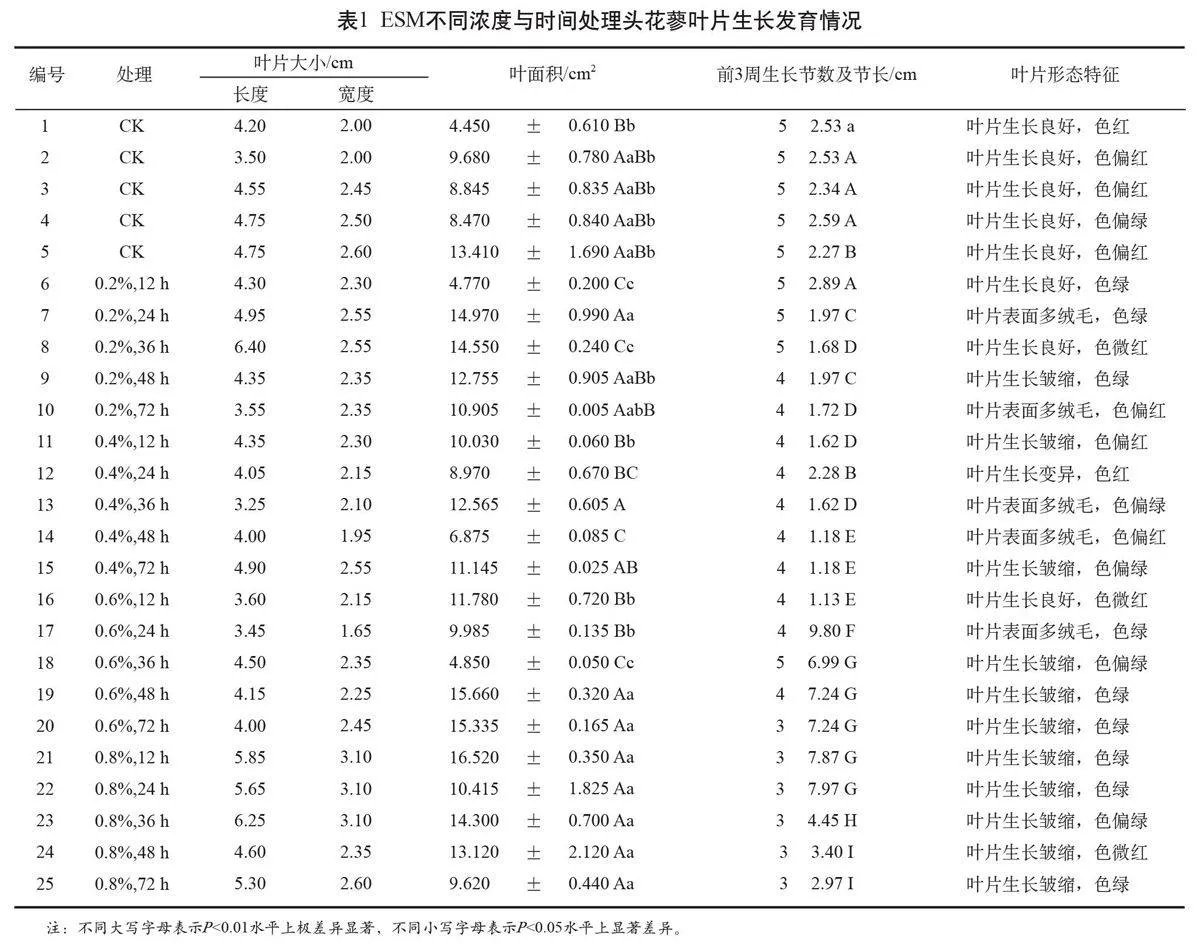
用0.01 mol/L的磷酸緩沖液(Na2HPO4·12H2O-NaH2PO4·H2O,pH=6.5)作為溶劑,配制質量濃度為0(CK)、0.2%、0.4%、0.6%、0.8%的EMS溶液,處理時間為12 h、24 h、36 h、48 h和72 h,依照完全隨機設計得出20個處理(表1)。按10粒種子1 mL誘變劑的比例在4℃避光條件下浸種,處理結束后的種子經流水沖洗24 h,點播于鋪有雙層濾紙的培養皿中,每個處理3次重復,每次重復50粒。培養條件為人工氣候培養箱內25℃暗光發芽[4],從置放當日起,每日上午9時記錄當天發芽數,當發芽數連續3d不再變化時即視為發芽結束[5],統計發芽率、發芽勢、發芽指數,其中:發芽率=發芽結束時的發芽總數/供試種子數×100%,發芽勢=開始發芽后連續3 d的發芽種子數/供試種子數×100%,發芽指數=∑Gt/Dt(Gt為t時間內的發芽數,Dt為相應的發芽天數)[6]。
將所有萌發的種子移栽至16 cm×8 cm的塑料盒中,培養基質由腐殖土、“椰糠+稻殼”、細田土按1∶1∶1比例組成,基質厚度為8 cm。頭花蓼生長期間溫室溫度控制在18~25℃,濕度≥75%,視土壤缺水程度不定期澆水,保證土壤持水量在70%左右[7],生長期間溫室光照均勻,強度為2000~3500 lx。待誘變發芽后的頭花蓼正常生長60 d時進行變異測定[8]。
1.2.2 變異材料的確定及處理方法
(1)觀察形態變異;(2)將變異材料按變異類型進行分類,進行數據采集;(3)制作變異材料切片,在LEICA DM 1000顯微鏡下觀察細胞結構;(4)提取花色變異材料花青素,采用分光光度法測定花青素量。
用AM300掃描式手持葉面積儀測定葉長、葉寬、葉面積,每個處理重復10次,所取樣本均位于植株的同一部位;直尺測量節間長,估讀至0.1 mm,重復10次;采用烘干稱重法測定葉比重及葉片含水量,重復3次,用浸提法測量花青素含量,重復3次。
1.3 數據處理
用SPSS19.0軟件進行數據處理。
2 結果與分析
2.1 不同處理條件下EMS對種子發芽的影響
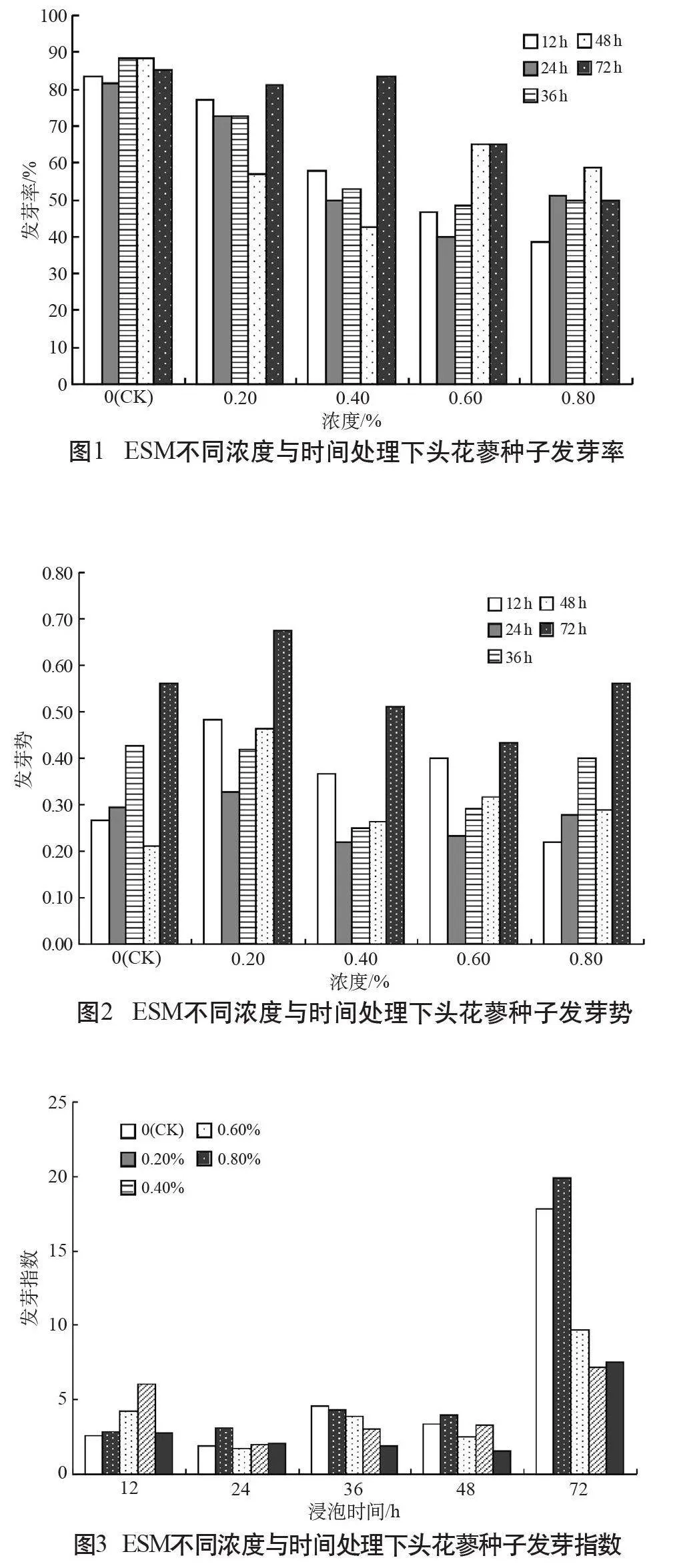
從圖1可知,不同EMS濃度和EMS處理時間對頭花蓼種子發芽具有顯著影響,在同一處理時間下,與對照組相比,實驗組發芽率隨處理濃度的變化呈現“低促高抑”現象。低濃度的化學誘變劑(<0.2%)能夠促進頭花蓼種子萌發,且顯著(P<0.05)提高種子發芽率、發芽勢及發芽指數(圖1~圖3)。隨著EMS濃度的逐漸提高(≥0.4%),種子發芽開始受到抑制,當EMS濃度為0.8%、處理時間為12 h時,頭花蓼種子的相對發芽率接近40%,達到對照組發芽的一半;當EMS濃度為0.8%、處理時間為48 h時,頭花蓼種子的發芽勢、發芽指數均達到最低值,種子生長活力在高濃度誘變劑處理下顯著降低(P<0.05)。在預備實驗中,當EMS濃度為2.0%時,在各時間處理下頭花蓼種子均不發芽,可見高濃度EMS完全抑制了頭花蓼種子的萌發。
當EMS濃度一定,處理時間在12~48 h時,實驗組種子發芽率隨處理時間的延長而降低(圖1)。在0.2%濃度下,當誘變時間增長為72 h時,經過處理的頭花蓼種子發芽率不降反增,72 h處理組的種子發芽勢和發芽指數均達到了本實驗水平下的最大值(圖2~圖3),與對照相比,達到極顯著差異(P<0.01),表現出了強烈的生長活力,這一結果很可能與種子打破休眠萌發的過程有關。正如所知,種子發芽除了需從胚內得到養分供應外,還極易受外界環境影響,有文獻提出,長時間的低溫浸種環境可能會刺激細胞內與發芽相關的酶的活性[7],從而增強種子的成活率。在本實驗中,經過4℃環境下72 h的誘變浸種,種子的發芽率、發芽勢以及發芽指數與對照相比都得到提高。此外,在以磷酸緩沖液作為空白處理的對照組中,經過72 h浸種的CK5發芽率和發芽勢明顯高于經過12 h浸種的CK1,可見,低溫浸種可在一定程度上提高頭花蓼種子的萌發。
2.2 苗期分析
待頭花蓼植株生長60 d后觀察發現,植株產生了廣泛的變異。
2.2.1 葉面積變化
觀察發現,其中1株突變體的葉片面積增長至16.520 cm2,而對照組平均葉面積僅為8.971 cm2,差異達到極顯著水平(P<0.01)。葉長葉寬與對照相比有顯著變化,突變體的葉片長度可增長至6.58 cm,對照組平均葉長僅為4.36 cm,差異達到極顯著水平(P<0.01);而縮小突變體葉片長度僅為3.23 cm,與對照相比縮小顯著(P<0.05)。
2.2.2 株高增加
誘變可使部分植株株高增至32.03 cm,相比對照組18.44 cm的平均株高,差異達到極顯著水平(P<0.01)。
2.2.3 葉片皺縮
經化學誘變劑EMS處理后,頭花蓼在幼苗期普遍發生葉片皺縮現象,是此次觀察中出現最多的變異類型(表1),大量細胞團從葉面中鼓起,造成葉片不正常突起或蜷縮(圖4),部分植株在生長一段時間后皺縮程度降低或自動消失。
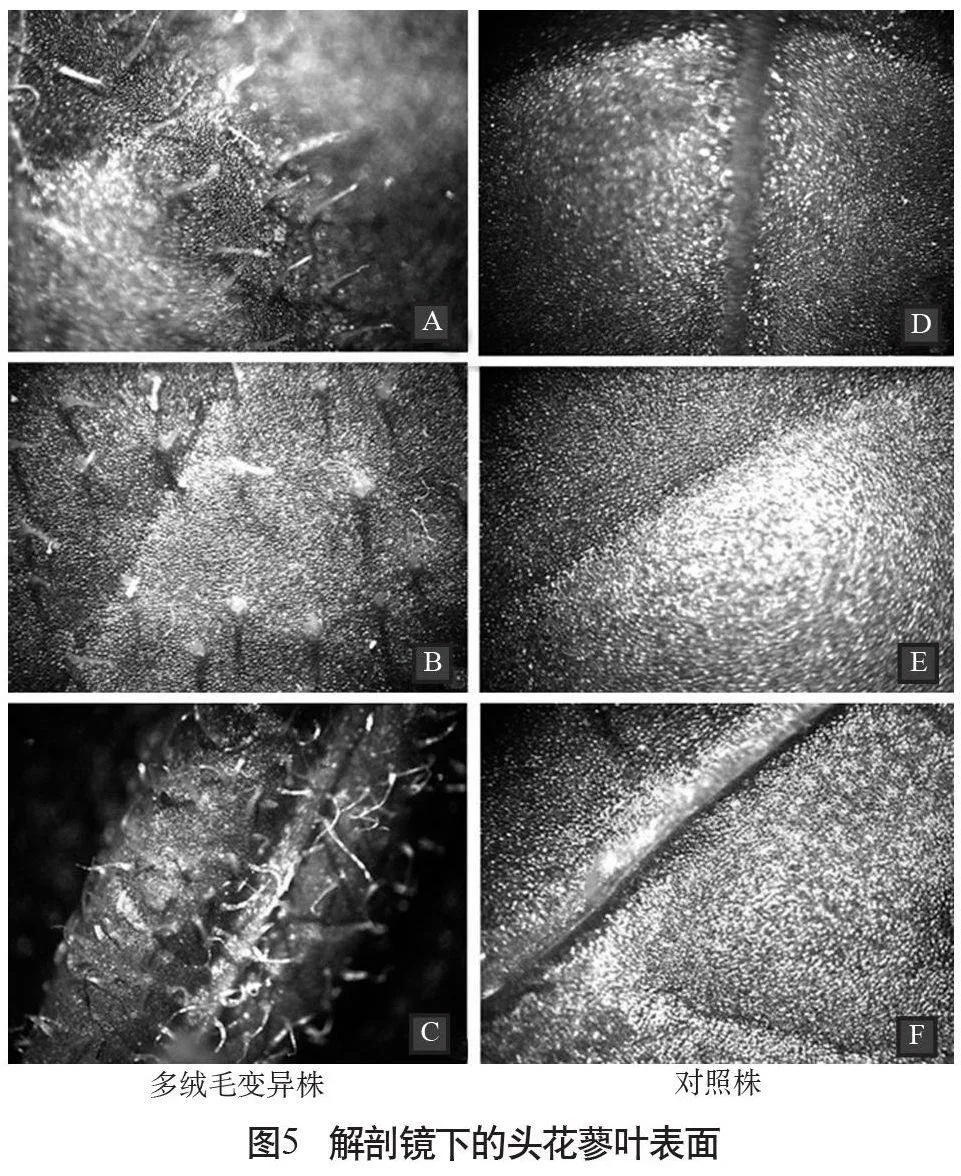
2.2.4 葉表絨毛
在誘變育種中關于誘變導致植株葉片表面有毛或無毛的變異,有非常多的報道[9]。與對照相比,本實驗中出現了大量的表皮毛增多變異類型(圖4、圖5)。
2.2.5 葉色
經誘變處理的頭花蓼種子萌發后,葉片顏色變為淺綠(圖4)。由于對照株與誘變株在生長期間環境條件完全一致,因此可以認為對照株與誘變株的葉片顏色差異是誘變處理導致的遺傳變化。
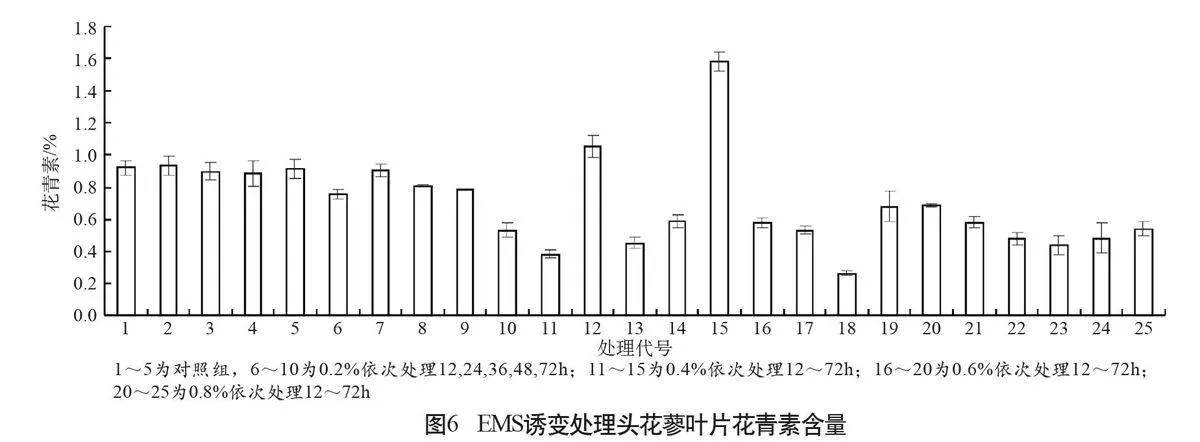
用分光光度法測定了25個處理的葉片花青素含量(圖6),結果顯示,對照株葉片的花青素含量較高(1~5號),為0.9115%(鮮樣),處理組有2株花青素含量(12號、15號)提高,與對照相比差異顯著,其余各株花青素含量下降,與對照相比差異不顯著。
有研究認為,EMS的傷害會減弱大部分植株對光照的敏感性[9],而敏感性的降低則使植株花青素的合成受到阻礙,在頭花蓼葉片中的含量降低。
2.2.6 生長抑制
部分植株誘變后生長受到明顯抑制,表現為誘變組幼苗在一定時期內的生長速度與對照組相比有極顯著的滯緩現象(P<0.01)。在頭花蓼的生長旺盛期,每5 d測量誘變組和對照組的生長節數和節長,觀測數據表明,高濃度(0.8%)EMS對植株的生長抑制極為顯著,經過30 d生長后,對照組平均生長節數為5,平均節長為24.504 mm,0.8%誘變組的生長節數為3,節長平均增加5.332 mm(圖7),與對照相比,差異達到極顯著(P<0.01),而低濃度(<0.8%)EMS誘變對植株的生長抑制不顯著。
2.2.7 花粉育性
實驗表明,化學誘變劑EMS可能對花粉造成不育或半不育性育性影響。其中一個不育株系,柱頭發育正常,花藥干癟,套袋自交不能結實,但以正常株對其授粉卻能正常結實。
3 討論
確定適宜EMS處理濃度和時間是化學誘變育種的關鍵工作,通常采用半致死劑量作為標準。本實驗中,使誘變組植株成活率達到對照植株成活率一半的誘變處理為:EMS濃度0.6%浸種時間24 h,EMS濃度0.8%浸種時間12 h。根據苗期觀察,經過12 h、濃度0.8%EMS處理的頭花蓼生長受到顯著抑制,植株成活率低,成活植株生長幼小且不育,而經過24 h、0.6%EMS處理的頭花蓼植株成活率高,突變頻率高,突變體易于選擇,誘變篩選效果好。根據處理后的植物變異情況,選擇EMS濃度0.6%、浸種時間24 h為本實驗最佳誘變處理。
在對突變體的篩選中,后期共篩選出葉面積增大型、葉片多絨毛型、葉片皺縮型、植株生長速度加快型、花青素含量降低型等變異株。本實驗僅從生理學角度對誘變植株進行了篩選和鑒定,缺少分子水平上的驗證,對變異植株M2代的觀察也沒有開展,使結果具有一定的局限性,有待進一步研究的驗證和完善。
參考文獻
[1]董力,王海洋.頭花蓼4個野外居群生物量及分枝格局研究[J].西南農業學報2011,24(1):253-257.
[2]楊艷,吳宗萍,張敏,等.頭花蓼對重金屬Cd 的吸收特性與累積規律初探[J].農業環境保護,2010,29(11):2094-2099.
[3]Greene E A,Codomo C A,Taylor N E,et a1.Spectrum of chemically induced mutations from a large scale reverse genetic screen in Arabidopsis[J].Genetics,2003,164(2):731-740.
[4]孫長生,韓見宇,楊錦綱,等.頭花蓼種子發芽生物學特性研究[J].現代中藥研究與實踐,2005,19(2):19-22.
[5]熊慶娥.植物生理學實驗教程[M].成都:四川科學技術出版社,2003:551.
[6]陳紅,韓曉瑩.超低溫保存對貴州酥李種子生理生化特性的影響[J].天津農業學報, 2013,19(5):1-4.
[7]徐剛,尹春英,牟東嶺.甲基磺酸乙酯(EMS)處理對麻瘋樹(Jatropha Curcas L.)萌發種子的生理效應[J].種子,2010,29(10):49-53.
[8]薛惠丹,李周岐.花椒愈傷組織EMS誘變及變異研究[J].西北林學院學報,2012,27(2):98-101.
[9]原小燕,李加納,劉列釗.EMS對油菜種子萌發的影響[J].西南師范大學學報(自然科學版),2010,35(3):217-221.
(責任編輯:丁志祥)

