PTEN基因表達與食管鱗狀細胞癌浸潤轉移的關系
潘 飛,尹 航
解放軍總醫院,北京 100853 1腫瘤中心實驗室;2腫瘤內二科
基礎研究
PTEN基因表達與食管鱗狀細胞癌浸潤轉移的關系
潘 飛1,尹 航2
解放軍總醫院,北京 1008531腫瘤中心實驗室;2腫瘤內二科
目的探討食管鱗狀細胞癌中的PTEN蛋白表達與食管鱗癌分化、浸潤和轉移的關系。方法應用免疫組化SP方法檢測PTEN蛋白在50例患者的食管鱗癌組織和其匹配的癌旁組織中的表達,并用細胞遷移和侵襲實驗證明PTEN對食管癌轉移的作用。結果PTEN蛋白在食管鱗癌中的陽性表達率為60%,癌旁正常組織的陽性表達率為90%,差異有統計學意義(Z=4.078,P<0.001)。PTEN的表達與腫瘤分化程度呈正相關,與淋巴結轉移、浸潤深度、腫瘤分期呈負相關。過表達PTEN抑制了食管鱗癌細胞的遷移、侵襲能力。結論PTEN蛋白的表達下調與食管鱗狀細胞癌的浸潤轉移相關。
食管鱗狀細胞癌;PTEN;轉移
食管癌是危害人類健康的主要惡性腫瘤之一。在世界范圍內,發病率居全部腫瘤第8位,腫瘤相關死亡居率居第6位[1-3]。中國是食管癌高發區,組織學上以食管鱗癌為主。腫瘤轉移和復發是食管癌預后差的主要原因之一,5年生存率為5% ~ 45%[4-7]。其發病機制可能與原癌基因激活、抑癌基因失活及腫瘤轉移基因異常有關[8]。PTEN是10號染色體缺失且與張力蛋白同源物的抑癌基因,具有磷酸酶活性,與腫瘤的浸潤、轉移和預后相關[9-14]。多項研究報道PTEN基因的突變或缺失參與腫瘤的發生和發展,影響細胞周期和凋亡,甚至誘導腫瘤細胞的放療抵抗性[15-18]。本研究采用免疫組織化學SP法檢測50例患者的食管鱗癌組織和其匹配的癌旁組織中的PTEN蛋白的表達水平,探討PTEN表達水平與食管鱗癌臨床病理特征的關系,并從腫瘤細胞水平驗證PTEN對食管鱗癌的功能,以期為臨床治療提供新的證據與思路。
材料和方法
1 樣本來源 50例食管鱗狀細胞癌(ESCC)組織標本為本院2012年3月- 2013年10月手術切除的組織標本。所有標本均取自首次切除食管且術前未接受放療和化療的食管癌患者。每例標本均取原發灶癌組織及距離癌組織1.5 cm以上的食管癌旁組織。所有標本均在腫瘤切除后30 min內采集,均以10%甲醛固定、脫水、石蠟包埋,制備成3 μm切片。每例常規制片3張,1張HE染色進行組織學診斷和分類,2張做免疫組化染色。患者的性別、年齡、腫瘤分化程度、是否轉移、TNM分期等臨床特征見表1。
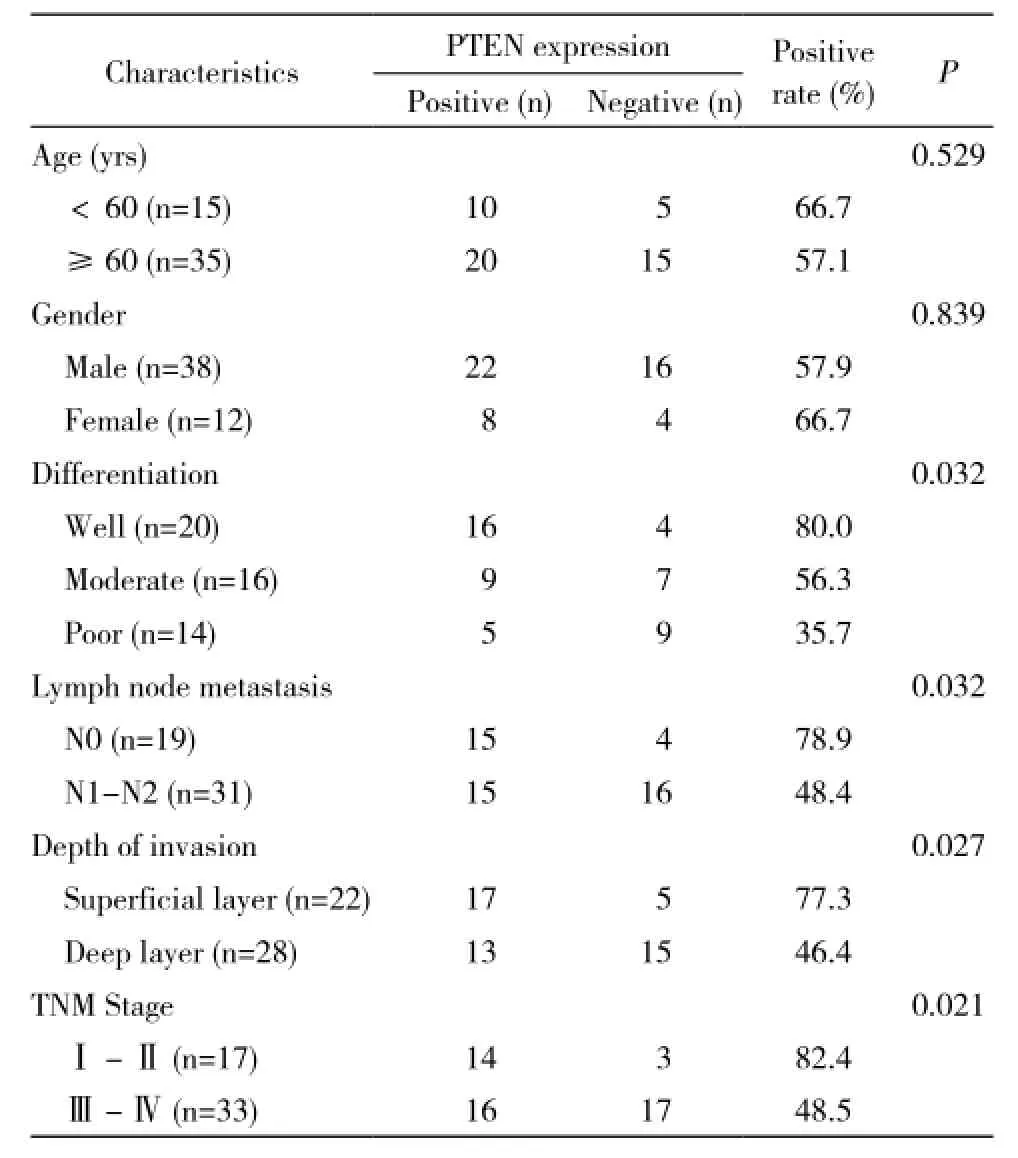
表1 PTEN表達與食管鱗癌臨床病理特征的關系Tab.1 Relationship between PTEN exp ression and clinicopathological characteristics in ESCC
2 試劑與儀器 兔抗人PTEN抗體購自Cell Signaling。SP試劑盒及濃縮型DAB顯色試劑盒均購自北京中杉金橋生物有限公司。
3 免疫組化方法及結果判斷 免疫組化SP方法。實驗步驟按試劑盒說明書進行。采用已知的食管鱗癌陽性標本作陽性對照,用PBS液代替一抗作陰性對照。綜合考慮切片中陽性細胞百分比和陽性細胞著色強度兩項指標,半定量積分法判斷結果。根據顯色程度判斷陽性強度:基本不著色者為0分,著色淡黃色者為1分,棕黃色者為2分,棕褐色者為3分。在光學顯微鏡下隨機選取切片并平展、選取細胞形態和組織結構清晰的視野,選取5個視野(×40),每個視野計數100個細胞,計算各個視野中陽性細胞的平均百分率作為該切片陽性細胞的百分率。按陽性細胞的平均百分率計分:0分為無陽性細胞,1分為陽性細胞≤10%,2分為陽性細胞11% ~ 50%,3分為陽性細胞51% ~75%,4分為陽性細胞>75%。染色強度與陽性細胞計分乘積0 ~ 2分記為(-),3 ~ 5分記為(+),6 ~9分記為(++),10 ~ 12分記為(+++)。
4 細胞系與細胞培養 人食管鱗癌細胞株KYSE150由本院消化科實驗室郭明洲教授惠贈。培養基為RPMI1640,血清、胰蛋白酶、青霉素和鏈霉素購自Hyclone公司。細胞在37℃、5% CO2培養箱中進行體外培養。2 ~ 3 d傳代1次,取對數生長期的細胞用于實驗。
5 質粒構建與轉染 利用載體pcDNA3.1(+) (Invitrogen)和酶切位點KpnⅠ、XhoⅡ構建PTEN過表達質粒,命名為pcDNA-PTEN,對照組為pcDNA3.1。將質粒瞬轉入食管鱗癌細胞株KYSE150,收集RNA和蛋白,并用Real-Time Quantitative PCR (qPCR)和Western blot來驗證PTEN的過表達。轉染試劑為Lipofectamine 2000(Invitrogen)。
6 Transwell遷移及細胞侵襲實驗檢測過表達PTEN對食管癌轉移的抑制作用 無菌鑷子將Transwell小室(或鋪基質膠的小室)放入24孔板的孔中;將預熱的無血清培養基200 μl加入到小室的上層,室溫下放置20 ~ 30 min,使ECM層充分水化;用無血清培養基制備細胞懸液,濃度為5×106/ml;向24孔板中加入500 μl含20%胎牛血清的1640培養基;向每個小室中加入200 μl第3步制備的細胞懸液;孵箱中孵育24 ~ 72 h;用棉拭子將小室上層未侵襲的細胞輕輕擦掉;將500 μl結晶紫染色液加入24孔板未占用的孔中;然后將擦去上層細胞的小室放入染色液中,使其被染色液浸透,染色20 min;將小室浸入盛有去離子水的燒杯中,沖洗數次,空氣干燥;顯微鏡下觀察照相,10倍鏡視野下隨機選取5個視野計數細胞。
7 統計學方法 采用SPSS13.0統計軟件分析數據。組間差異分析采用配對設計的秩和檢驗,相關性分析采用Pearson χ2檢驗。P<0.05為差異有統計學意義。
結 果
1 食管鱗癌組織標本PTEN蛋白表達低于癌旁食管組織 50例食管鱗癌組織標本的PTEN蛋白陽性率為60%,癌旁組織的陽性率為90%,差異有統計學意義(Z=4.078,P<0.001)。見表2。

表2 PTEN在食管鱗癌和癌旁組表達情況Tab. 2 Expression of PTEN in ESCC tissues and adjacent noncancerous tissues (n)
2 食管鱗癌PTEN蛋白表達與臨床病理特征的關系 PTEN蛋白在高、中、低分化食管鱗癌中的陽性表達率分別為80%(16/20)、56.3%(9/16)、35.7%(5/14),可知食管鱗癌組織的PTEN蛋白表達水平與食管鱗癌的分化程度呈正相關,分化程度越高陽性率越高(P=0.032)。PTEN在淋巴結無轉移和轉移的癌組織中陽性表達率分別為78.9%(15/19)、48.4%(15/31),兩組差異有統計學意義(P=0.032)。PTEN蛋白在食管鱗癌浸潤淺層組、浸潤深層組陽性率分別為77.3%(17/22)、46.4%(13/28),兩組差異有統計學意義(P=0.027)。PTEN蛋白在食管癌早期表達高于晚期(P=0.021)。另PTEN蛋白表達水平與年齡、性別無相關性。見表1。
3 食管鱗癌PTEN蛋白的過表達抑制食管鱗癌細胞的遷移和侵襲能力 我們構建了PTEN的過表達質粒。將質粒瞬轉入食管鱗癌細胞株KYSE150,48 h后收集RNA和蛋白,通過qPCR和Western blot檢測,結果表明PTEN在KYSE150細胞中實現了過表達(圖1)。Tanswell遷移實驗顯示PTEN過表達組(pcDNA-PTEN)癌細胞遷移穿過小孔的數目比對照組(pcDNA3.1)少了近60%(圖2A),過表達PTEN抑制了癌細胞的遷移能力(P<0.05)。細胞侵襲實驗結果表明PTEN過表達組(pcDNAPTEN)癌細胞穿過小孔的數目比對照組(pcDNA3.1)少了近65%(圖2B),過表達PTEN抑制了癌細胞的侵襲能力(P<0.05)。
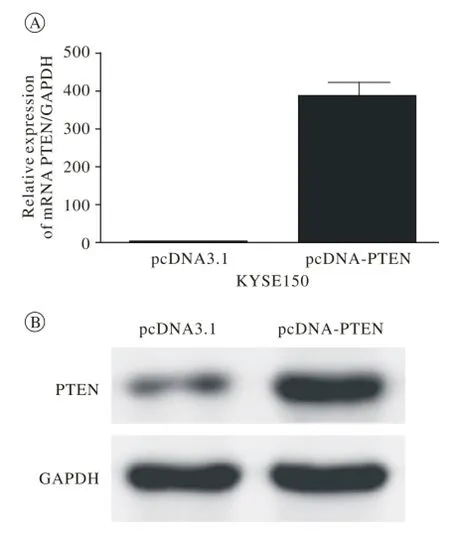
圖 1 成功構建PTEN過表達質粒Fig. 1 Overexpression of PTEN was successfully constructed
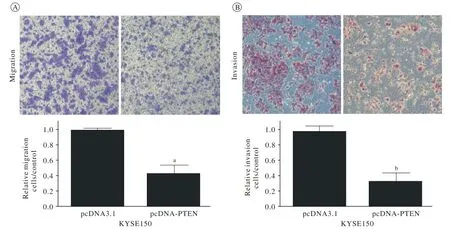
圖 2 PTEN的高表達可以抑制食管鱗癌細胞的遷移和侵襲能力 A: 遷移實驗; B: 侵襲實驗Fig. 2 Overexpression of PTEN rem arkably inh ibited the ability of m igration (A) and invasion (B) in ESCC cells (a P<0.05, b P<0.05)
討 論
PTEN基因是1997年發現的抑癌基因,位于染色體10q23上,全長210 kb,編碼含403個氨基酸的蛋白質[19]。PTEN具有特異的磷酸酶活性,可調節3,4,5-三磷酸磷脂酰肌醇(PIP3)和3,4-二磷酸磷脂酰肌醇(PIP2)水平,影響Akt通路,從而調控細胞的增殖分化和凋亡,發揮腫瘤抑制作用[20]。也有研究證明,PTEN通過下調局灶黏附激酶的表達,抑制胃癌的轉移和浸潤[12]。
PTEN廣泛表達于上皮細胞,主要通過基因的突變、缺失或甲基化而失活,表現為PTEN mRNA或蛋白的不表達或表達下調[21-22]。食管鱗癌是上皮來源的腫瘤。本研究結果顯示食管鱗癌組織中的PTEN蛋白陽性表達率低于相應的癌旁組織。這表明抑癌基因PTEN的表達下調在食管癌的發生、發展過程中具有重要的作用。我們進一步探討了PTEN的表達與食管鱗癌臨床病理特征的關系,發現:1)PTEN蛋白表達水平與食管鱗癌分化程度呈正相關,分化程度越低,腫瘤惡性程度越高,陽性率越低;2)PTEN蛋白表達水平與淋巴結是否轉移有關,無淋巴結轉移組的陽性表達率高于淋巴結轉移組;3)PTEN蛋白表達水平與食管鱗癌浸潤程度呈負相關,浸潤深層組PTEN陽性率低于浸潤淺層組;4)PTEN蛋白表達水平與臨床TNM分期呈負相關,Ⅰ~Ⅱ期的PTEN陽性率高于Ⅲ~Ⅳ期的陽性率,提示PTEN的表達缺失或下調主要發生在食管鱗癌的晚期。
以上結果表明,PTEN蛋白表達與食管鱗癌的惡性程度、浸潤深度、轉移能力相關,這與PTEN在其他腫瘤中的作用相似[16-17]。為此,我們通過細胞水平上的遷移和侵襲實驗證明PTEN過表達組的癌細胞穿過小孔的數目均少于對照組,提示PTEN的高表達可以抑制細胞的遷移和侵襲能力。
綜上所述,PTEN蛋白在食管鱗癌的發生、發展中起到了重要作用,可以調控食管鱗癌的浸潤、轉移。對食管癌的PTEN基因研究,有助于進一步闡明食管癌的發生機制,為腫瘤的診斷、治療、預后評估提供新的思路。
1 Ferlay J, Shin HR, Bray F,et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-2917.
2 Komatsu S, Ichikawa D, Takeshita H,et al. Prognostic impact of circulating miR-21 and miR-375 in p lasma of patients with esophageal squamous cell carcinoma[J]. Expert Opin Biol Ther,2012, 12(1): S53-S59.
3 Zhu YH, Fu L, Chen LL,et al. Downregulation of the novel tumor suppressor DIRAS1 predicts poor prognosis in esophageal squamous cell carcinoma[J]. Cancer Res, 2013, 73(7): 2298-2309.
4 Chen FJ, Sun M, Li SQ,et al. Upregulation of the long Non-Coding RNA HOTAIR promotes esophageal squamous cell carcinoma metastasis and poor prognosis[J]. Mol Carcinog, 2013, 52(11):908-915.
5 Lv XB, Lian GY, Wang HR,et al. Long noncoding RNA HOTAIR is a prognostic marker for esophageal squamous cell carcinoma progression and survival[J]. PLoS One, 2013, 8(5):e63516.
6 Sato F, Shimada Y, Watanabe G,et al. Expression of vascular endothelial growth factor, matrix metalloproteinase-9 and E-cadherin in the process of lymph node metastasis in oesophageal cancer[J]. Br J Cancer, 1999, 80(9): 1366-1372.
7 Thompson SK, Ruszkiewicz AR, Jamieson GG,et al. Improving the accuracy of TNM staging in esophageal cancer: a pathological review of resected specimens[J]. Ann Surg Oncol, 2008, 15(12):3447-3458.
8 Denlinger CE, Thompson RK. Molecular basis of esophageal cancer development and progression[J]. Surg Clin North Am, 2012, 92(5):1089-1103.
9 Cai JC, Fang LS, Huang YB,et al. miR-205 targets PTEN and PHLPP2 to augment AKT signaling and drive malignant phenotypes in Non-Small cell lung cancer[J]. Cancer Res, 2013, 73(17):5402-5415.
10 Chowdhury S, Ongchin M, Wan G,et al. Restoration of PTEN activity decreases metastases in an orthotopic model of colon cancer[J]. J Surg Res, 2013, 184(2): 755-760.
11 Leinonen KA, Saram?ki OR, Furusato B,et al. Loss of PTEN is associated with aggressive behavior in ERG-positive prostate cancer[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22(12): 2333-2344.
12 Zhang LL, Liu J, Lei S,et al. PTEN inhibits the invasion and metastasis of gastric cancer via downregulation of FAK expression[J]. Cell Signal, 2014, 26(5): 1011-1020.
13 Chen J, Li T, Liu Q,et al. Clinical and prognostic significance of HIF-1α, PTEN, CD44v6, and survivin for gastric cancer: a metaanalysis[J]. PLoS One, 2014, 9(3):e91842.
14 Cordes I, Kluth M, Zygis D,et al. PTEN deletions are related to disease progression and unfavourable prognosis in early bladder cancer[J]. Histopathology, 2013, 63(5): 670-677.
15 Dean SJ, Perks CM, Holly JM,et al. Loss of PTEN expression is associated with IGFBP2 expression, younger age, and late stage in triple-negative breast cancer[J]. Am J Clin Pathol, 2014, 141(3):323-333.
16 Squarize CH, Castilho RM, Abrahao AC,et al. PTEN deficiency contributes to the development and progression of head and neck cancer[J]. Neoplasia, 2013, 15(5): 461-471.
17 Xu WT, Yang Z, Lu NH. Roles of PTEN (phosphatase and tensin homolog) in gastric cancer development and progression[J]. Asian Pac J Cancer Prev, 2014, 15(1): 17-24.
18 Qu C, Liang Z, Huang J,et al. MiR-205 determines the radioresistance of human nasopharyngeal carcinoma by directly targeting PTEN[J]. Cell Cycle, 2012, 11(4): 785-796.
19 Stocker H, Andjelkovic M, Oldham S,et al. Living with lethal PIP3 levels: viability of flies lacking PTEN restored by a PH domain mutation in Akt/PKB[J]. Science, 2002, 295(5562): 2088-2091.
20 Li J, Yen C, Liaw D,et al. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer[J]. Science, 1997, 275(538): 1943-1947.
21 Frisk T, Foukakis T, Dwight T,et al. Silencing of the PTEN tumor-suppressor gene in anaplastic thyroid cancer[J]. Genes Chromosomes Cancer, 2002, 35(1): 74-80.
22 Latta E, Chapman WB. PTEN mutations and evolving concepts in endometrial neoplasia[J]. Curr Opin Obstet Gynecol, 2002, 14(1):59-65.
Relationship between expression of PTEN and infiltration and metastasis of esophageal squamous cell carcinoma
PAN Fei1, YIN Hang2
1Key Laboratory of Oncology;2Department of Oncology Chinese PLA General Hospital, Beijing 100853, China
The frst author: PAN Fei. Email: panfeisysu@126.com; YIN Hang. Email: story2001@126.com
ObjectiveTo investigate the relationship between protein expression of PTEN and differentiation, infiltration and metastasis of esophageal squamous cell carcinoma (ESCC).MethodsThe immunohistochem isty SP method was used to detect the protein expression of PTEN in 50 cases of ESCC tissues and adjacent noncancerous tissues. Then, cell biological experiments such as migration and invasion experiments were performed in ESCC cell lines to explore their functions in tumor progression.ResultsThe positive incidence of PTEN in ESCC tissues was 60%, while in adjacent noncancerous tissues, it was 90%. The differences were statistically signif cant (Z=4.078, P<0.001). The protein expression of PTEN was positively correlated with its differentiation.Furthermore, the protein expression of PTEN had a negative correlation with lymph node metastasis,depth of invasion and TNM.Correspondingly, overexpression of PTEN remarkably inhibited the ability of m igration and invasion in ESCC cells.ConclusionThe decreased protein expression of PTEN plays an important role in the metastasis of ESCC.
esophageal squamous cell carcinoma; PTEN; metastasis
R 735.1
A
2095-5227(2014)08-0843-04
10.3969/j.issn.2095-5227.2014.08.019
2014-06-05 10:35
http://www.cnki.net/kcms/detail/11.3275.R.20140605.1035.002.html
2014-05-05
國家自然科學基金項目(81301781)
Supported by the National Natural Science Foundation of China(81301781)
潘飛,男,在讀碩士。研究方向:消化系統腫瘤。Email: panfeisysu@126.com;共同第一作者:尹航,男,主治醫師。研究方向:肺癌和消化系統腫瘤。Email: story2001@126.com

