miR-146a促進動脈粥樣硬化斑塊形成調控機制研究
孟凡磊,王 超,霍曉川,關 寧,羅俊生
遼寧醫學院,遼寧錦州 121001
miR-146a促進動脈粥樣硬化斑塊形成調控機制研究
孟凡磊,王 超,霍曉川,關 寧,羅俊生
遼寧醫學院,遼寧錦州 121001
目的探討miR-146a對動脈粥樣硬化斑塊的影響及其機制。方法利用miR-146a增強劑(miR-146a mim ic)和miR-146a拮抗劑(miR-146a inhibitor)轉染大鼠外周血單核巨噬細胞,轉染成功后予巨噬細胞泡沫化。油紅O染色和脂質染色的半定量分析miR-146a對細胞的脂質堆積情況的影響。Western blot檢測膽固醇酯水解酶(cholesteryl ester hydrolase,CEH)、ABCA1和ABCG1的表達情況。結果Western blot檢測顯示,miR-146a mimic轉染組的CEH表達明顯降低,miR-146a inhibitor轉染組的ABCA1和ABCG1表達量較對照組和miR-146a mimic轉染組明顯增多。油紅O染色顯示miR-146a mimic轉染組、對照組和miR-146a inhibitor轉染組的陽性細胞比例分別為82.1%±3.1%、73.2%±0.16%和16.25%±2.1%。結論miR-146a能夠抑制大鼠外周血單核巨噬細胞細胞內CEH的表達,進而阻礙游離膽固醇的外流,最終導致動脈粥樣硬化斑塊的形成。
泡沫細胞;膽固醇酯水解酶;ABCA1;ABCG1;微小RNA
由動脈粥樣硬化引起的缺血性腦血管病(ischemic cerebrovascular disease,ICVD)占腦血管病(cerebrovascular disease,CVD)的70% ~ 80%,其具有較高的發病率和致殘率,是危害人類健康的最為常見的疾病之一。現已證實動脈粥樣硬化的形成與泡沫細胞內過剩膽固醇和膽固醇酯有著密切的關系[1]。研究發現膽固醇酯水解酶(cholesteryl ester hydrolase,CEH)能夠增加細胞內游離膽固醇和膽固醇酯的外流,抑制泡沫細胞的形成[2-3]。微小RNA(miRNA)是一種非編碼RNA,通過導致靶基因的沉默來調控真核基因的表達[4-5]。有學者認為miRNA拮抗劑能促進膽固醇的逆行轉運(reverse cholesterol transport,RCT),減少細胞內膽固醇和膽固醇酯含量[6]。同時,在膽固醇逆行轉運過程中最重要的轉運體ABCA1和ABCG1起到了通道蛋白載體的作用[7-8]。本研究通過觀察分析miRNA對大鼠外周血單核細胞的膽固醇的逆行轉運的影響,進一步探討miRNA對膽固醇酯水解酶的作用機制,并為藥物治療缺血性腦血管病提供理論依據。
材料和方法
1 材料 胎牛血清(美國GIBCO公司),氧化型低密度脂蛋白(ox-LDL)(北京協生生物科技有限公司),佛波酯(PMA)和油紅O(Sigma公司),大鼠淋巴細胞分離液(TBD sciences),內參照β-actin(Santa Cruz公司),CEH(HCEH1)兔多克隆一抗購于Sigma公司,ABCA1兔多克隆一抗、ABCG1兔多克隆一抗(Abcam公司)。
2 大鼠外周血單核細胞的分離提取與培養 取8 ~10 ml大鼠外周血,將其用0.9%氯化鈉注射液對半稀釋,加入等量的淋巴細胞分離液,于50 ml離心管中以1 500 r/min離心20 min后,小心吸取中間層和上層交接處的白細胞層于EP管中洗滌離心后,獲得T淋巴細胞,于6孔板內備用,調整細胞濃度至1×106/孔。在37℃,5% CO2培養箱孵育培養4 h后的單個核細胞此時大部分貼壁,輕輕倒去未貼壁的淋巴細胞,用濃度為50 ng/ml的PMA刺激48 h,使之轉化為巨噬細胞。
3 細胞分組及處理 將培養的巨噬細胞分為對照組,miR-146a mimic轉染組(100 pmol刺激48 h),miR-146a inhibitor轉染組(100 pmol刺激48 h)然后各組應用氧化低密度脂蛋白(50 μg/ml)刺激24 h。
4 油紅O染色和脂質半定量分析 將細胞以PBS沖洗3次,放在4℃、10%甲醛中固定10 min,用油紅O方法染色:水洗5 min,60%異丙醇中放置5 min,新過濾的油紅O染色10 min。60%異丙醇分化5 min,水洗5 min,Mayer氏蘇木精明礬染液染色5 min,1% HCl分色及反藍后,水洗5 min并照相。按Wads方法pI進行脂質染色的半定量分析,即根據細胞脂滴的面積進行細胞分類。如果細胞脂滴的面積小于細胞核的面積記為“-”,細胞脂滴的面積等于或大于細胞核的面積記為“+”,此即為油紅O染色細胞;每玻片計數100個細胞。
5 Western blot檢測相關蛋白表達 不同處理組泡沫化處理24 h后將細胞刮下,收集至EP管內。用TBS漂洗后加入裂解液裂解細胞,考馬斯亮藍法測定蛋白質濃度。取等量蛋白上樣SDS聚丙烯酰胺凝膠電泳,轉膜,5%脫脂奶粉封閉抗體,分別加入1∶200倍稀釋的CEH一抗、1∶500倍ABCA1一抗、1∶2 500倍ABCG1一抗過夜。TBST洗膜后加入二抗溫育1 h,β-actin作為內參。TBS洗滌,加入ECL顯影劑在暗室中顯影。
6 統計學方法 采用SPSS13.0統計軟件進行統計學處理。數據以表示,各組數據正態性和方差齊性檢驗,兩樣本均數比較采用t檢驗,檢驗水準α=0.05。
結 果
1 miR-146a對巨噬細胞泡沫化的影響 miR-146a inhibitor轉染組細胞多呈橢圓形或者不規則形狀,油紅O染色陽性細胞明顯減少,細胞核染為藍色,細胞質紅染不明顯。而空白對照組和miR-146a mimic轉染組可見大量的染色陽性細胞,細胞質大量紅染,細胞核染藍色,并且細胞體積部分增大,呈圓形或不規則形(圖1)。其中,對照組的陽性細胞比例為73.2%±0.16%,miR-146a mimic轉染組和miR-146a inhibitor轉染組分別為82.1%±3.1%和16.25%±2.1%,與對照組相比較差異均有統計學意義(P<0.05)。可見miR-146a inhibitor轉染組泡沫化程度有所下降,miR-146a mimic轉染組泡沫化的程度有所增加。
2 miR-146a減少巨噬細胞CEH的表達并且降低了膽固醇的外流 Western blot檢測結果顯示,miR-146a mimic轉染組比較對照組CEH表達明顯降低(圖2),表明miR-146a的含量升高可以抑制CEH的表達。并且miR-146a inhibitor轉染組的ABCA1和ABCG1表達量較對照組和miR-146a mimic轉染組明顯增多(圖3),由此我們認為miR-146a能夠抑制與膽固醇外流相關的ATP結合盒轉運體ABCA1和ABCG1的表達。
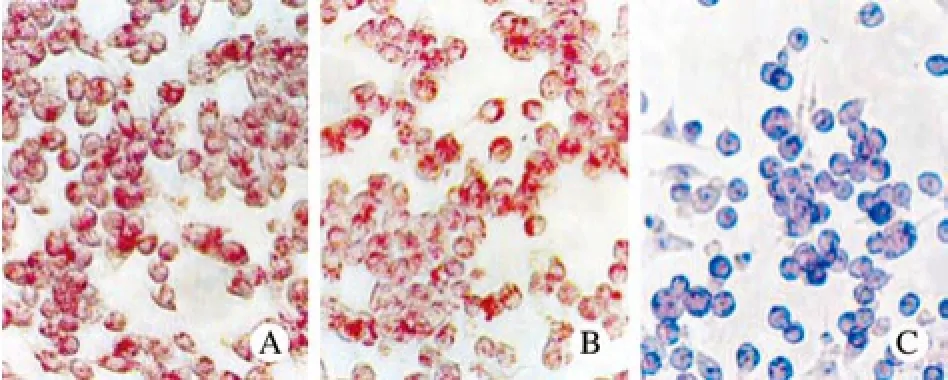
圖 1 油紅O染色顯示miR-146a能促進大鼠外周血單核巨噬細胞轉化為泡沫細胞(×400) A: 對照組; B: miR-146a m im ic轉染組; C: miR-146a inhibitor轉染組Fig. 1 Oil Red O staining show ing foam cells in control group(A), miR-146a m im ic transfected group(B), miR-146a inhibitor transfected group(C)
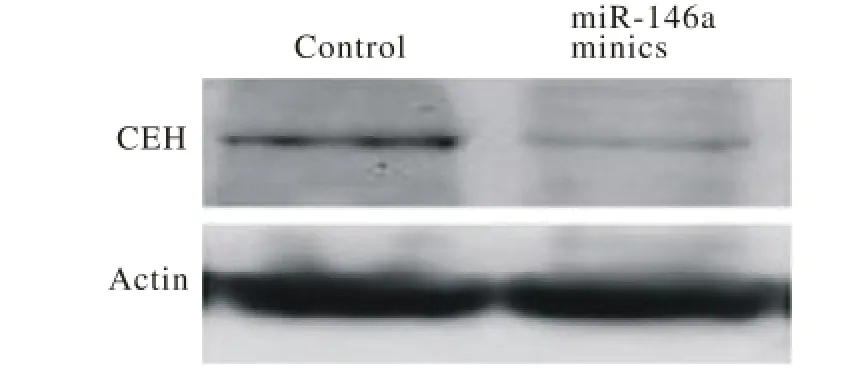
圖 2 Western blot檢測CEH表達水平Fig. 2 Western blot show ing expression level of CEH
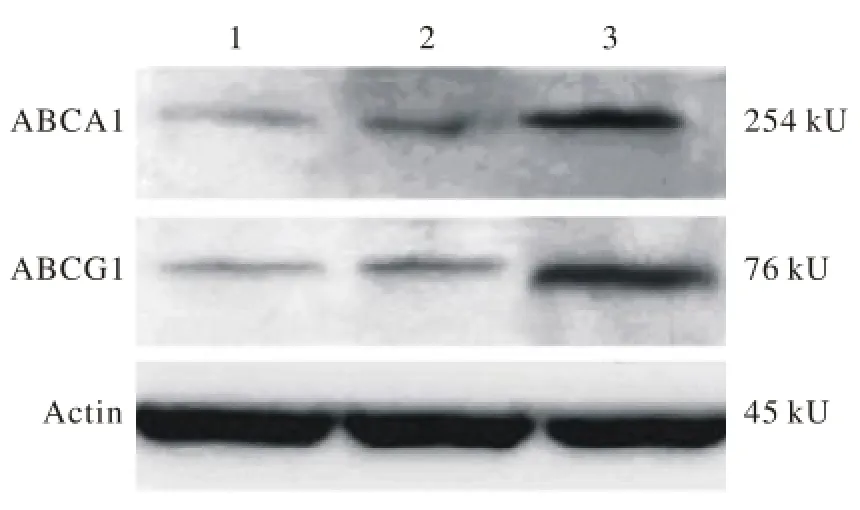
圖 3 miR-146a m im ic和miR-146a inh ibitor轉染后Western b lot檢測ABCA 1和ABCG 1蛋白表達情況 1: miR-146a m im ic轉染組; 2: 對照組; 3: miR-146a inhibitor轉染組Fig. 3 Western b lot show ing exp ression of ABCA 1 and ABCG1 protein in miR-146a m im ic transfected group (1), control group (2), miR-146a inhibitor transfected group (3)
討 論
巨噬細胞吞噬脂類形成泡沫細胞,并且在血管壁上聚集是動脈粥樣硬化(atherosclerosis,AS)的顯著特征之一。由于血管內皮損傷后循環中的脂蛋白尤其是修飾的低密度脂蛋白(modified lowdensity lipoprotein,mLDL)被單核巨噬細胞攝取,并逐漸增加形成泡沫細胞[9-10]。隨著泡沫細胞的脂質不斷聚集,AS斑塊體積不斷增加,且伴隨相應的炎癥反應,從而增加其易損性并且容易引起斑塊的破裂[11]。有研究發現,清除巨噬泡沫細胞內的膽固醇有逆轉AS的作用[12]。CEH在體內組織細胞表達較為廣泛,其中以巨噬細胞和肝表達最為顯著[13]。在巨噬泡沫細胞中,CEH高表達使水解CEs的能力增強,釋放FC增加,同時能使細胞表面通道蛋白例如ABCA1和ABCG1的表達量增加,在不同程度上促進了RCT的進程,抑制泡沫細胞的形成[11,14]。
近年來,miRNA作為治療靶點指導疾病的診斷和藥物的研究已經成為熱點。且基于miRNA基因防治AS已經越來越受到學者重視。miR-146a對細胞的生物學過程有重要的調節作用,能夠抑制IL-18的表達、調節巨噬細胞功能、促進血管平滑肌細胞增殖等作用[15-16]。研究證實miR-146a對脂質代謝具有調節作用,可以參與動脈粥樣硬化形成的過程[17-18]。但miR-146a是否通過誘導CEH表達來調節泡沫細胞RCT的進程還未見報道。因此,我們通過以上的研究來觀察它們是否存在聯系。
我們通過轉染大鼠外周血單核巨噬細胞miR-146a mimic,使巨噬細胞內miR-146a量增多,觀察CEH的表達量是否有所變化。研究發現miR-146a組與對照組相比CEH的表達程度明顯減低,據此我們推測miR-146a能通過某些信號通路來下調CEH的表達,促進泡沫細胞的形成。
AS的形成與泡沫細胞內脂質的聚集有密切的關系,故增加巨噬泡沫細胞膽固醇外流是防治AS的關鍵。因此,本研究通過油紅O染色和Western blot觀察分析各組泡沫細胞的形成情況、膽固醇逆行轉運體ABCA1和ABCG1的表達情況、miR-146a對泡沫細胞的影響。結果顯示,miR-146a inhibitor轉染組較對照組和miR-146a mimic轉染組ABCA1和ABCG1表達增高,泡沫細胞形成數目也較少。該結果證實了miR-146a與巨噬細胞泡沫化成正相關。同時miR-146a能抑制ABCA1和ABCG1的表達,阻礙膽固醇的逆行轉運,最終導致動脈粥樣硬化的形成。因此,我們認為miR-146a能夠通過抑制CEH表達進而減少巨噬細胞膽固醇外流相關受體的表達,促進了巨噬細胞向泡沫細胞的轉化。
綜上所述,本研究證明了miR-146a抑制大鼠外周血單核巨噬細胞CEH的表達,促進了的細胞的泡沫化,并且降低了細胞內游離膽固醇外流。但是其機制還需要進一步的探究。同時以上研究結果的發現為進一步探討miR-146a與CEH相關作用機制和防治AS的藥理研究提供了理論依據。
1 Webb NR, Moore KJ. Macrophage-derived foam cells in atherosclerosis: lessons from murine models and implications for therapy[J]. Curr Drug Targets, 2007, 8(12): 1249-1263.
2 Zhao B, Song J, St Clair RW,et al. Stable overexpression of human macrophage cholesteryl ester hydrolase results in enhanced free cholesterol efflux from human THP1 macrophages[J]. Am J Physiol Cell Physiol, 2007, 292(1): C405-C412.
3 Igarashi M, Osuga J, Uozaki H,et al. The critical role of neutral cholesterol ester hydrolase 1 in cholesterol removal from human macrophages[J]. Circ Res, 2010, 107(11): 1387-1395.
4 Lee RC, Ambros V. An extensive class of small RNAs in Caenorhabditis elegans[J]. Science, 2001, 294(5543): 862-864.
5 Sun SG, Zheng B, Han M,et al. miR-146a and krüppel-like factor 4 form a feedback loop to participate in vascular smooth muscle cell proliferation[J]. EMBO Rep, 2011, 12(1): 56-62.
6 Rayner KJ, Sheedy FJ, Esau CC,et al. Antagonism of miR-33 in mice promotes reverse cholesterol transport and regression of atherosclerosis[J]. J Clin Invest, 2011, 121(7): 2921-2931.
7 Kang J, Park J, Choi H,et al.Plant ABC Transporters[J]. Arabidopsis Book, 2011, 9:e0153.
8 Bingham TC, Fisher EA, Parathath S,et al. A2a adenosine receptor stimulation decreases foam cell formation by enhancing ABCA1-dependent cholesterol efflux[J]. J Leukoc Biol, 2010, 87(4):683-690.
9 Maxfield FR, van Meer G. Cholesterol, the central lipid of mammalian cells[J]. Curr Opin Cell Biol, 2010, 22(4): 422-429.
10 Glass CK, Witztum JL. Atherosclerosis. the road ahead[J]. Cell,2001, 104(4): 503-516.
11 Ouimet M, Marcel YL. Regulation of lipid droplet cholesterol efflux from macrophage foam cells[J]. Arterioscler Thromb Vasc Biol,2012, 32(3): 575-581.
12 Nissen SE, Tsunoda T, Tuzcu EM,et al. Effect of recombinant ApoA-I Milano on coronary atherosclerosis in patients with acute coronary syndromes: a randomized controlled trial[J]. JAMA,2003, 290(17): 2292-2300.
13 Ghosh S, Mallonee DH, Hylemon PB,et al. Molecular cloning and expression of rat hepatic neutral cholesteryl ester hydrolase[J]. Biochim Biophys Acta, 1995, 1259(3): 305-312.
14 Ghosh S. Early steps in reverse cholesterol transport: cholesteryl ester hydrolase and other hydrolases[J]. Curr Opin Endocrinol Diabetes Obes, 2012, 19(2): 136-141.
15 Xiang Y, Jiang MH, Wang DS,et al. Effect of miR-146a on IL-18 expression in mouse macrophage[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2011, 27(5): 477-479.
16 Monk CE, Hutvagner G, A rthur JS. Regulation of miRNA transcription in macrophages in response to Candida albicans[J]. PLoS One, 2010, 5(10):e13669.
17 Yang K, He YS, Wang XQ,et al. MiR-146a inhibits oxidized lowdensity lipoprotein-induced lipid accumulation and inflammatory response via targeting toll-like receptor 4[J]. FEBS Lett, 2011,585(6): 854-860.
18 Jiang M, Xiang Y, Wang D,et al. Dysregulated expression of miR-146a contributes to age-related dysfunction of macrophages[J]. Aging Cell, 2012, 11(1): 29-40.
Mechanism in regulation of miR-146a promoting atherosclerotic p laque formation
MENG Fan-lei, WANG Chao, HUO X iao-chuan, GUAN Ning, LUO Jun-sheng
The frst aff liated hospital of Liaoning Medical University, Jinzhou 121001, Liaoning Province, China
Corresponding author: LUO Jun-sheng. Email: luojunshengljs@sina.com
ObjectiveTo study the effect and mechanism of miR-146a in atherosclerotic plaque.MethodsRat monocyte macrophages were transfected with agom ir-146a (miR-146a m im ic) and antagomir-146a (miR-146a inhibitor), and exposed to ox-LDL after transfection. Macrophages were stained with oil red O and sem i-quantitative analysis were used to evaluate the effect of miR-146a on lipid accumulation. Western blot was employed to detect the expression of CEH, ABCA1 and ABCG1.ResultsWestern Blot showed that the expression of CEH signif cantly decreased in miR-146a mimics, while the expression of ABCA1 and ABCG1 in miR-146a inhibitor transfection group increased much more than they were in the control group and miR-146a m im ic transfection group. Oil Red O staining showed that the positive cells ratios in miR-146a m im ic transfection group and control group and miR-146a inhibitor transfected group were 82.1%±3.1%, 73.2%±0.162% and 16.25%±2.1% respectively.ConclusionmiR-146a can inhibit the expression of CEH in rat peripheral blood mononuclear cells and hinder cholesterol effux, thus resulting in atherosclerotic plaque formation.
foam cell; cholesteryl ester hydrolase; ABCA1; ABCG1; MicroRNA
R 543.5
A
2095-5227(2014)08-0847-04
10.3969/j.issn.2095-5227.2014.08.020
2014-04-04 11:40
http://www.cnki.net/kcms/detail/11.3275.R.20140404.1140.003.html
2013-11-25
國家自然科學基金項目(81171111);遼寧省科技廳自然科學基金項目(2013022016);遼寧省教育廳科學研究項目(L20122 98);遼寧醫學院校長基金項目(XZJJ20130211);遼寧省科技廳科學技術計劃項目(2011225055)
Supported by the National Natural Science Foundation of China(81171111); Natural Science Foundation of Liaoning Science and Technology Committee (2013022016); Science and Technology Research Project of Liaoning Education Committee(L2012298); Science and Technology Plan Project of Liaoning Science and Technology Committee(2011225055)
孟凡磊,男,在讀碩士。研究方向:腦血管病的基礎與臨床。Email: 791031025@qq.com
羅俊生,男,博士,出站博士后,教授,博士生導師。Email: luojunshengljs@sina.com

