利拉魯肽對糖尿病大鼠腎臟病變的影響
李 里,盧 松
(重慶市中山醫院內分泌科,重慶 400013)
糖尿病腎病(DN)是常見的糖尿病微血管并發癥,目前被認為是導致終末期腎衰竭的主要原因[1]。利拉魯肽是一種胰高血糖素樣肽-1(GLP-1)類似物,2型糖尿病患者 GLP-1分泌功能受損,外源性給予利拉魯肽可明顯降低其血糖及體重,故該藥受到的關注越來越多。目前,關于利拉魯肽對糖尿病腎病(DN)的影響研究少見報道。本研究中,擬從白蛋白排泄率、生化、病理等方面觀察不同劑量利拉魯肽對糖尿病大鼠腎臟病變的影響。現報道如下。
1 材料和方法
1.1 動物模型的建立與分組
選擇雄性8周齡SD大鼠60只(購自重慶醫科大學醫學動物中心),體重(200 ±25)g,動物合格證編號為 150449。2 型糖尿病模型制備,采用高糖高脂飲食1個月后一次性小劑量鏈脲佐菌素(STZ,Sigma公司)(30 mg/kg)腹腔內注射[2],STZ 用 0.1 mmol/L 無菌枸櫞酸緩沖液配制(pH=4.5)。給藥72 h后連續3 d血糖不低于16.67mmol/L,尿糖定性(++)以上者視為造模成功。將 30只成模大鼠隨機平均分為3組,即糖尿病腎病組(DN組)、利拉魯肽100μg/kg組(L100 組)、利拉魯肽 200μg/kg組(L200組)。另取10只SD大鼠,腹腔注射等量枸櫞酸鈉緩沖液,作為正常對照組(NC組)。模型建立1周后,L100組、L200組分別給予利拉魯肽(諾和諾德中國公司)100μg/kg或 200μg/kg腹腔內注射,每日2次,NC組與DN組給予等量生理鹽水注射。
1.2 標本收集與測定
藥物干預12周后,以代謝籠收集24 h尿液,記錄尿量并采用散射比濁法測定尿白蛋白排泄率(UAER)。24 h尿蛋白測定采用考馬斯亮蘭法,以牛血清蛋白制作標準曲線,得回歸方程 Y=3.729 7 ×10-4X+0.397 7(r=0.999 7),將每個標本于 721 型分光光度計595 nm波長處測得的吸光度(A)值代入上述方程,所得值與尿量的乘積為24 h尿蛋白總量。稱體重(BW)后,腹主動脈取血、離心,使用法國ABX型全自動生化分析儀檢測血糖(BG)、血肌酐(Scr)、尿素氮(BUN)。采血后分離左腎,去包膜,稱腎重(KW),計算腎臟肥大指數 (KW/BW×103)。
1.3 腎臟病理檢查
取部分腎組織,經4%戊二醛固定,常規脫水、滲透、包埋、切片等處理,透射電鏡觀察腎臟組織超微結構變化。取部分腎組織,予4%多聚甲醛固定,常規石蠟包埋、切片、脫蠟、HE及PASM染色、透明、封片處理,光鏡觀察腎臟組織結構變化。在光鏡下(400倍)隨機取50個腎小球,用北航計算機醫學病理圖像分析系統測定腎小球平均截面積(MGA)、系膜平均面積(MMA),根據腎小球平均體積(MGV)=1.25MGA 計算 MGV,系膜面積比(FMA)=MMA/MGA。
1.4 統計學處理
2 結果
2.1 血糖、腎功能指標
試驗結束,DM組死亡3只,L100組與L200組各死亡1只。與 DM 組比較,L100組與 L200組的 BUN,Scr,UAER,BG水平均明顯下降(P <0.05),L200組比 L100組下降更明顯(P <0.05)。見表1。
表1 各組大鼠血糖、腎功能指標水平變化(±s)
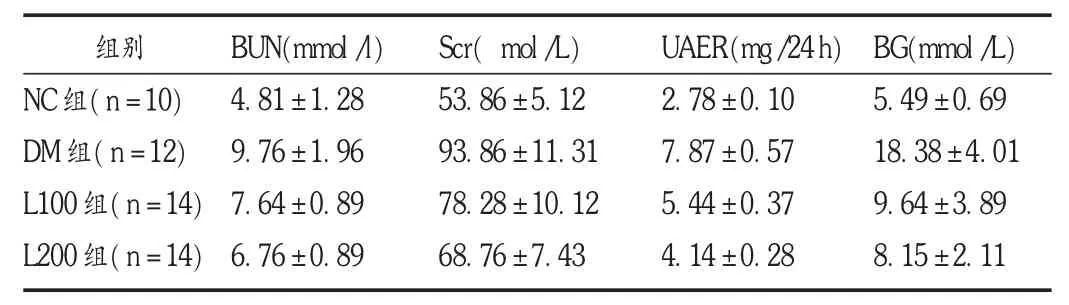
表1 各組大鼠血糖、腎功能指標水平變化(±s)
注:與 NC 組比較,P <0.05;與 DM 組比較,P <0.05;與 L100 組比較,P <0.05。下表同。
組別N C組(n=1 0)D M 組(n=1 2)L 1 0 0組(n=1 4)L 2 0 0組(n=1 4)B U N(m m o l/l)4.8 1±1.2 8 9.7 6±1.9 6 7.6 4±0.8 9 6.7 6±0.8 9 S c r( m o l/L)5 3.8 6 ±5.1 2 9 3.8 6 ±1 1.3 1 7 8.2 8 ±1 0.1 2 6 8.7 6 ±7.4 3 U A E R(mg/2 4 h)2.7 8 ±0.1 0 7.8 7 ±0.5 7 5.4 4 ±0.3 7 4.1 4 ±0.2 8 B G(m m o l/L)5.4 9±0.6 9 1 8.3 8 ±4.0 1 9.6 4±3.8 9 8.1 5±2.1 1
2.2 腎臟肥大指標
與 DM組比較,L100組與 L200組 KW,KW/BW,MGV,FMA增加的幅度明顯下降(P<0.05),L200組比 L100組下降更明顯(P <0.05)。見表2。
表2 各組大鼠腎臟肥大指標變化(±s)
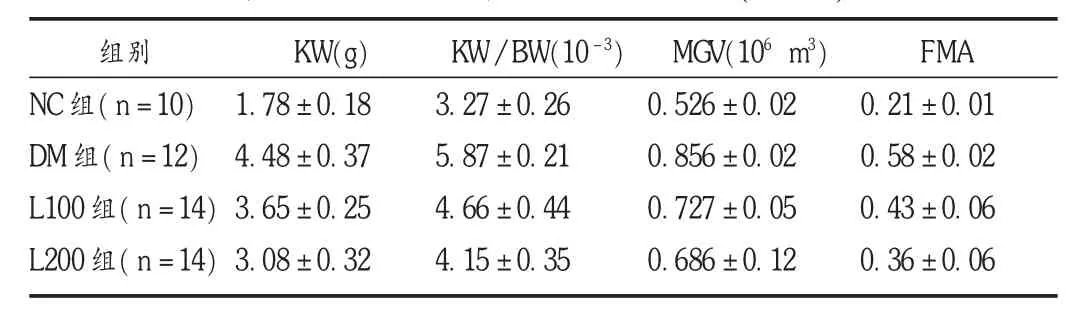
表2 各組大鼠腎臟肥大指標變化(±s)
組別N C組(n=1 0)D M 組(n=1 2)L 1 0 0組(n=1 4)L 2 0 0組(n=1 4)K W(g)1.7 8 ± 0.1 8 4.4 8 ± 0.3 7 3.6 5 ± 0.2 5 3.0 8 ±0.3 2 K W /B W(1 0-3)3.2 7 ± 0.2 6 5.8 7 ± 0.2 1 4.6 6 ± 0.4 4 4.1 5 ± 0.3 5 mg V(1 0 6 m 3)0.5 2 6 ± 0.0 2 0.8 5 6 ± 0.0 2 0.7 2 7 ± 0.0 5 0.6 8 6 ± 0.1 2 F M A 0.2 1 ± 0.0 1 0.5 8 ± 0.0 2 0.4 3 ± 0.0 6 0.3 6 ±0.0 6
2.3 腎組織病理學檢查
光鏡下,HE及PASM染色顯示,對照組大鼠腎組織結構清晰、形態規則、毛細血管基底膜(ECM)清晰可見,包曼氏囊清晰可見;DM組大鼠腎小球明顯肥大,部分腎小球呈分葉狀,系膜區增寬,基底膜增厚;L100組和L200組也出現上述改變,但程度明顯減輕,尤以L200組病變減輕明顯。見圖1及圖2。透射電鏡結果顯示NC組大鼠腎組織結構清晰,基底膜光滑、均質,足突間隙明顯;DM組大鼠腎小球足細胞胞體腫脹,足突部分融合、脫落,系膜區基質增多,基底膜增厚;L組上述改變減輕,尤以L200組病變減輕明顯。見圖3。
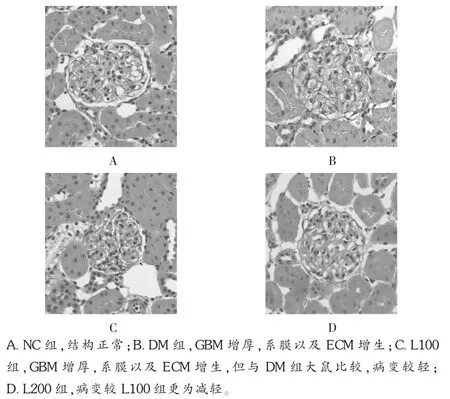
圖1 光鏡下大鼠腎臟HE染色圖像(400倍)
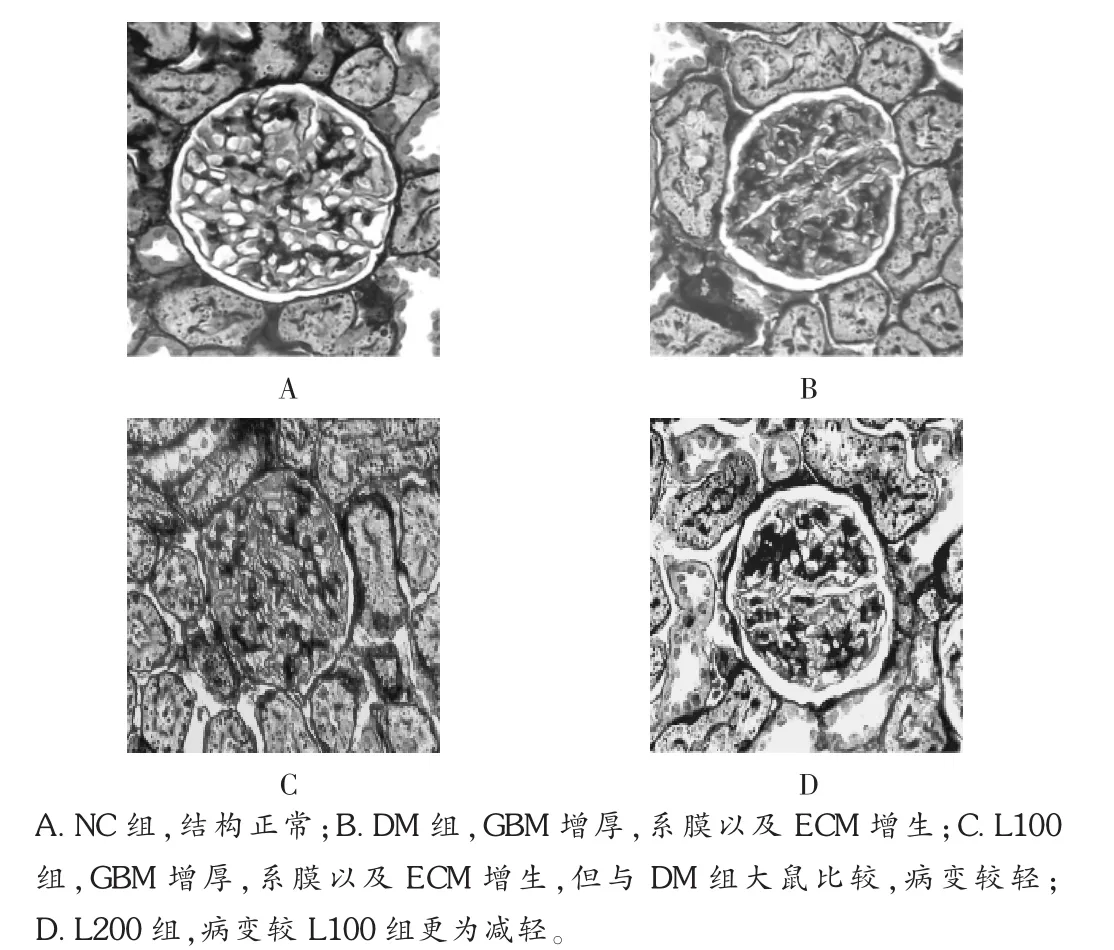
圖2 光鏡下大鼠腎臟PASM染色圖像(400倍)
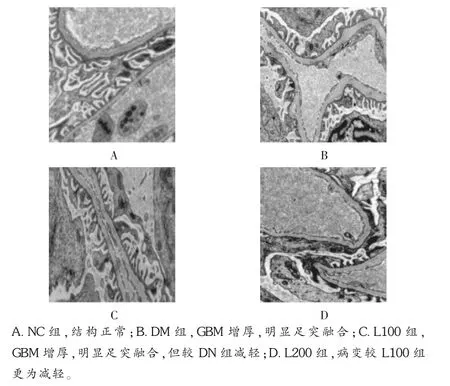
圖3 大鼠腎臟透射電鏡圖像(10 000倍)
3 討論
糖尿病腎病特征性病理改變是系膜細胞肥大以及細胞外基質成分堆積,腎小球基底膜增厚,最終導致腎小球硬化。其發病機制復雜,而高血糖是其發生發展的起始和核心因素。在腎臟中,長期高血糖狀態可使腎小球上皮細胞分泌CD26增加[3],導致腎臟局部血管內皮生長因子、轉化生長因子、胰島素樣生長因子等表達增加,刺激系膜外基質沉淀,從而引起腎小球基底膜增厚,導致腎損害[4]。
利拉魯肽是胰高血糖素樣肽-1類似物,是治療糖尿病的新型藥物,通過抑制胰島β細胞凋亡、促進其增殖及前體細胞向β細胞轉化、抑制肝糖輸出、促進外周細組織對胰島素的敏感性,從而降低血糖。本研究結果顯示,與糖尿病組大鼠相比,不同劑量利拉魯肽治療組大鼠血糖均明顯降低,且腎功能各項指標如尿素氮、肌酐好轉,24 h尿蛋白明顯下降,病理切片分析和電鏡檢查提示腎小球基底膜增厚、系膜細胞增生、足細胞損傷等病理改變減輕,MGV及 FMA等病理指標好轉,表明利拉魯肽對糖尿病大鼠腎臟有保護作用,能減輕腎小球高濾過和腎臟肥大,降低尿蛋白,改善腎功能,且200μg/kg劑量較100μg/kg的作用更顯著。但關于利拉魯肽的劑量與保護腎臟的療效是否成簡單的線性關系,以及達到腎臟保護作用的起始劑量,仍需要進一步研究。
關于利拉魯肽減少蛋白尿、延緩腎功能惡化的機制,目前進行的研究甚少。Chow等[5]通過db/db糖尿病小鼠研究了腎臟巨噬細胞浸潤與腎損害的關系,發現腎臟巨噬細胞浸潤與血糖、糖化血紅蛋白水平明顯相關,而與肥胖和血脂無關,腎臟巨噬細胞的浸潤和激活與蛋白尿和腎纖維化則是相關聯的。在STZ誘導的C57BL/6J小鼠DN模型中,腎臟巨噬細胞聚集同進行性腎損傷和纖維化是有聯系的,糖尿病環境中的一些成分(如高血糖、糖化血紅蛋白等)可以刺激巨噬細胞經由白細胞介素(IL-1)和血小板衍生生長因子(PDGF)依賴途徑促進成纖維細胞增殖,從而可能增強腎纖維化[6]。因此推測,利拉魯肽可能通過降低血糖、糖化血紅蛋白水平,從而抑制巨噬細胞在腎臟局部的浸潤,緩解蛋白尿和腎臟纖維化。
關于利拉魯肽腎臟保護作用的機制、劑量和時間依賴性,以及是否具有降糖作用之外的腎臟保護作用等問題,有待進一步深入研究。
參考文獻:
[1]Zhou G,Li C,Cai L.Advanced glycation end-products induce connective tissue growth factor-mediated renal fibrosis predominantly through transforming growth factor beta-independent pathway[J].Am JPathol,2004,165:2 033-2 043.
[2]何清華,周迎生,王 征,等.2型糖尿病大鼠模型制備的影響因素及其特點[J].中國實驗動物學報,2007,15(6):425-429.
[3]Mannucci E,Pala L,Ciani,et al.Hyperglycaemincrease diperptidy peptidase IV activity in patientswith type-2 diabetesmellitus[J].Diabetologia,2010,48:1 168.
[4]Cha DR,Kang YS,Han SY,et al.Vascular endot helial growthfactor is increased during early stage of diabetic nephropathy in type-2 diabetic rats[J].JEndocrinol,2011,183:183-194.
[5]Chow F,Ozols E,Nikolic-Paterson DJ,et a1.Macrophages inmouse type 2 diabetic nephropathy:correlation with diabetic state and progressive renal injury[J].Kidney Int,2009,65(1):116-128.
[6]Chow FY,Nikolic-Paterson DJ,Atkins RC,et al.Macrophages instreptozotocin-induced diabetic nephropathy:potential role in renal fibrosis[J].Nephrol Dial Transplant,2010,19(12):2 987-2 996.

