樹鼩骨髓間充質干細胞體外分離培養及成脂成骨誘導
樹鼩骨髓間充質干細胞體外分離培養及成脂成骨誘導
陸彩霞,李曉飛,王文廣,孫曉梅,仝品芬,匡德宣,代解杰
(1.中國醫學科學院,北京協和醫院醫學生物學研究所樹鼩種質資源中心,昆明 650118;2.云南省重大傳染病疫苗研發重點實驗室,昆明 650118)
目的 探討樹鼩骨髓間充質干細胞(BM-MSCs)的體外分離、傳代及定向誘導為脂肪細和成骨細胞的可行性。方法 通過密度梯度離心聯合貼壁培養法對樹鼩骨髓間充質干細胞進行體外分離、擴增、純化,倒置相差顯微鏡進行形態學觀察。用成脂誘導液(DMEM/F12+10%FBS+100 U/mL青霉素+100μg/mL鏈霉素+1.0 μmol/L地塞米松+0.2 mmol/L吲哚美辛+0.01 mg/mL胰島素+0.5 mmol/L IBMX)和成骨誘導液(高糖DMEM +10%FBS+100 U/mL青霉素+100μg/mL鏈霉素+50 ng/mL BMP-2)對分離的樹鼩BM-MSCs分別定向誘導為脂肪細胞和成骨細胞。結果 原代和傳代細胞為梭形或三角形,可增殖形成克隆。BM-MSCs成脂誘導后油紅O染色細胞內出現紅色脂滴,成骨誘導后茜素紅染色可觀察到礦化結節。結論 密度梯度離心聯合貼壁培養法分離培養樹鼩BM-MSCs簡便可行,獲得的BM-MSCs可體外誘導分化為脂肪細胞和成骨細胞。
樹鼩;骨髓間充質干細胞;細胞培養;成脂誘導;成骨誘導
骨髓間充質干細胞(bone marrow mesenchymal stem cell,BM-MSCs)是一群來源于骨髓組織中的非造血細胞,具有自我更新和可誘導分化為脂肪細胞、肌細胞、成骨細胞、軟骨細胞、神經細胞和肝細胞等具有多向分化潛能的細胞[1]。BM-MSCs能分泌細胞因子和生長因子,可通過旁分泌和內分泌機制發揮免疫調節作用修復受損的組織器官[2],在組織工程中具有良好的應用前景。目前已從人、猴、犬、兔、羊和大小鼠中分離培養出BM-MSCs,但各物種的BM-MSCs在形態和反應性上存在種屬差異,如體外貼壁生長時,不同種屬的BM-MSCs細胞形態明顯不同,對同樣誘導劑的反應不同[3]。樹鼩作為一種新型實驗動物,近年來在生物醫學研究中其應用范圍越來越廣,開展樹鼩BM-MSCs的分離培養,研究其形態特征和反應性,為探索樹鼩BM-MSCs作為種子細胞應用于疾病干細胞治療提供實驗依據。
1 材料和方法
1.1 實驗動物
F1代成年樹鼩(雌雄不限,體重110~130g,來自中國醫學科學院醫學生物學研究所,實驗動物生產許可證SCXK(滇)K2013-0001,使用許可證SYXK (滇)K2013-0001。
1.2 主要試劑及儀器
人淋巴細胞分離液(天津灝洋生物制品有限公司)、DMEM/F12(Thermo)、高糖DMEM(Thermo)、胎牛血清(Thermo)、地塞米松(Enzo)、3-異丁基-1甲基黃嘌呤(IBMX)、胰島素、吲哚美辛(Sigma)、噻唑藍(MTT)、油紅O(Sigma)、DMSO(Sigma)、茜素紅(Solarbio)、BMP-2(PeproTech)、胰酶、肝素鈉、青霉素、鏈霉素、倒置顯微鏡、二氧化碳孵箱、酶標儀。
1.3 實驗方法
1.3.1 BM-MSCs的原代取材、分離與培養:取F1代成年樹鼩,采用頸椎脫臼法處死動物,無菌條件下取出樹鼩的雙股骨和脛骨,粘膜用碘酒浸泡后移入超凈工作臺,用生理鹽水清洗2遍后,剪去骨頭兩端,露出骨髓腔。1 mL注射器吸取肝素鈉并沿骨髓腔吸取骨髓,之后用生理鹽水沖洗骨髓腔,反復2次,并將吸取物和沖洗物移入離心管,對倍加入PBS混懸細胞。在離心管中先加入2 mL淋巴細胞分離液再沿管壁緩慢加入細胞懸液,室溫3500 r/min離心30 min,取中間層,加入PBS混懸細胞,室溫1500 r/min離心10 min,倒掉上清,用含10%FBS、100 U/mL青霉素和100μg/mL鏈霉素的DMEM/F12重懸細胞,吹打混勻后移至25 cm2培養瓶中,在37℃,5%CO2條件下培養。
1.3.2 BM-MSCs的傳代培養:培養72 h后全量換液,以后每3~4 d換液,待細胞生長至90%融合后,用0.25%胰酶消化按1:2傳代培養。倒置相差顯微鏡下觀察細胞形態及生長狀況。
1.3.3 樹鼩BM-MSCs生長曲線測定:取第5代的BM-MSCs,0.25%胰酶消化后制備細胞懸液,調整細胞濃度為4x104個/mL,接種96孔板,每孔200μL,每3 d換液。分別于1、2、3、4、5、6、7、8 d,每天取3孔行MTT法檢測(每孔加入MTT 20μL,37℃孵育4 h后吸出上清,每孔加入150μL DMSO,震蕩10 min)在酶標儀490 nm處測定吸光度值,繪制細胞生長曲線。
1.3.4 樹鼩BM-MSCs向脂肪細胞誘導:取第三代樹鼩BM-MSCs,0.25%胰酶消化后以1x104個/mL接種6孔板,常規培養基培養細胞貼壁融合至90%后,培養液改為成脂誘導液(DMEM/F12+10%FBS +100 U/mL青霉素和100μg/mL鏈霉素 +1.0 μmol/L地塞米松+0.2 mmol/L吲哚美辛+0.01 mg/mL胰島素+0.5 mmol/L IBMX),每隔48 h換液,誘導2周后進行油紅O染色。
1.3.5 樹鼩BM-MSCs成骨細胞誘導:取第三代樹鼩BM-MSCs,0.25%胰酶消化后以1x104個/mL接種6孔板,常規培養基培養細胞貼壁融合至90%后,培養液改為成骨誘導液(高糖DMEM+10% FBS+100 U/mL青霉素+100μg/mL鏈霉素+50 ng/mL BMP-2),每隔48 h換液,誘導18 d后進行茜素紅染色。
2 結果
2.1 形態學觀察
原代細胞:倒置顯微鏡下,剛接種后可見大量小圓形懸浮細胞,24 h后可見細胞開始貼壁,48 h后貼壁細胞開始變形,呈橢圓形或短的梭形,72 h后貼壁細胞開始增殖,細胞呈梭形或三角形。5 d左右可見貼壁細胞分裂形成不同大小的細胞集落,成纖維細胞逐漸增多,“菊花樣”聚落形成較多,并呈放射狀向周圍擴展,逐漸與鄰近集落相互融合,8 d左右即可達80%融合。原代細胞生長相對較慢,培養12 d左右可融合成單層(彩插2圖1)。
傳代細胞:原代細胞培養第12天左右可第1次傳代,之后每6~7 d即可傳代1次,傳代培養的細胞生長速度比原代快,其形態為均一梭形。接種2 h左右即可見細胞貼壁,4 h左右貼壁細胞即可開始克隆生長,3 d左右即可達80%融合,形態呈長梭形,多呈“菊花狀”排列(彩插2圖2),8 d左右生長逐漸緩慢。
2.2 細胞生長曲線
BM-MSCs接種后1~2 d為潛伏期,從第3天起細胞開始增殖并進入對數生長期,第5~6天到達高峰,以后進入平臺期(圖3)。
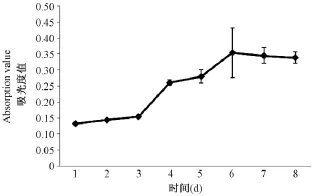
圖3 P5代BM-MSCs生長曲線(4x104 cells/mL)
2.3 成脂誘導后鑒定
樹鼩BM-MSCs成脂誘導6 d后,鏡下可見細胞變圓變大,細胞內有小的脂滴形成,成“葡萄樣”改變,隨著培養時間的增加細胞內脂滴逐漸變大,誘導14 d后油紅O染色可見脂滴被染成紅色(彩插3圖4)。
2.4 成骨誘導后鑒定
樹鼩BM-MSCs成骨誘導18 d后進行茜素紅染色,鏡下可見大量紅色結節(彩插3圖5)。
3 討論
BM-MSCs最早由 Friedenstein和 Petrakova報道[4],1999年Pittenger[5]統一將骨髓間充質干細胞作為正式的命名,其僅占骨髓內單核細胞的1/104~1/105,因此分離純化和大量擴增BM-MSCs使其能作為組織工程的種子細胞,其分離純化方法就顯得尤為重要。目前BM-MSCs的分離方法主要有四種[6]:貼壁分離篩選法、密度梯度離心法、流式細胞儀分選法和免疫磁珠分離法。貼壁法是利用BMMSCs貼壁生長而造血系細胞懸浮生長的特性,通過定期換液除去懸浮細胞,達到分離純化BM-MSCs的目的。密度梯度離心法是利用Percoll和Ficoll分離液將骨髓中不同比重的細胞成分分開得到單個核細胞群,再在培養瓶中培養。流式細胞儀分選和免疫磁珠法都是利用BM-MSCs表達CD29/CD44,不表達CD34/CD45進行正選或負選而獲得相對純化的細胞。后兩種分離方法過程繁瑣,費用昂貴,對細胞活性影響很大,加之目前尚未發現特異性很高的表面標志分子,使其應用受限。樹鼩作為一種新型實驗動物,其BM-MSCs的細胞表面分子還未有相應的免疫試劑,故后兩種分離方法顯然不適用于樹鼩BM-MSCs的分離。目前對不同物種BM-MSCs的分離多采用的是前兩種方法,其中兔、大鼠BMMSCs分離多采用貼壁分離法,分離到的BM-MSCs細胞比較粗短,密度大時仍呈不規則多邊形,多呈階梯狀平行排列[3,7-8]。人BM-MSCs分離可采用貼壁分離法和密度梯度離心法,其中60Co照射處理培養瓶結合貼壁法分離BM-MSCs,獲得的BM-MSCs活性好,傳代力持久,細胞數量多,純度高,獲得的BM-MSCs細胞比較長,密度大時呈菊花狀、蜂窩狀生長[3,9]。我們采用密度梯度離心聯合貼壁法分離樹鼩BM-MSCs,經過換液和傳代培養后,獲得了相對較純的細胞,細胞形態為梭形或三角形,呈蜂窩狀生長與人的BM-MSCs細胞形態較為相似。樹鼩BM-MSCs生長曲線呈S形,符合正常細胞的生長特性,1~2 d為潛伏期,從第3天起細胞開始增殖并進入對數生長期。分離培養獲得的樹鼩BM-MSCs在體外生長活躍,原代細胞生長較為緩慢,傳代后3 d左右即可達到80%融合,增殖能力較強,可作為組織工程中種子細胞的來源。
國際細胞治療學會間充質及組織干細胞委員會提出鑒定人來源BM-MSCs有3條最低標準[10]:①對塑料底物的貼附特性。②流式細胞儀檢測,BM-MSCs群體表達CD105、CD73、CD90陽性率≥95%,而 CD45、CD34、CD14或 CD11b、CD79a或CD19、HLA-DR陽性率≤2%。③具有多向分化潛能。該聲明特別指出,對于動物來源的BM-MSCs,除第二條標準不具備普遍意義的適用性外,第一、第三條標準同樣適用于動物來源的BM-MSCs。由于樹鼩作為一種新型的正在實驗動物化的實驗動物,其BM-MSCs的細胞表面分子還未有相應的免疫試劑,故目前還不能采用流式細胞儀對分離到的BM-MSCs進行細胞表面分子表達鑒定,相關的免疫試劑還有待研發。我們對分離到的BM-MSCs進行體外定向誘導分化為脂肪細胞和成骨細胞,發現用此方法分離到的BM-MSCs能高效向脂肪細胞和成骨細胞誘導分化。BM-MSCs能否向脂肪細胞和成骨細胞分化,在一定程度上取決于培養條件。實驗在培養基中加入了BM-MSCs向脂肪細胞分化所必須的成分,即3-異丁基-1甲基黃嘌呤(IBMX)、地塞米松、胰島素和吲哚美辛。IBMX可提高細胞內cAMP水平,激活cAMP反應元件結合蛋白-CREB,調控C/EBPα和C/EBPβ的表達,參與脂肪細胞的形成;地塞米松通過激活糖皮質激素受體誘導C/EBP的表達,并降低脂肪細胞分化抑制因子的表達;胰島素通過與IGF-1受體結合后調控CREB的磷酸化和轉錄[11-12]。實驗中用含1.0μmol/L地塞米松、0.2 mmol/L吲哚美辛、0.01 mg/mL胰島素和0.5 mmol/L IBMX的成脂誘導液誘導BM-MSCs,誘導培養第6天即可在鏡下觀察到細胞內出現脂質空泡,隨著誘導時間的延長,脂質空泡逐漸變大,形成“葡萄樣”改變,經油紅O染色后可見到脂質空泡被染成紅色。骨髓間充質干細胞向成骨細胞誘導,經典的誘導方法是在培養基中加入維生素C,地塞米松和β-磷酸甘油鈉[5],也可用骨形態蛋白2(BMP-2),進行誘導[13]。實驗中我們采用BMP-2誘導,發現可以成功誘導為成骨細胞,茜素紅染色可見大量紅色結節。
BM-MSCs來自成年的細胞,不涉及道德及倫理學方面的問題,其容易在體外培養,具有高度的擴增能力,傳代后基因穩定性良好;具有多分化潛能,能在不同的誘導條件及合適的體內生長微環境中,定向分化為不同的組織細胞系;同源性BM-MSCs能通過各種途徑輸入體內,在不引起免疫排斥的同時,能在損傷部位修復受損的器官和組織[6];可在世界各地不同條件的實驗室里繁殖和復制,可對獲得的BM-MSCs進一步細分亞類的細胞系,用于不同的治療目的[14]。正因為BM-MSCs具有這些優點,近幾年來被大量應用于實驗及臨床研究,美國FDA及中國SFDA均已批準BM-MSCs進入II期臨床實驗[15-16]。樹鼩作為近年來研究比較熱的新型實驗動物,其BM-MSCs分離培養還處在摸索階段,本實驗研究發現采用密度梯度離心聯合貼壁法可以成功分離樹鼩BM-MSCs,分離后的BM-MSCs具有向脂肪細胞和成骨細胞分化的潛能,可為樹鼩BMMSCs應用于疾病干細胞治療提供實驗依據。
[1] JIANG Y,JAHAGIRDAR BN,REINHARDT RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,13:1185-1188.
[2]Ming Li and Susumu Ikehara Bone-Marrow-DerivedMesenchymalStemCellsfor Organ Repair[J].Stem Cells International,Volume 2013,http://dx.doi.org/10.1155/2013/132642.
[3]夏冰,王捷,郭立達,不同種屬骨髓間充質干細胞體外培養特性的比較研究[J].中國微侵襲神經外科雜志(CMINSJ),2006,11(12):555-557.
[4]Friedenstein AJ,Gorskaja JF,Kulagina NN.Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J].Exp Hematol,1976,4(5):267-274.
[5]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage Potential of Adult Human Mesenchymal Stem Cells[J].Science,1999,284(5411):143-147.
[6] 王彤.骨髓間充質干細胞臨床研究進展[M].人民衛生出版社,2010.1.
[7]庾佳佳,汪新柱,趙琳等.兔骨髓間充質干細胞的分離培養及成骨誘導[J].中國組織工程研究,2013,17(6):974-979.
[8]劉賢華,仝青英,白曉東.人骨髓間充質干細胞體外不同分離與培養方法的比較[J].武警醫學,2012,23(10):836-839.
[9]王寒,趙根尚,周玉陽等.SD大鼠骨髓間充質干細胞分離提純及鑒定[J].中華實用診斷與治療雜志,2012,26(5):436 -438.
[10]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria fordefining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement Cytotherapy.2006;8(4):315-317.
[11]Nuttall ME,Gimble JM.Controlling the balance between osteoblastogenesis and adipogenesis and consequent therapeutic implication[J].Curr Opin Pharmacol.2004;4:290-294.
[12]Rosen ED,Walkey CJ,Puigserver P.et al.Transcriptional regulation of adipogensis[J].Gens Dev.2000;14:1293-1307.
[13]Pierre J Marie,Olivia Fromigué.Osteogenic differentiation of humanmarrow-derivedmesenchymalstem cells[J].Regenerative Med.(2006) 1(4),539-548.
[14]王彤,黃子通.骨髓間充質干細胞與心血管疾病[J].中國急救醫學,2008,28(7):645:648
[15]Amado LC,Saliaris AP,Schuleri KH,et al.Cardiac repair with intramyocardial injection of allogeneic mesenchymal stem cells aftermyocardial intarction[J].Proc Natl Acad SciUSA 2005 Aug 9;102(32):11474-11479.
[16]趙春華.干細胞原理、技術與臨床[M].北京:化學工業出版社,2006.
Isolation,culture,adipocgenic and osteogenic induction of Tupaia bonemarrow mesenchymal stem cells
LU Cai-xia,LIXiao-fei,WANGWen-guang,SUN Xiao-mei,TONG Pin-fen,KUANG De-xuan,DAI Jie-jie
(1.The Center of Tree shrew Germplasm Resources,Institute of Medical Biology,Chinese Academy of Medical Science and Peking Union Medical College,Kunming 650118,China;2.Yunnan Key Laboratory of Vaccine Research&Development on Severe Infection Diseases,Kunming 650118,China)
Objective To study the isolation,culture,adipogenic and osteogenic induction Tupaia bonemarrow mesenchymal stem cells(BM-MSCs).M ethod The BM-MSCs from tupaia were isolated and expended by combination of gradient centrifugation and adherence culture,then subcultured and observed formorphology under inverted phase contrast microscope.BM-MSCswere induced to adipocytes.and osteoblasts in vitro Result Cellswere spindle or triangle-shaped,and clone proliferation.Cells were successfully induced into adipocytes.and osteoblasts Conclusions The method of isolation BM-MSCs from tupaia by combination of gradient centrifugation and adherence culture is simple and feasible,BMMSCs have differentiation potential into adipocytes and osteoblasts.
Tupaia; Bone marrow mesenchymal stem cells; Cell culture; Adipogenic induction;Osteogenic induction
代解杰,男,研究員,E-mail:djj@imbcams.com.cn。
R329 R332
A
1671-7856(2014)03-0010-04
10.3969.j.issn.1671.7856.2014.003.003
國家科技支撐計劃(2011BAI15B01-21;2012BAI39B01;2014BAI01B01)。
陸彩霞,女,助理研究員,研究方向:實驗動物與人類疾病動物模型,E-mail:lcx@imbcams.com.cn。
2014-02-12
研究報告

