孕酮抑制Aβ誘導星形膠質細胞活化所致神經元損傷
吳 潔,吳紅海,于 洋,秦亞彬,韓曉磊,侯艷寧
(1.中國人民解放軍白求恩國際和平醫院藥劑科,河北石家莊 050082;2.河北醫科大學藥理教研室,河北 石家莊 050017)
阿爾采末病(Alzheimer’s disease,AD)是一種以進行性認知功能障礙和記憶損傷為主要臨床表現的中樞神經系統退行性病變。其典型病理改變為淀粉樣斑塊形成、神經纖維纏結、神經元變性死亡和膠質細胞過度增生活化。星形膠質細胞是中樞神經系統最豐富的細胞類型,適度激活的星形膠質細胞可胞吞Aβ蛋白,釋放神經營養因子,保護神經元;但過度激活的星形膠質細胞,通過釋放神經毒性的細胞因子和其他毒性物質,誘導神經元凋亡,加速AD病理進程。研究表明[1],大腦星形膠質細胞的活化和其所分泌細胞因子的改變通常比AD的典型病理改變早10多年,在AD的發生、發展中有重要的作用。
孕酮(progesterone,PROG)是重要的天然孕激素之一,主要用于保護妊娠和婦科疾病的治療。近年來,大量研究發現,孕酮還可作為神經活性甾體,通過抑制炎癥反應、抑制中樞興奮性毒性、抗氧化、抗缺血、抗凋亡、神經營養、改善學習記憶等,對顱腦損傷及神經退行性疾病發揮保護作用[2-4]。本文旨在研究孕酮在抑制Aβ1-42誘導星形膠質細胞活化,保護神經元中的作用及其機制,為孕酮在AD防治中的應用提供實驗依據。
1 材料與方法
1.1 主要試劑與儀器 新生SD大鼠,清潔級,由河北省實驗動物中心提供[許可證號:SCXK(冀)2008-1003];DMEM培養液、胎牛血清(Gibco);Aβ1-42、PROG(Sigma);IL-1β ELISA kit、TNF-α ELISA kit(Blue Gene);NF-κB抗體(Cell Signal);Alexa Fluor 488標記的山羊抗兔二抗(中杉金橋);Lamin A抗體、辣根酶標記山羊抗兔/鼠IgG(Santa Cruz);超凈臺(中國蘇凈集團);CO2細胞培養箱(Thermo Forma);電熱恒溫水浴鍋(科隆儀器設備廠);倒置顯微鏡(上海精密儀器廠);熒光顯微鏡及顯微成像系統(日本Olympus公司);酶標儀(德國BMG公司);低溫離心機(Thermo);電泳儀(北京六一廠)。
1.2 大鼠大腦星形膠質細胞原代培養 取新生24 h SD大鼠,無菌條件下取大腦皮質,剪碎,37℃水浴中胰酶消化15~20 min,含10%FBS的高糖DMEM終止消化。使用巴氏吸管吹散細胞,制備單細胞懸液,接種于預先包被多聚賴氨酸的培養瓶中,37℃,5%CO2細胞培養箱中孵育,每隔2~3 d全量更換培養液,至細胞基本融合。使用“二次震蕩法”純化星形膠質細胞,GFAP免疫熒光染色結果顯示,星形膠質細胞純度超過95%。純化后星形膠質細胞經消化、重懸,以1×108·L-1密度接種于6孔板中,含10%FBS的DMEM培養。
1.3 大鼠大腦皮質神經元培養 參照本實驗室已建立方法[5],略有改進。取新生24 h內SD大鼠大腦皮質部分,進行細胞培養,6 h后首次換液為含2%B27的neurobasal培養基,培養48 h后加入阿糖胞苷抑制膠質細胞生長,48 h以后完全換液,此后,每2 d半量換液。取培養6~7 d的神經元細胞供實驗用。
1.4 星形膠質細胞與神經元共培養 參照文獻[6]方法,略有改進。星形膠質細胞培養于孔底部含有4個約0.5 mm高石蠟小柱的6孔板中,石蠟小柱用于支撐載玻片;神經元培養在經多聚賴氨酸處理的載破片上,培養7 d后,將載有神經元的玻片放入石蠟小柱上,與星形膠質細胞進行共培養。
1.5 實驗分組與給藥 星形膠質細胞隨機分為對照組、Aβ(5μmol·L-1Aβ1-42)組及Aβ加3個濃度PROG處理組 PL、PM、PH(0.01、0.1、1μmol·L-1PROG,各組同時加入 5μmol·L-1Aβ1-42),處理24 h,檢測炎癥因子的釋放、NF-κB的活性。將載有神經元的玻片放入經不同給藥處理的星形膠質細胞中進行共培養,更換培養液為 DMEM(不含 Aβ、PROG),繼續培養48 h,檢測共培養神經元的存活率。
1.6 MTT法 取出神經元細胞爬片,放入24孔板中,每孔加入 40μl MTT(5 g·L-1),于 37℃孵育4 h,棄去培養基,每孔各加入300μl DMSO,混合均勻,酶標儀測定各組細胞490 nm波長處的吸光度(OD值),以各組細胞吸光度與對照組吸光度的比值表示相對細胞存活率。
1.7 ELISA檢測 取各組細胞條件培養液,3 000 r·min-1離心 10 min,取上清,按試劑盒說明書操作,測定炎癥因子IL-1β和TNF-α的水平。
1.8 細胞免疫熒光分析 取各處理組星形膠質細胞,4%多聚甲醛固定30 min,兔源 p65(1∶100)4℃孵育過夜,二抗孵育1 h,熒光顯微鏡下觀察。
1.9 Western blot分析 取各組星形膠質細胞,冰上提取細胞核蛋白,等量蛋白提取液與上樣緩沖液混合,煮沸變性。樣品經SDS-PAGE電泳分離,100 mA濕轉,脫脂奶粉封閉,加兔源p65(1∶1 000)孵育過夜,TBS漂洗后,加辣根過氧化物酶標記的二抗室溫孵育2 h,ECL光化學法顯色,暗室中壓X線片顯影。X-線膠片經掃描,應用Image J圖像分析軟件對掃描圖上的條帶進行相對定量分析。
1.10 統計學方法 結果以ˉx±s表示,應用SPSS 16.0統計軟件,采用單因素方差分析(one way ANOVA),繼以Dunnett t test對數據進行統計分析。
2 結果
2.1 孕酮抑制Aβ1-42誘導星形膠質細胞活化所致神經元損傷 MTT結果顯示,與對照組相比,Aβ組大鼠皮質神經元存活率下降,為對照組的70.1%(P<0.05)。與Aβ組相比,PM、PH組神經元存活率升高,分別為Aβ組的1.159倍和1.296倍 (P<0.05)。孕酮抑制Aβ1-42活化星形膠質細胞引起的神經元存活率下降,作用呈濃度依賴性,結果見Fig 1。

Fig 1 Effect of PROG treated Aβ1-42 activated astrocytes on viability of cultured cortical neurons#P<0.05 vs control group;*P<0.05 vs Aβgroup

Fig 2 Effect of PROG on release of inflammatory cytokines from Aβ1-42 activated astrocytes**P<0.01 vs control group;#P<0.05 vs Aβgroup
2.3 PROG對 Aβ1-42誘導的星形膠質細胞 NF-κB活性的影響 NF-κB主要功能性亞單位p65在細胞中的定位,反映NF-κB的活性。免疫熒光結果顯示,p65在對照組細胞的胞質明顯表達,胞核無著色;Aβ
2.2 PROG對 Aβ1-42誘導的星形膠質細胞炎癥因子釋放的影響 ELISA結果顯示,與對照組相比,Aβ組條件培養液中IL-1β和TNF-α水平均升高(P<0.01);與 Aβ組相比,PM、PH組 IL-1β和 TNF-α的水平均下降(P<0.05);PL組 IL-1β和 TNF-α的水平變化差異無統計學意義(P>0.05)。孕酮濃度依賴地抑制Aβ1-42活化星形膠質細胞炎癥因子的釋放,結果見Fig 2。組NF-κB被激活,p65在胞核明顯表達。隨孕酮濃度的增加,p65在胞核中的分布逐漸減少,胞質中分布增多,孕酮濃度依賴地抑制Aβ1-42引起的p65核轉位,結果見Fig 3。
Western blot結果顯示,與對照組相比,Aβ組星形膠質細胞核提取液中 p65的表達增加(P<0.01)。與 Aβ組相比,PM、PH組細胞核提取液中p65表達量降低(P<0.01),低劑量組差異無統計學意義(P>0.05)。孕酮濃度依賴地抑制 Aβ1-42活化星形膠質細胞中NF-κB的活性,結果見Fig 4。
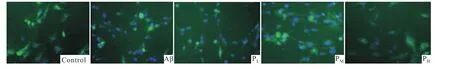
Fig 3 Effect of PROG on nuclear translocation of p65 in Aβ1-42 activated astrocytes observed under fluorescence microscope(400×)
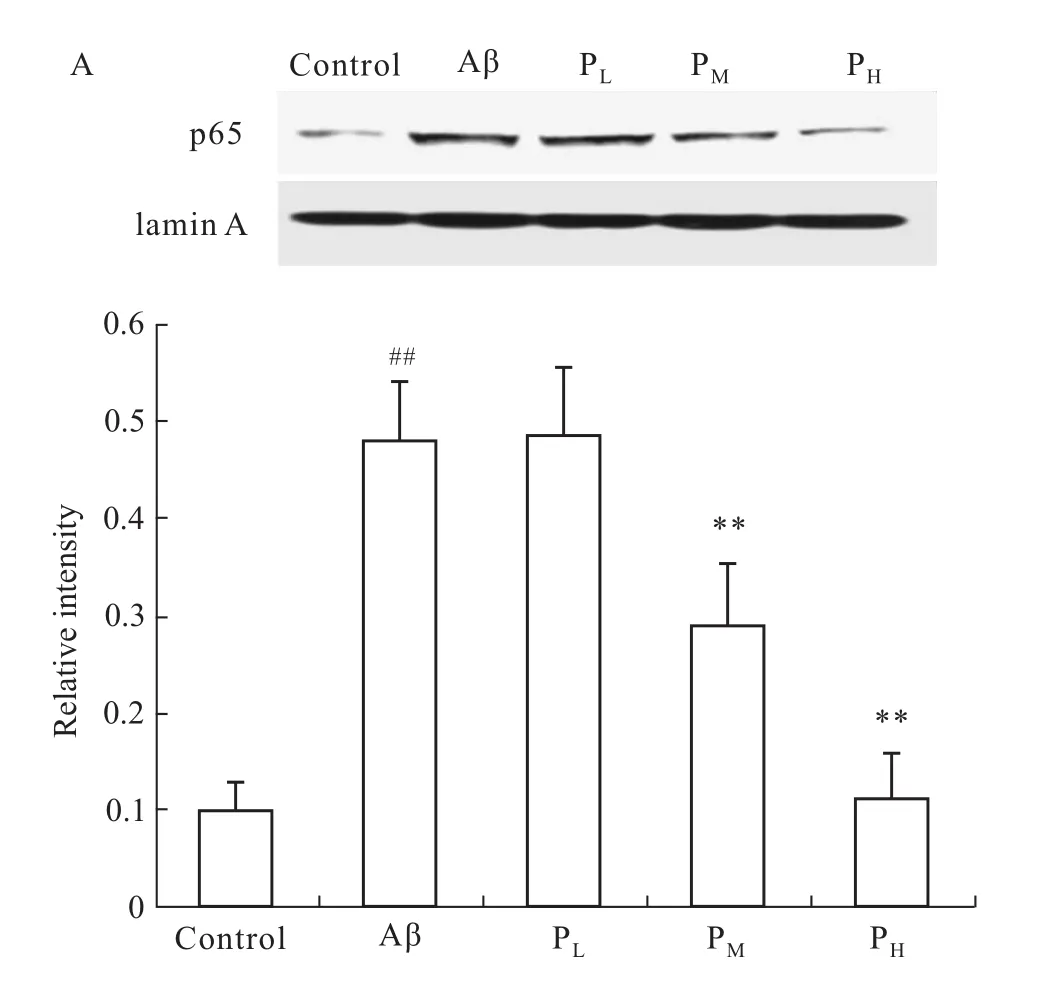
Fig 4 Effect of PROG on p65 expression in nucleus of Aβ1-42 activated astrocytesA:The relative amounts of p65 levels were detected by Western blot analysis,lamin A was used as an internal control;B:Densitometric scanning.##P<0.01 vs control group;**P<0.01 vs Aβgroup.
3 討論
孕酮作為神經活性甾體,發揮廣泛的神經系統調節、保護作用。首先,孕酮能夠增加神經元在缺血損傷中的耐受性[7],維持神經元在Aβ損傷中的活性與功能[8]。也有研究表明,孕酮能夠通過抑制星形膠質細胞和小膠質細胞的活化,在急性腦損傷、脊髓損傷及痛風模型中,發揮有效保護作用[9-11]。然而,孕酮作用與Aβ活化的星形膠質細胞對神經元的影響,尚未見文獻報道。
本實驗首次將孕酮作用于Aβ1-42活化的星形膠質細胞,觀察與其共培養神經元存活率的變化。結果發現,Aβ1-42活化的星形膠質細胞與神經元共培養,使神經元存活率明顯下降;孕酮能夠有效抑制Aβ1-42活化星形膠質細胞引起的神經元存活率下降,發揮神經元保護作用。
星形膠質細胞能夠動態地調節信息處理、信號轉導,調控神經和突觸可塑性,為神經元提供營養和代謝支持[12]。然而,中樞神經系統的各種刺激,誘導星形膠質細胞活化、增生,使其正常生理功能發生一系列變化,影響神經元的活性。文獻報道[6],Aβ作用于星形膠質細胞,使其線粒體功能障礙,能量代謝異常;吞噬與清除Aβ功能受損,致Aβ蓄積[13];谷氨酸轉運系統障礙,興奮性毒性物質蓄積[6];谷胱甘肽合成代謝障礙,過氧化產物蓄積[14];釋放神經毒性的細胞因子和其他毒性物質等[15]。Aβ引起星形膠質細胞代謝表型的改變,都在一定程度上誘導神經元凋亡及AD的發生、發展。
實驗從抑制炎癥反應方面,研究孕酮發揮神經保護作用的機制。將不同濃度的孕酮處理Aβ1-42活化的星形膠質細胞,孕酮有效降低Aβ1-42活化星形膠質細胞條件培養液中IL-1β、TNF-α的水平,抑制NF-κB的活性,在一定程度上反映了孕酮對 Aβ1-42活化星形膠質細胞的抑制,作用呈濃度依賴性。炎癥因子IL-1β、TNF-α介導細胞炎癥級聯反應;增加β-淀粉樣前體蛋白APP及其剪切酶BACE的表達,促進Aβ的生成與釋放;作為死亡配體,誘導神經元凋亡,在 AD的發生、發展中起重要作用[16]。NF-κB作為基因表達轉錄因子,參與炎癥反應、氧化應激反應和細胞凋亡等的調控過程,與許多基因啟動子區域的固定核苷酸序列相結合,啟動基因轉錄,在多種疾病的發病過程中有重要作用[3,18]。因此,與Chen等[3]發現孕酮通過抑制 TLRs/NF-κB信號通路,減少IL-1β、TNF-α、IL-6的表達,發揮保護急性腦損傷作用相一致,本研究認為,NF-κB信號通路在孕酮抑制Aβ誘導的星形膠質細胞活化,發揮神經元保護作用中有重要意義。
綜合實驗室前期孕酮對Aβ25-35誘導的阿爾采末病模型神經元凋亡有保護作用的發現[5],說明孕酮不僅能保護Aβ直接導致的神經元損傷,還可通過抑制膠質細胞活化,發揮對神經元的保護作用,對AD的預防和治療極具潛力。
參考文獻:
[1] Serrano-Pozo A,Mielke M L,Gómez-Isla T,et al.Reactive glia not only associates with plaques but also parallels tangles in Alzheimer’s disease[J].Am J Pathol,2011,179(3):1373-8420.
[2] Meffre D,Labombarda F,Delespierre B,et al.Distribution of membrane progesterone receptor alpha in the male mouse and rat brain and its regulation after traumatic brain injury[J].Neurosci,2013,231:111-24.
[3] Chen G,Shi J,Jin W.Progesterone administration modulates TLRs/NF-κB signaling pathway in rat brain after cortical contusion[J].Ann Clin Lab Sci,2008,38(1):65-74.
[4] Feeser V R,Loria R M.Modulation of traumatic brain injury using progesterone and the role of glial cells on its neuroprotective actions[J].J Neuroimmunol,2011,237(1-2):4-12.
[5] 于 洋,薛 改,吳紅海,等.Aβ25-35對大鼠大腦皮質神經元神經甾體水平的影響[J].中國藥理學通報,2010,26(6):783-6.
[5] Yu Y,Xue G,Wu H H,et al.Effects of Aβ25-35treatment on the levels of neurosteroids in cortical neurons[J].Chin Pharmacol Bull,2010,26(6):783-6.
[6] Allaman I,Gavillet M,Bélanger M,et al.Amyloid-beta aggregates cause alterations of astrocytic metabolic phenotype:impact on neuronal viability[J].J Neurosci,2010,30(9):3326-38.
[7] 李新娟,何瑞芳,李 爽,等.孕酮對全腦缺血/再灌注損傷大鼠學習記憶及海馬P2X7受體表達的影響[J].中國應用生理學雜志,2012,28(5):472-5.
[7] Li X J,He R F,Li S,et al.Effects of progesterone on learning and memory and P2X7 receptor expression in the hippocampus after global cerebral ischemia reperfusion injury in rats[J].Chin J Appl Physiol,2012,28(5):472-5.
[8] Liu S,Wu H G,Xue G,et al.Metabolic alteration of neuroactive steroids and protective effect of progesterone in Alzheimer’s disease-like rats[J].Neural Rege Res,2013,8(30):2800-10.
[9] Labombarda F,González S,Lima A,et al.Progesterone attenuates astrocytes and microgliosis and enhances oligodendrocyte differentiation following spinal cord injury[J].Exp Neurol,2011,231(1):135-46.
[10]Meyer M,Gonzalez D,Garay L I,et al.Stage dependent effects of progesterone on motoneurons and glial cells of Wobbler mouse spinal cord degeneration[J].Cell Mol Neurobiol,2010,30(1):123-35.
[11]Garay L,Tüngler V,Deniselle M C,et al,Progesterone attenuates demyelination and microglial reaction in the lysolecithin-injured spinal cord[J].J Neurosci,2011,192:588-97.
[12] Ransom B,Behar T,Nedergaard M.New roles for astrocytes(stars at last)[J].Trends Neurosci,2003,26(10):520-2.
[13]Zhao J,O′Connor T,Vassar R.Contribution of activated astrocytes to Aβproduction:implications for Alzheimer′s disease pathogenesis[J].J Neuroninflamation,2011,8:150.
[14]Chen Y,Vartiainen N,Ying W,et al.Astrocytes protect neurons from nitric oxide toxicity by a glutathione-dependent mechanism[J].J Neurochem,2001,77(6):1601-10.
[15]Garwood C J,Pooler A M,Athertonl J,et al.Astrocytes are important mediators of Aβ-induced neurotoxicity and tau phosphorylation in primary culture[J].Cell Death Dis,2011,2(6):e167.
[16]Wong A,Luth H J,Deuther-Conrad W,et al.Advanced glycation endproducts co-localize with inducible nitric oxide synthase in Alzheimer′s disease[J].Brain Res,2001,920(1-2):32-40.
[17]Coronel M F,Labombarda F,De Nicola A F,et al.Progesterone reducesthe expression of spinal cyclooxygenase-2 and inducible nitric oxide synthase and prevents allodynia in a rat model of central neuropathic pain[J].Eur J Pain,2014,18(3):348-59.

