江蘇單二啤酒大麥麥芽麥汁中混濁物質的研究
張辰東,蔡國林,張 明,陸 健,*
(1.江南大學工業生物技術教育部重點實驗室,江蘇無錫214122;2.江南大學糧食發酵工藝與技術國家工程實驗室,江蘇無錫214122;3.江南大學生物工程學院,江蘇無錫214122;4.宿遷市江南大學產業技術研究院,江蘇宿遷223800;5.江蘇省農墾麥芽有限公司,江蘇射陽224300)
麥芽是生產啤酒的主要原料,麥芽質量的優劣將直接影響啤酒的生產效率和成品啤酒的質量。我國幅員遼闊,東北、西北、江蘇等地都是大麥的適產區,但是與此同時,近十年以來,我國年均進口啤酒大麥達170萬t,這主要是因為部分國產大麥麥芽的質量存在一些缺陷,不能滿足啤酒釀造的需要。
麥汁的即時濁度是指糖化結束、煮沸之前的濁度,以EBC濁度單位表示,是一項評價麥芽質量的重要指標。研究表明引起麥汁混濁的物質主要有蛋白質及β-葡聚糖、阿拉伯木聚糖、糊精等糖類物質。目前,認為引起麥汁、啤酒混濁主要是由于富含脯氨酸的蛋白質易與多酚交聯從而形成大分子混濁物質[1],Siebert的模型描述了啤酒中混濁活性蛋白與混濁活性多酚的結合方式,并解釋了兩者的相對含量對混濁形成的影響[2]。而對多糖引起麥汁混濁的研究相對較少,Jin采用在麥汁中反添加不同分子量及濃度的β-葡聚糖的方式研究了β-葡聚糖對麥汁濁度的影響,并提出了模型來預測β-葡聚糖濃度及分子量與濁度的關系[3]。此外,大麥及麥芽表面微生物產生的胞外多糖及分泌蛋白等代謝產物,進入麥汁后亦會使濁度升高[4-5]。我國從加拿大、澳大利亞進口的大麥麥芽制備的麥汁通常清亮透明,而江蘇啤酒大麥麥芽生產的麥汁濁度較高,且多數伴隨著過濾性能差、粘度高等釀造缺陷。這些指標在行業標準中并未體現,因此,大型啤酒廠為了控制原料質量,采購麥芽通常要求其協定麥汁濁度在5.5EBC以下,甚至5.0EBC以下。主要原因是擔心引起濁度過高的物質可能會對啤酒生產過程和最終產品的質量產生不利的影響,這導致江蘇啤酒大麥麥芽在國內啤酒行業中的使用比例受到了較大的限制。
單二是江蘇啤酒大麥典型品種,在江蘇啤酒大麥約50萬t的年產量中,單二品種占據了40%左右。因此,本文以單二啤酒大麥制備的麥芽為研究對象,采用色譜及質譜等技術,以定量的方式對協定麥汁混濁物質中蛋白質與糖類進行了研究,確定引起麥汁即時濁度升高的物質組成,以期為單二大麥乃至其它品種的改良指明方向,為提高江蘇啤酒麥芽質量提供依據。
1 材料與方法
1.1 材料與儀器
商品麥芽 單二麥芽 由江蘇省農墾麥芽有限公司提供;Metcalfe麥芽 由中糧麥芽(江陰)有限公司提供。
丙烯酰胺、甲叉雙丙烯酰胺、十二烷基磺酸鈉、過硫酸銨、考馬斯亮藍 G-250、考馬斯亮藍 R-250等 均為上海生工進口分裝產品;其他試劑 均為國產分析純產品。真菌α-淀粉酶(Fungamyl 800L)、中性蛋白酶(Neatrase 0.8L)為諾維信公司產品;β-葡聚糖酶 為裕立寶公司產品。
WGZ-2-PJ型濁度計 上海昕瑞儀器儀表有限公司;自動糖化儀 輕工部西安輕機所光電公司;麥芽標準粉碎機 北京德之杰啤酒技術有限責任公司;H1850R臺式高速冷凍離心機 長沙湘儀離心機儀器有限公司;KjeItec2300凱氏定氮儀 瑞典FOSS分析儀器有限公司;Agilent 1100安捷倫液相色譜儀美國安捷倫公司;垂直電泳槽 美國Bio-Rad公司;UV-2100紫外分光光度計 尤尼柯(上海)儀器有限公司;ICS-5000離子交換色譜儀 美國戴安公司;基質輔助激光解析飛行時間串聯質譜 德國Bruker公司等。
1.2 實驗方法
1.2.1 麥汁濁度及常規指標的測定 麥汁的制備參照文獻[6]采用協定糖化法。濁度的測定采用濁度計,測定原理為90°角散射濁度法[7],測定在麥汁開始過濾后的30min內完成。麥汁常規指標的測定參照文獻[6]。
1.2.2 麥汁混濁物質的收集 取過濾后的麥汁離心,12000r/min 離心(30min,4℃)后,棄去上清,沉淀物質冷凍干燥。
1.2.3 混濁物質的酶解 蛋白酶酶解,取一份協定麥汁(350mL)制備的混濁物質,加3mL蒸餾水及0.1mL蛋白酶,40℃水浴1h后,80℃水浴20min以滅活酶制劑。真菌淀粉酶和β-葡聚糖酶酶解,取一份協定麥汁(350mL)制備的混濁物質,加3mL蒸餾水及0.1mL真菌淀粉酶和0.1mL β-葡聚糖酶,40℃水浴1h后,80℃水浴20min以滅活酶制劑。
1.2.4 糖化過程添加酶制劑實驗 蛋白酶添加實驗,在單二麥芽協定糖化起始階段添加0.1mL蛋白酶;真菌淀粉酶和β-葡聚糖酶添加實驗,在單二麥芽協定糖化起始階段添加0.1mL真菌淀粉酶和0.1mL β-葡聚糖酶。糖化結束后,測定麥汁濁度。
1.2.5 麥芽蛋白的提取 取細粉的麥芽粉0.1g,加1mL蒸餾水,60℃水浴提取1h,期間每隔15min混勻數次,離心取上清液,作為水溶蛋白(清蛋白);在沉淀中再添加5%(W/V)NaCl溶液1mL,重復提取過程,上清液為鹽溶蛋白(球蛋白);在沉淀中再添加70%乙醇溶液1mL,重復提取過程,離心取上清液,作為醇溶蛋白[8]。
1.2.6 蛋白質含量的測定 取凍干后的沉淀物質,參照文獻[9]測定。
1.2.7 氨基酸組成分析 凍干物用6mol/L鹽酸在110℃真空條件下水解22h,水解液過濾、離心,用高效液相色譜法測定氨基酸含量[10]。
1.2.8 SDS-PAGE電泳 采用單向垂直電泳系統,分離膠為12.5%丙烯酰胺,濃縮膠為5%。樣品為少量凍干沉淀物質溶于8mol/L尿素(含有1%(W/V)SDS、1%(V/V)β-巰基乙醇)中。蛋白質含量的測定采用 Bradford 法[11],A、B、C、D 泳道上樣量分別為10、15、15、20μL。
1.2.9 MALDI-TOF/TOF鑒定 切取SDS-PAGE電泳膠上的目標條帶,經過胰蛋白酶消化之后,通過飛行時間串聯質譜分析和蛋白質數據庫(NCBInr)檢索(http://www.matrixscience.com/)進行蛋白質鑒定。
1.2.10 總糖含量測定 將少量凍干樣品分散于蒸餾水中,采用苯酚-硫酸法測定總糖含量[12]。
1.2.11 總多酚含量測定 將少量凍干樣品分散于蒸餾水中,采用Folin-Ciocalteu法測定總多酚含量[13]。
1.2.12 高效陰離子交換色譜-脈沖安培檢測(HPAEC-PAD)分析多糖水解后單糖組成 多糖的水解采用 Krahl等人(2009)的方法[14],取少量凍干物質,加4mL蒸餾水和4mL 4mol/L HCl,于沸水浴中水解1h,冷卻至室溫后加4mL 4mol/L NaOH中和,離心,過0.45μm濾膜,用高效陰離子交換色譜分析單糖含量。色譜柱:CarboPac PA20;檢測器:脈沖安培檢測器;流動相 A:水;流動相 B:250mmol/L NaOH;流動相 C:1mol/L NaAc;流速:0.5mL/min;梯度洗脫條件:0~21.1min,98.2%A、1.8%B;21.1~30min,93.2%A、1.8%B、5%C;30~30.1min,78.2%A、1.8%B、20%C;30.1~50min,20%A、80%B。

表1 不同品種麥芽常規指標及協定麥汁濁度比較Table 1 Comparison of malt quality parameters and Congress wort turbidity between Daner and Metcalfe malt

表2 混濁物質基本成分Table 2 Basic ingredient of the turbid substances
1.2.13 數據分析 所有實驗數據均測定3次,取其平均值。運用SPSS 11.5軟件進行方差分析。
2 結果與討論
2.1 不同品種大麥麥芽麥汁濁度比較
啤酒行業普遍采用協定麥汁指標評價麥芽的品質。單二與Metcalfe協定麥汁指標如表1所示,可以看出Metcalfe麥芽的質量明顯優于單二麥芽,單二麥汁的濁度比 Metcalfe麥汁高 7.82EBC,粘度比Metcalfe麥汁高0.21mPa·s,而30min的過濾體積僅為130mL,不到Metcalfe麥汁的50%。在江蘇啤酒大麥麥芽中,協定麥汁即時濁度高、粘度大與過濾性能差通常同時出現,而混濁物質可能是導致濾層堵塞,引起過濾速度減慢的物質基礎,因此有必要對引起麥汁即時濁度升高的混濁物質進行解析。
2.2 混濁物質主要成分分析及其對麥汁濁度的影響
通過離心收集單二麥汁的混濁物質,經冷凍干燥后,對制備的混濁物質的基本成分分析如表2所示,可以看出麥汁混濁物質主要成分為多糖,其次為蛋白質、多酚,三種物質總量為98.87%。以往對于麥汁混濁物質的研究,主要以顯微染色及反添加的方式定性描述,而本研究首次通過離心得到混濁物質,采用定量分析的方式,全面、真實地描述了麥汁混濁物質。在江蘇麥芽麥汁中,陳繼超[15]通過反添加各種物質的方式發現影響麥汁濁度的物質主要為高分子和中分子蛋白,然而由于反添加物質的結構及分子量與麥汁內源性混濁物質有差異,因此并不能真實地反映出麥汁混濁物質的組成情況。
為進一步驗證多糖引起混濁的能力,對混濁物質采用不同的酶制劑進行酶解處理,將處理后的混濁物質反添加到協定糖化結束前20min的麥汁中,同時以不作處理的混濁物質作為對照,引起麥汁濁度變化的情況如表3所示。可以看出反添加混濁物質后,單二及Metcalfe麥汁濁度分別升高3.44EBC及2.92EBC,使用蛋白酶對混濁物質酶解后并反添加,單二及Metcalfe麥汁濁度分別升高2.98EBC及2.57EBC,使用真菌淀粉酶和β-葡聚糖酶處理后并反添加,單二及Metcalfe麥汁濁度分別升高0.33EBC及0.30EBC。因此,認為引起單二協定麥汁混濁的主要物質為多糖。
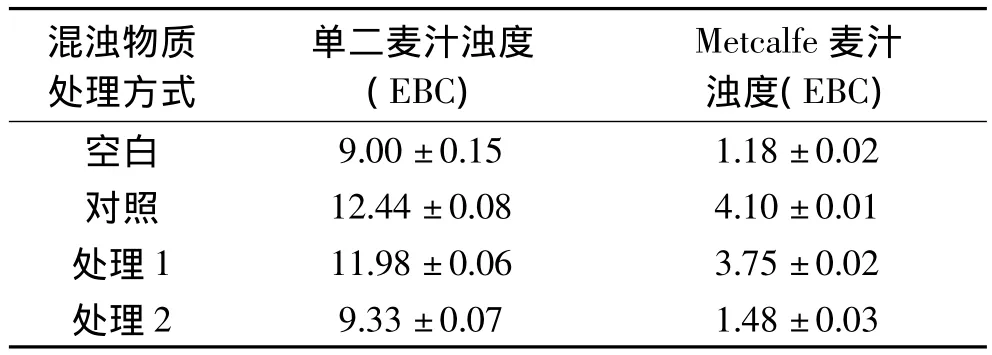
表3 酶解混濁物質對麥汁濁度的影響Table 3 Effect of turbid substances hydrolysed by enzyme on wort turbidity
糖化初始階段添加酶制劑對麥汁濁度的影響如圖1所示。可以看出,蛋白酶及真菌淀粉酶和β-葡聚糖酶都有降低麥汁濁度的作用,加入蛋白酶后,麥汁濁度從對照的9.00EBC降低到8.33EBC,加入真菌淀粉酶和 β-葡聚糖酶后,麥汁濁度從對照的9.00EBC降低到4.57EBC。由此進一步證明,多糖為引起單二麥汁混濁的主要物質。
2.3 多糖的單糖組成分析
多糖的單糖組成分析結果如表4所示,可以看出,凍干物質水解后的單糖主要為葡萄糖,其次為半乳糖、阿拉伯糖、木糖,此外還有少量的鼠李糖及氨基糖。根據麥汁混濁物質的組成情況分析,葡萄糖主要來源于未降解的β-葡聚糖或糊精;阿拉伯木聚糖含量可根據Schwarz提出的公式:阿拉伯木聚糖(AX)=(阿拉伯糖(arabinose)+木糖(xylose))×0.88[16]計算得到,含量為 1.19%(W/W);阿拉伯半乳聚糖肽(AGP)含量為半乳糖的1.516倍[14],為5.31%(W/W)。通常認為β-葡聚糖與阿拉伯木聚糖對麥汁的粘度影響很大,而這些聚糖物質在濃度較高時,會交聯形成網狀結構,進而形成高粘度凝膠,與蛋白、多酚及其它多糖結合形成復雜的混濁物質[17]。阿拉伯半乳聚糖肽是一種非交聯、多分散的大分子物質,在水溶液中只表現出輕微的非理想效應[18]。

表4 混濁物質中單糖組成Table 4 Monosaccharide composition of the turbid substances
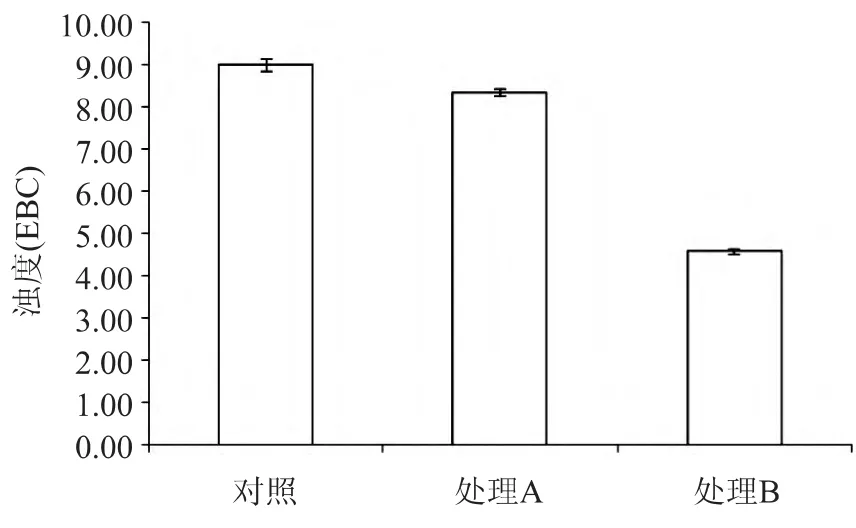
圖1 協定糖化添加酶制劑對單二麥汁濁度的影響Fig.1 Effect of enzyme on Daner wort turbidity in Congress Mashing
2.4 蛋白質組分分析
2.4.1 SDS-PAGE電泳 混濁蛋白的SDS-PAGE電泳圖譜如圖2所示,可以看出麥汁中混濁蛋白包括多個條帶,蛋白分子量主要分布于25~45ku及小于18.4ku兩個部分,這與文獻報道的啤酒混濁蛋白的分子量分布較為一致[8]。蛋白來源方面,從圖2可以看出麥汁混濁蛋白主要來自于麥芽水溶蛋白及醇溶蛋白,其中條帶1和5在麥芽蛋白中沒有明顯對應條帶,可能是由于麥芽蛋白提取方法的限制所致,條帶2和4在麥芽醇溶蛋白中有對應條帶,條帶3和6在麥芽水溶及鹽溶蛋白中有對應條帶,表明這部分蛋白可以抵抗糖化過程中的酶解作用及熱變性,進而出現在過濾后的麥汁中。
2.4.2 混濁蛋白的質譜分析 混濁蛋白的SDSPAGE條帶經胰蛋白酶消化、質譜分析的結果如表5所示,可以看出,混濁蛋白中的條帶1與條帶2都鑒定為AMY2/BASI復合體A鏈,BASI來源于大麥,是一種大麥α-淀粉酶/枯草桿菌蛋白酶抑制劑,它能夠與大麥 α-淀粉酶同工酶2(AMY2)結合形成AMY2/BASI復合體,這是一種蛋白質-蛋白質的復合體,通常認為該復合體與調節大麥中淀粉降解有關[19]。條帶1與條帶2分子量相差較大,鑒定為同一蛋白,這可能是由于AMY2與BASI結合為蛋白復合體,并相互交聯從而形成了分子量較大的物質,而在SDS-PAGE電泳時又沒有打開交聯,從而出現在了電泳圖譜中。同時由于質譜鑒定是以匹配的氨基酸序列為依據,因此條帶1同樣鑒定為AMY2/BASI復合體A鏈。
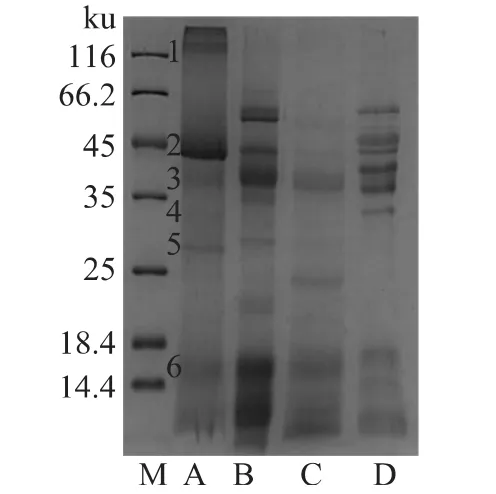
圖2 混濁蛋白的SDS-PAGE分析Fig.2 SDS-PAGE of wort haze proteins
條帶3鑒定為Z4蛋白。Z蛋白屬于絲氨酸蛋白酶抑制劑家族,有Z4蛋白與Z7蛋白兩種。Z蛋白與β-淀粉酶在某種程度上具有一定的聯系,是一種富含賴氨酸的蛋白質,其在制麥及糖化過程中能夠抵抗變性及蛋白酶的水解作用,繼而出現在麥汁中,形成混濁物質[20]。條帶4鑒定為大麥醇溶蛋白γ3。大麥醇溶蛋白是一種富含脯氨酸的蛋白質,根據分子量、硫含量及氨基酸組成的差異,可分為B、C、D及γ四種。金蓓等研究認為與胰蛋白酶抑制劑 CMe、germin E及Z蛋白相比,大麥醇溶蛋白γ3是一種次要的混濁活性蛋白,但是在形成混濁的過程中依然具有關鍵性作用[8,21]。條帶5鑒定為油體鈣蛋白2,這是一種與油脂代謝有關的蛋白,如參與膜融合和脂肪體融合等過程,同時有文獻指出油體鈣蛋白可能具有一種利于蛋白質相互結合的獨特表面[22],這可能與混濁的形成有關。條帶6鑒定為BTI-CMe2.1,是一種氯仿/甲醇可溶蛋白(CM蛋白),屬于胰蛋白酶/α-淀粉酶抑制劑屬,通常分子量較低,在9~16ku之間,且脯氨酸含量較低,在8%左右。這些疏水蛋白或其片段在制麥及糖化過程中能夠抵抗蛋白酶的水解作用而出現在麥汁中,進而形成混濁物質[23]。

表5 混濁蛋白的質譜鑒定結果Table 5 Haze protein identified by mass spectrometry
2.4.3 氨基酸含量分析 混濁蛋白的氨基酸分析結果如表6所示,可以看出麥汁混濁蛋白的氨基酸組成具有一定的特異性,以谷氨酸、天冬氨酸及脯氨酸居多。谷氨酸及脯氨酸通常認為是啤酒混濁蛋白的主要氨基酸[1],而在麥汁混濁蛋白中這兩種氨基酸的含量很豐富,也證實了啤酒混濁蛋白與麥汁混濁蛋白的同源性;麥芽 α-淀粉酶中富含天冬氨酸[24-25],這與麥汁混濁蛋白中天冬氨酸含量豐富相吻合。
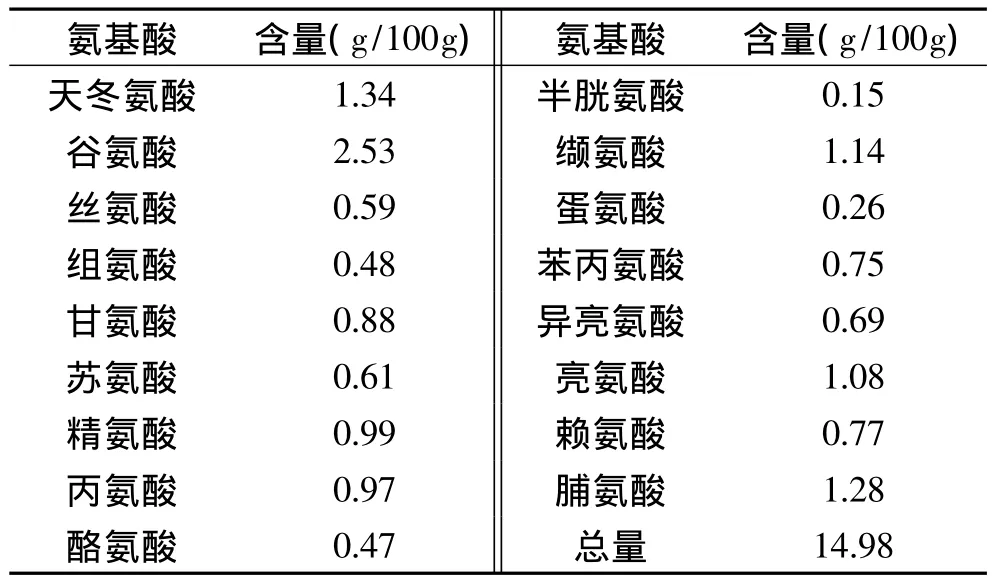
表6 混濁物質中17種氨基酸含量Table 6 Amino acid content of the turbid substances
3 結論
采用SDS-PAGE電泳結合質譜分析、離子交換色譜技術研究了單二麥汁混濁物質中的蛋白質及糖類物質,結果表明:a.引起江蘇單二啤酒大麥麥芽協定麥汁混濁的關鍵性物質為多糖。b.組成混濁多糖的單糖以葡萄糖為主,其次為半乳糖、阿拉伯糖、木糖。c.混濁蛋白研究方面,SDS-PAGE電泳表明混濁物質中蛋白質分子量主要集中于25~45ku及小于18.4ku的兩個部分,質譜分析表明混濁蛋白主要為AMY2/BASI復合體A鏈,此外還有少量的Z4蛋白、大麥醇溶蛋白γ3、油體鈣蛋白2及BTI-CMe2.1。氨基酸組成以谷氨酸、天冬氨酸及脯氨酸居多。后續將對多糖的結構及其與蛋白質是否存在交聯特性等進行研究,以進一步明確多糖引起麥汁混濁的原因。本研究明確了單二麥芽協定麥汁中的混濁成分,對提高麥芽品質、改良大麥品種具有借鑒意義。
[1]Elisabeth S,Martina G,Thomas B.Protein changes during malting and brewing with focus on haze and foam formation:a review[J].European Food Research and Technology,2011,232(2):191-204.
[2]Siebert KJ,Lynn P.Effect of protein-polyphenol ratio on the size of haze particles[J].Journal of the American Society of Brewing Chemists,2000,58(3):117-123.
[3]Speers RA,Jin YL,Paulson AT,et al.Effects of β -Glucan,Shearing and Environmental Factors on the Turbidity of Wort and Beer[J].Journal of the Institute of Brewing,2012,109(3):236-244.
[4]Perretti G,Floridi S,Turchetti B,et al.Quality Control of Malt:Turbidity Problems of Standard Worts Given by the Presence of Microbial Cells[J].Journal of the Institute of Brewing,2012,117(2):212-216.
[5]Zhang TX,Xu P,Sun J,et al.Identification of Biological Wort Turbidity Caused by Microbial Contamination of Gairdner Barley[J].Journal of the American Society of Brewing Chemists,2009,67(1):33-37.
[6]QB/T 1686-2008.啤酒麥芽[S].
[7]吳琪,朱眠.啤酒濁度測定方法及影響因素的探討[J].食品與發酵工業,1994(4):36-43.
[8]Jin B,Li L,Feng ZC,et al.Investigation of the relationship of malt protein and beer haze by proteome analysis[J].Journal of Food Processing and Preservation,2012,36(2):169-175.
[9]GB 5009.5-2010.食品安全國家標準食品中蛋白質的測定[S].
[10]黃雪松,陳磊.不同黃酒部位的沉淀蛋白質氨基酸組成分析[J].食品與發酵工業,2011,37(10):25-27.
[11]Bradford MM.A rapid and sensitivemethod forthe quantitation of microgram quantities of protein utilizing the principle of protein- dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[12]杜秉健,李全宏.南瓜多糖水解工藝優化研究[J].食品工業科技,2011(3):232-236.
[13]孔維寶,樊偉,陸健,等.麥芽制造過程中酚類物質及其相關酶類的變化[J].食品與生物技術學報,2007,26(5):61-65.
[14]Krahl M,Müller S,Zarnkow M,et al.Arabinoxylan and fructan in the malting and brewing process[J].Quality Assurance and Safety of Crops & Foods,2009,1(4):246-255.
[15]陳繼超.酶法解決啤酒生產中使用國產麥芽引起麥汁濁度高的問題的研究[D].廣州:華南理工大學,2011.
[16]Schwarz PB,Han JY.Arabinoxylan content of commercial beers[J].Journal of the American Society of Brewing Chemists,1995,53(4):157-159.
[17]Kontogiorgos V,Ritzoulis C,Biliaderis CG,et al.Effect of barley β-glucan concentration on the microstructural and mechanical behaviour of acid-set sodium caseinate gels[J].Food Hydrocolloids,2006,20(5):749-756.
[18]Fincher G,Sawyer W,Stone B.Chemical and physical properties of an arabinogalactan-peptide from wheat endosperm[J].Biochemical Journal,1974,139(3):535-545.
[19]Nielsen PK,B?nsagerBC,Fukuda K,etal.Barley α-amylase/subtilisin inhibitor:structure,biophysics and protein engineering[J].Biochimica et Biophysica Acta(BBA)- Proteins and Proteomics,2004,1696(2):157-164.
[20]Hejgaard J.Purification and properties of protein Z-a major albumin of barley endosperm[J].Physiologia Plantarum,1982,54(2):174-182.
[21]Jin B,Li L,Feng ZC,et al.Investigation of hordeins during brewing and their influence on beer haze by proteome analysis[J].Journal of Food Biochemistry,2011,35(5):1522-1527.
[22]Tzen JT.Integral Proteins in Plant Oil Bodies[J].ISRN Botany,2012(2012):1-16.
[23]Robinson LH,Juttner J,Milligan A,et al.The identification of a barley haze active protein that influences beer haze stability:Cloning and characterisation of the barley SE protein as a barley trypsin inhibitor of the chloroform/methanol type[J].Journal of Cereal Science,2007,45(3):343-352.
[24]Robert X,Haser R,Svensson B,et al.Comparison of crystal structures of barley alpha-amylase 1 and 2:implications for isozyme differences in stability and activity[J].Biologia,2002(57):59-70.
[25]S?gaard M,Olsen FL,Svensson B.C-terminal processing of barley alpha-amylase 1 in malt,aleurone protoplasts,and yeast[J].Proceedings of the National Academy of Sciences,1991,88(18):8140-8144.

