NO水平下降通過氧化應激引起人胎盤滋養細胞凋亡
王艷華,張慧萍,田 玨,周龍霞,陳久凱,馬文斌,孔繁琪,趙 麗,劉現梅,韓學波,楊曉玲,姜怡鄧
(寧夏醫科大學1.檢驗學院、2.基礎醫學院、3.總醫院,寧夏 銀川 750004)
妊娠期高血壓疾病(hypertension disorder complicating pregnancy,HDCP)是孕婦因妊娠后內環境改變致滋養細胞功能障礙為主要病理特征的妊娠期特有疾病之一[1],是導致孕產婦和圍生兒死亡的重要原因,但其病因至今未明。研究發現,細胞凋亡在滋養細胞的浸潤、遷移及胎盤種植的過程中可能發揮重要作用,且與HDCP發病機制密切相關[2]。胎盤是母體與胎兒間進行物質交換的關鍵靶器官,滋養細胞凋亡在胎盤形成、發育以及整個妊娠過程中起重要作用。目前,研究認為NO在調節胎盤血管阻力,保持子宮胎盤血液循環暢通及調節滋養細胞分化等方面具有重要作用[3]。另外,有研究報道,胎盤局部NO水平下降,可直接導致胎盤組織發生上述影響滋養細胞的病理改變,因此,可認為胎盤局部NO合成下降與胎盤滋養細胞病理改變密切相關。同時,研究表明,NO參與細胞凋亡的生物調節[4],氧化應激是造成細胞凋亡的重要環節[5]。然而,NO是否可以通過氧化應激調控滋養細胞凋亡未見報道。因此,本實驗選取人胎盤滋養細胞為研究對象,通過一氧化氮合酶(NOS)抑制劑N-硝基-L-精氨酸甲酯(L-NAME)有效抑制NO的合成,觀察NO水平下降對人胎盤滋養細胞凋亡的影響,并探討氧化應激在其中所起的作用。
1 材料與方法
1.1 試劑及細胞培養 人胎盤滋養細胞株(HTR-8)來源于復旦IBS細胞庫;DMEM F12培養基、胎牛血清、100 kU·L-1青霉素和0.1 g·L-1鏈霉素均購自Gibco公司;L-NAME購自Sigma公司;Annexin VFITC細胞凋亡檢測試劑盒購自貝博試劑公司;一氧化氮(NO)、總抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)測定試劑盒均購自南京建成生物工程研究所;BCA蛋白含量檢測試劑盒購自南京凱基生物科技發展有限公司。采用DMEM F12培養基培養細胞(含10%胎牛血清、100 kU·L-1青霉素和0.1 g·L-1鏈霉素),培養條件為37℃,5%的CO2。
1.2 實驗設計及分組 將HTR-8細胞分為對照組(0μmol·L-1的 L-NAME)和實驗組,每組 3例樣品。實驗組分別用不同濃度的L-NAME(10、100、500、1 000μmol·L-1)干預。
1.3 四甲基偶氮唑藍染色法(M TT法)測定細胞存活率 取對數生長期的細胞,制成每毫升5×104個細胞的懸液接種,培養24 h后,各組分別加入相應藥物孵育24、48 h,吸棄液體,加入終濃度0.5 g·L-1MTT 100μl,繼續培養4 h,棄去上清液,加入DMSO 150μl,微量震蕩10min,于酶標儀上490 nm測定各孔吸光度(A)值,通過與對照組比較求出存活率。存活率/%=實驗組吸光度(A)值/對照組吸光度(A)值×100%。
1.4 Annexin V-FITC檢測細胞凋亡 用不含EDTA的胰酶消化細胞,300×g,2~8℃,離心5min,棄培養基。冷PBS洗滌細胞2次。用400μl 1×Annexin V結合液懸浮細胞,濃度大約為1×109cells·L-1。在懸液中加入5μl Annexin V-FITC染色液,輕輕混勻后,于2~8℃避光孵育15 min,加入10μl PI染色液后混勻,避光孵育5min,立即用美國BD公司FACSCalibur流式細胞儀檢測。
1.5 細胞電鏡標本制備 細胞經胰酶消化后,收集于離心管中,800 r·min-1離心沉淀,用預冷的2.5%戊二醛磷酸緩沖液(pH 7.4)固定30 min,0.1 mol·L-1磷酸緩沖液洗15 min,重復3次;1%鋨酸(pH 7.4)固定30 min,再用0.1 mol·L-1磷酸緩沖液洗 15 min,共 3次;乙醇逐級脫水后,浸透,Epon812膠囊內包埋,聚合;超薄切片,醋酸鈾、檸檬酸鉛雙重染色;采用日立HITACHIH-7650透射電鏡觀察并取圖。
1.6 NO、T-AOC、SOD和MDA的檢測 用橡皮刮子刮下細胞,1 000 r·min-1,離心 10 min,棄上清,1 ml PBS輕輕吹打,1 000 r·min-1,離心 10 min,棄上清,重懸于0.5 ml緩沖液中,超聲破碎細胞。上述樣本用凱基BCA蛋白含量檢測試劑盒測定蛋白濃度,按相應試劑盒說明書檢測NO、T-AOC、SOD和MDA水平,并計算結果。
1.7 統計學處理 用Prism 5.0統計軟件進行統計學分析,結果以ˉx±s表示,多樣本均數間比較采用One-way ANOVA檢驗,組間兩兩比較用 Student-Newman-Keuls檢驗,兩個變量相關性分析采用Pearson相關系數分析。
2 結果
2.1 L-NAME對人胎盤滋養細胞存活率的影響不同濃度的L-NAME干預HTR-8細胞24、48 h后,MTT法檢測并計算各組細胞存活率。干預24 h對細胞的存活率無明顯影響,然而,干預HTR-8細胞48 h后,與對照組比較,從 100μmol·L-1的 LNAME組開始細胞增殖受到明顯抑制,其細胞存活率呈現隨著劑量增大而逐漸下降的趨勢,結果提示L-NAME對HTR-8細胞生長有抑制作用。見Fig 1。
2.2 L-NAME引起人胎盤滋養細胞NO水平下降與對照組比較,100、500、1 000μmol·L-1的 LNAME組滋養細胞中NO水平明顯降低(P<0.01)。見Fig 2。
2.3 L-NAME對人胎盤滋養細胞凋亡的影響 不同濃度的L-NAME干預HTR-8細胞后,Annexin-V FITC染色、流式細胞定量定性分析結果顯示:隨著L-NAME濃度的增加,細胞凋亡數也逐漸增加(P<0.01),呈劑量依賴關系。以上提示,L-NAME可誘導HTR-8細胞發生凋亡。見Fig 3。
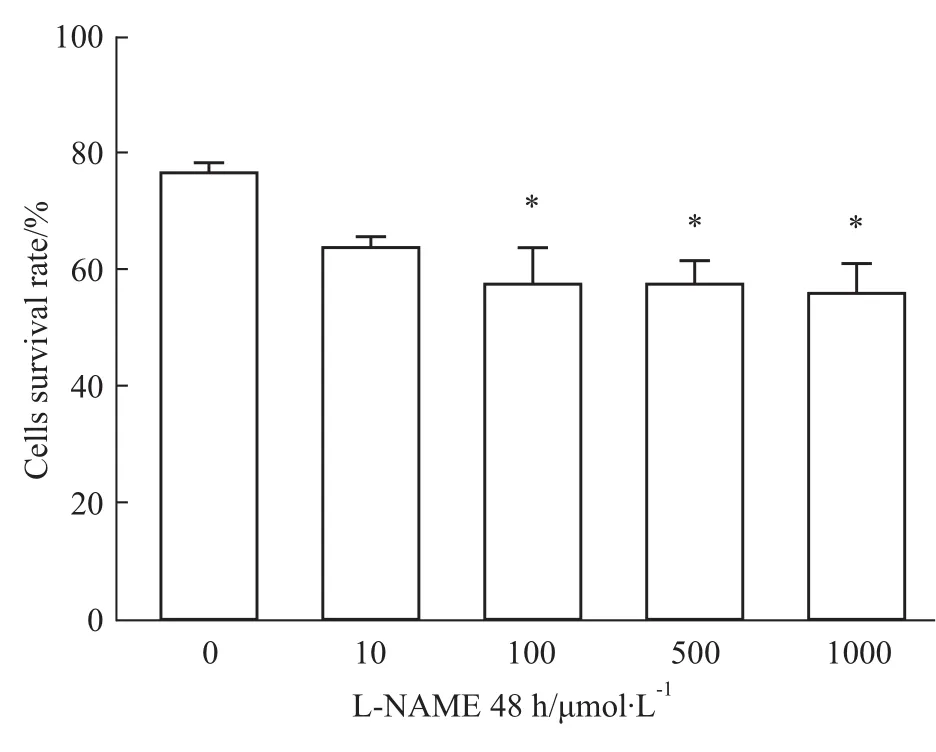
Fig 1 Effect of L-NAME on survival rate of HTR-8 cells*P<0.05 vs control group
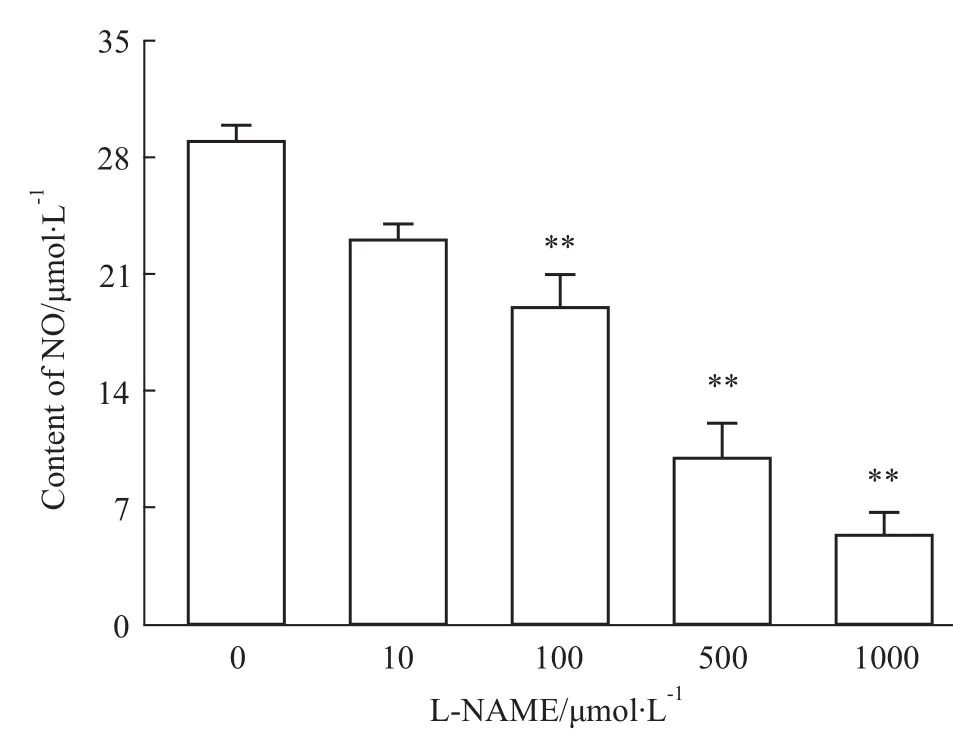
Fig 2 Levels of NO after different concentrations of L-NAME intervenes HTR-8 cells**P<0.01 vs control group
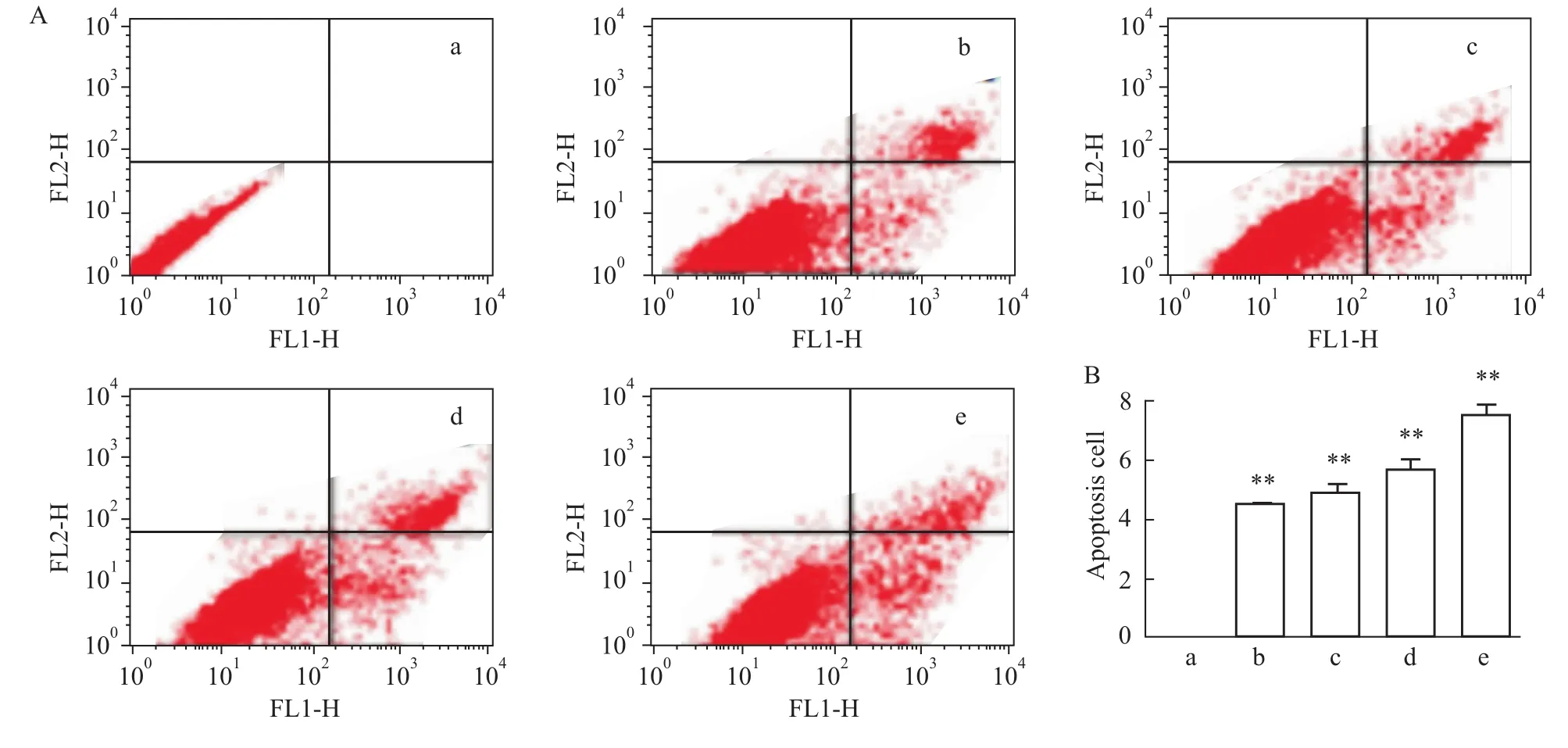
Fig 3 Effects of L-NAME on HTR-8 cells apoptosisA,B:Quantification of cell apoptosis by flow cytometer.In each panel,the lower rightquadrant indicated the apoptotic cells.a:Control group;b:10 μmol·L-1 L-NAME group;c:100μmol·L-1 L-NAME group;d:500μmol·L-1 L-NAME group;e:1 000μmol·L-1 L-NAME group.**P<0.01 vs control group
2.4 NO水平與細胞凋亡數相關性分析 為了進一步明確NO水平降低與凋亡的關系,將NO水平與細胞凋亡數進行相關性分析,結果顯示:NO水平與細胞凋亡數(r=-0.5210)呈負相關,因此,NO水平降低與滋養細胞凋亡存在因果關系。見Fig 4。
2.5 透射電鏡觀察滋養細胞超微病理結構改變對照組細胞膜完整,細胞核核膜光滑,染色質均勻,粗面內質網及高爾基器豐富,線粒體內外膜完整,嵴結構清楚;10μmol·L-1L-NAME組可見細胞膜完整,細胞核核膜完整,核仁明顯,細胞器有輕度擴張或可見致密型線粒體;100μmol·L-1L-NAME組染色質凝集或邊集,線粒體腫脹或濃縮、嵴斷裂或溶解,甚至消失,形成空泡,可見凋亡小體(箭頭所指);500μmol·L-1L-NAME組細胞膜完整,染色質略微聚集凝固,細胞質內有大量空泡,線粒體腫脹、嵴斷裂或溶解,甚至消失;1 000μmol·L-1L-NAME組細胞核形態不規則,核膜固縮不規則,染色質凝集或邊集,似凋亡前體(箭頭所指),細胞質內有大量空泡。見Fig 5。
2.6 不同濃度L-NAME干預HTR-8細胞后TAOC、SOD及MDA的變化 結果顯示,與對照組比較,100、500、1 000μmol·L-1的 L-NAME組細胞中T-AOC、SOD水平明顯降低(P<0.05),而 500、1 000μmol·L-1的L-NAME組細胞中MDA的含量明顯升高(P<0.05)。見Fig 6。
2.7 T-AOC、SOD及MDA含量與細胞凋亡數相關性分析 為了進一步確定氧化應激在HTR-8細胞凋亡中起作用,將細胞內T-AOC、SOD及MDA含量與細胞凋亡數進行相關性分析,結果顯示:細胞凋亡數與 T-AOC(r=-0.3212)、SOD(r=-0.2779)水平呈負相關,與MDA(r=0.2807)含量呈正相關。見Fig 7。
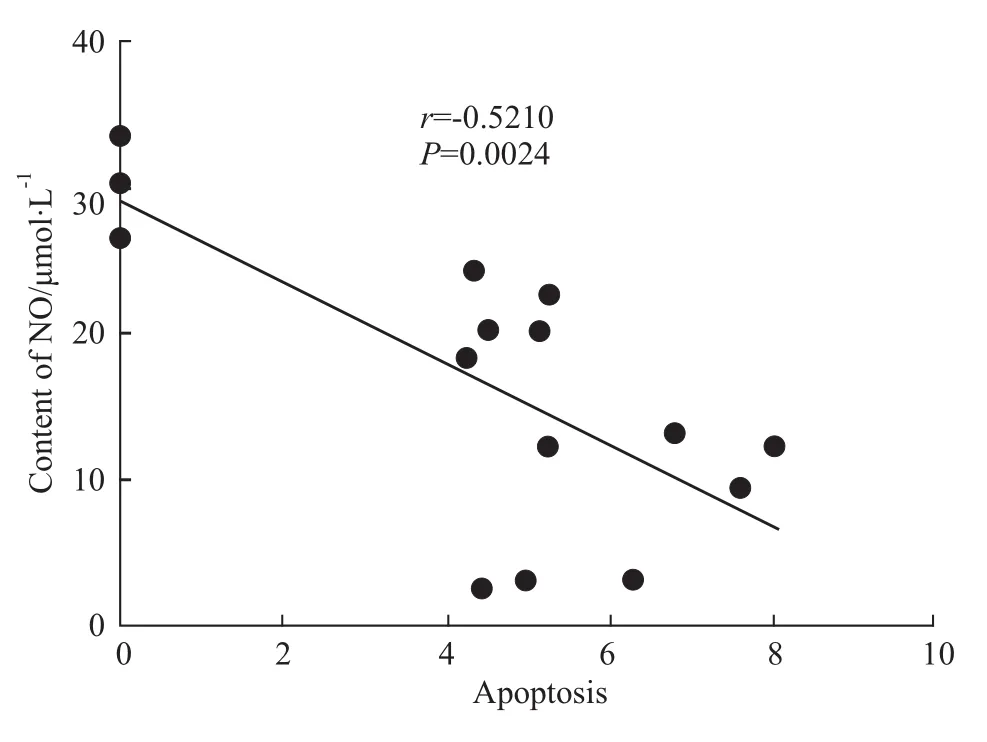
Fig 4 Scatter p lots of Spearman correlation coefficient corresponding between apoptosis and NO content in HTR-8 cells
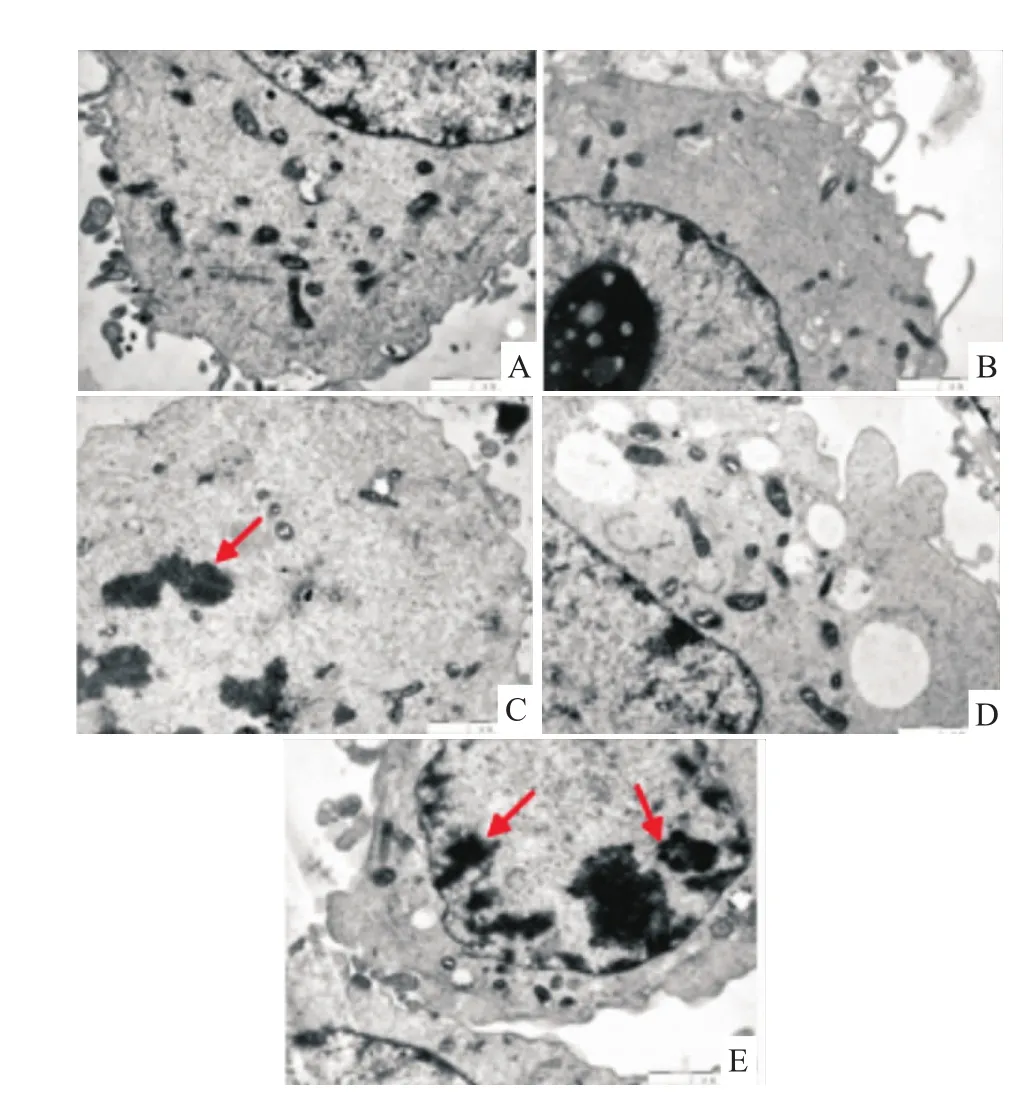
Fig 5 Characteristics of trophoblast cell ultrastructure under electron m icroscopeA:Control group;B:10μmol·L-1 L-NAME group;C:100μmol·L-1 L-NAME group;D:500μmol·L-1 L-NAME group;E:1 000μmol·L-1 L-NAME group
3 討論
近年來研究已證實,妊娠過程中胎盤組織存在滋養細胞凋亡現象,且對滋養細胞遷移、浸潤及胎盤種植有重要調節作用。胎盤滋養細胞凋亡過度可能導致胎盤淺著床,造成子宮螺旋動脈重建失敗,最終出現胎盤血液灌注量減少而引發HDCP的發生,提示胎盤滋養細胞的凋亡現象可能是HDCP發生、發展的核心環節[2],但滋養細胞凋亡的機制有待研究。研究表明[6],HDCP患者血漿NO較正常孕婦明顯下降,其下降的程度與病情嚴重程度呈正比,提示,妊娠期間NO分泌不足可能是HDCP的重要致病因素之一。適量的NO水平是保證子宮胎盤循環低阻、低壓、高流量的關鍵,這是機體對正常妊娠的保護性機制。另外,有研究報道,NO對細胞凋亡起著雙向調控作用,在某些細胞中,NO可以促進凋亡,而在另外一些細胞(如肝細胞)中卻可以抑制凋亡。例如,NO可介導一些細胞保護性基因如熱休克蛋白HSP70和 HSP32的表達,從而抵抗 TNF-α、氧離子和亞硝酸鹽離子等誘導的細胞凋亡[7]。NO水平下降是否可調控滋養細胞凋亡及其機制有待進一步研究,因此,本研究采用 NOS抑制劑(LNAME)干預人胎盤滋養細胞,間接觀察NO水平降低對人胎盤滋養細胞凋亡的影響。研究結果顯示:不同濃度的L-NAME干預HTR-8細胞后,導致細胞存活率及NO水平的降低,并引起HTR-8細胞發生凋亡,電鏡結果在100、1 000μmol·L-1L-NAME組可見凋亡小體及凋亡前體,而500μmol·L-1LNAME組凋亡不明顯,這可能由于電鏡有其局限性,樣品定位和圖像分析困難,觀察視野小,視野可能沒有捕捉到,結合流式細胞儀檢測細胞凋亡結果,500 μmol·L-1L-NAME組存在明顯的凋亡。為了進一步明確NO水平與滋養細胞凋亡的關系,將HTR-8細胞內NO水平與細胞凋亡數進行相關性分析,NO水平與細胞凋亡數呈負相關。因此,NO水平降低與滋養細胞凋亡存在因果關系,但其機制有待探討。
已有證據表明,氧化應激在HDCP發病機制中也起著關鍵作用,和正常妊娠相比,HDCP患者胎盤中脂質過氧化物增加,抗氧化酶減少[8]。研究表明,活性氧所致的氧化應激是造成細胞凋亡的重要環節。正常情況下,機體內活性氧的產生和清除處于動態平衡狀態,所以對機體并無有害影響。而多種有害刺激可打破這種平衡,致活性氧大量生成而超過抗氧化系統的清除能力,機體就會形成氧化應激狀態,促進細胞凋亡甚至導致病理損傷。NO是體內產生的血管舒張因子,除可調節血壓外,在清除自由基等方面也起著重要作用。研究表明[9],NO以多種形式保護細胞免受過氧化損傷,包括與多種脂質過氧化產物以近擴散速率進行反應,阻止脂質過氧化鏈,甚至抑制細胞凋亡。為了證實NO水平降低引起滋養細胞凋亡是否通過氧化應激,我們檢測了氧化應激指標。正如結果所示,100、500、1 000 μmol·L-1的L-NAME組 T-AOC、SOD水平降低,而MDA的含量升高。SOD是體內抗氧化防御系統的第一道防線,在阻止自由基和脂質過氧化對機體的損害方面起關鍵作用[10]。SOD活性下降引發脂質過氧化物在金屬離子存在下催化裂解產生MDA。通常MDA用來間接反映氧自由基的存在及對細胞的損傷程度,MDA對細胞有毒性作用,可與蛋白質分子內和分子間交聯,誘發細胞凋亡[11]。為了進一步確定氧化應激在HTR-8細胞凋亡中起作用,將HTR-8細胞內T-AOC、SOD及MDA含量與細胞凋亡數進行相關性分析,結果顯示,細胞凋亡數與HTR-8細胞內T-AOC、SOD含量呈負相關,與MDA含量呈正相關,提示NO水平降低引起HTR-8細胞發生氧化應激,促進滋養細胞凋亡可能是HDCP致病的機制之一。
綜上所述,NO水平降低能夠誘導人胎盤滋養細胞發生凋亡,而NO水平降低引起的氧化應激可能是其重要機制之一,這對于深入探討NO分泌不足引起HDCP提供了一定的實驗依據。
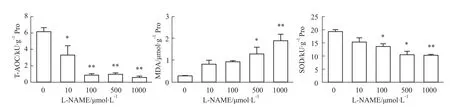
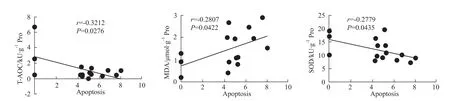
Fig 7 Scatter p lots of Spearman correlation coefficient corresponding between apoptosis and T-AOC,SOD and MDA content in HTR-8 cells
參考文獻:
[1] Longtine M S,Barton A,Chen B,et al.Live-cell imaging shows apoptosis initiates locally and propagates as a wave throughout syncytiotrophoblasts in primary cultures of human placental villous trophoblasts[J].Placenta,2012,33(12):971-6.
[2] 劉美玲,彭景梗.滋養層細胞凋亡調控的研究[J].生理科學進展,2004,35(4):335-7.
[2] Liu M L,Peng JG.Study on the regulation of apoptosis of trophoblast cells[J].Progr Physiol Sci,2004,35(4):335-7.
[3] Sladek SM,Magness RR,Conrad K P.Nitricoxide and pregnancy[J].Am JPhysiol,1997,272(2Pt2):R441-63.
[4] Kim YM,Talanian R V,Billiar TR.Nitric oxide inhibits apoptosis bypreventing increases in caspase-3-like activity via two distinct mechanisms[J].JBiol Chem,1997,272(49):31138-48.
[5] 張駿艷,姚 華,李 晟,等.Urantide對大鼠心肌缺血/再灌注后心肌細胞凋亡的作用及機制研究[J].中國藥理學通報,2013,29(5):648-54.
[5] Zhang JY,Yao H,Li S,et al.Regulation of urantide in PI3K/Akt and PKC signaling transduction inmyocardial ischemia-reperfusion injury to relieve the cardiomyocyte apoptosis in rats and itsmechanism[J].Chin Pharmacol Bull,2013,29(5):648-54.
[6] Shaarnash A H,Elsonosy E D,ZakhariM M,et al.Placental nitric oxide synthase(NOS)aetivity and nitric oxide(NO)production in normal pregnancy,precelampsia and eclampsia[J].Int JGynaecol Obstet,2001,72(2):127-33.
[7] Kim YM,de Vera M E,Watkins SC,etal.Nitric oxide protects culured rat hepatocytes from tumor necrosis factor-alpha-induced apoptosis by inducing heatshock protein 70 expression[J].JBoil Chem,1997,272(2):1402-11.
[8] Huang Q T,Zhang M,Zhong M,et al.Advanced glycation end products as an upstream molecule triggers ROS-induced sFlt-1 production in extravillous trophoblasts:a novel bridge between oxidative stress and preeclampsia[J].Placenta,2013,34(12):1177-82.
[9] BeligniM V,Fath A,Bethke PC,et al.Nitric oxide acts as an antioxidant and delays programmed cell death in barley aleurone lay-ers[J].Plant Physiol,2002,129(4):1642-50.
[10]Zelko IN,Mariani T J,Folz R J.Superoxide dismutasemultigene family:a comparison of the CuZn-SOD(SOD1),Mn-SOD(SOD2),and EC-SOD(SOD3)gene structures,evolution,and expression[J].Free Radic Biol Med,2002,33(3):337-49.
[11]張 敏,朱 穎,胡 波,等.A-actinin-4與多柔比星腎病大鼠氧化應激狀態的關系[J].實用兒科臨床雜志,2009,24(5):358-60.
[11]Zhang M,Zhu Y,Hu B,et al.The relationship between A-actinin-4 and the oxidative stress of doxorubicin nephropathy rats[J].J Appl Clin Pediatr,2009,24(5):358-60.