低氧誘導因子-3α的研究進展
鹿 輝,尹 強,王 榮,謝 華,李文斌,賈正平,張娟紅
(蘭州軍區蘭州總醫院全軍高原損傷防治重點實驗室,甘肅蘭州 730050)
低氧誘導因子(hypoxia-inducible transcription factor,HIF)最早是由Semenza等[1]于1992年在研究促紅細胞生成素基因時發現的。HIF是細胞應對氧氣水平降低時的主要調節因子,調控依賴氧氣水平相關基因的表達[2]。這些基因主要參與造血、血管生成、離子轉運、葡萄糖的利用、細胞外基質的合成、細胞的增殖、生存及凋亡和腫瘤的發生等過程[3-4]。HIF是由一個不穩定的 α亞基(HIF-α)和一個穩定的β亞基(HIF-β)組成的二聚體,具有結合靶基因的低氧反應元件(hypoxia response elements,HREs)的能力,從而發揮調控作用。HIF-α和HIF-β亞基均屬于 bHLH-PAS(bHLH,basic helix-loop-helix;PAS,Per-ARNT-Sim;Per,period circadian protein;ARNT,aryl hydrocarbon receptor nuclear translocator protein;Sim,single-minded protein)蛋白家族的成員[5]。序列同源性HIF-α亞基在人體中目前認為有3種:HIF-1α(由基因 HIF1A編碼)、HIF-2α(由基因 EPAS1編碼)和HIF-3α(由基因HIF3A編碼HIF-3α的多種剪接變異體)[6],三者均受氧濃度調節,是調節HIF活性的功能亞單位[8]。。相對于HIF-1α和HIF-2α,對HIF-3α的認識和研究還比較匱乏。HIF-3α存在多種剪切變異體,其功能也不盡相同,調控包括低氧應激在內的多種生理活動。本綜述將系統地介紹HIF-3α的結構、表達調控及其在多種生理活動中的調控作用。
1 HIF-3α的結構
HIF-1α和HIF-2α亞基具有相似的結構域,均具有1個N端bHLH結構域,2個PAS結構域,氧氣依賴降解結構域(oxygen-dependent degradation domain,ODD)以及 N端和 C端的轉錄激活結構域(transactivation domain,TAD)組成,N端的TAD結構域的部分序列與ODD重疊[9]。1998年,在老鼠體內首次發現了HIF-α的第3種亞型HIF-3α[10],在人體內于2001年首次發現HIF-3α[11]。這種新的蛋白與HIF-1α和HIF-2α的bHLH-PAS區域有55%的相似性[10]。與HIF-1α和HIF-2α相似,HIF-3α中也含有1個ODD結構域和1個N-TAD結構域,但沒有C-TAD結構域(Fig 1)。
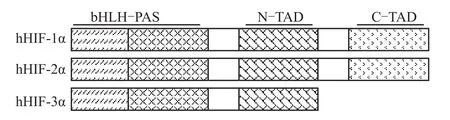
Fig 1 Structural alignment of human HIF-1α,HIF-2α and HIF-3αsubunits
2 人類 HIF-3α(hHIF-3α)的剪接變異體
人類HIF-3α(hHIF-3α)有8種剪接變異體,其結構域見Fig 2,與鼠 HIF-3α(mHIF-3α)相似,人類 HIF-3α基因包含19個內含子,長度大約是43 kb的堿基長度,位于染色體的19q13.2的位置。3個特別的外顯子1a、1b和1c很可能含有8種剪接變異體的轉錄起始位點。外顯子2編碼bHLH結構域,外顯子3-9編碼PASa、PASb和PAC(PAS-associated C-terminal domain)結構域,外顯子11的3′末端部分、整個的外顯子12和外顯子13的5′末端部分編碼ODD結構域,外顯子14a和16編碼亮氨酸拉鏈結構域(leucinezipper,LZIP)[6]。
hHIF-3α1的序列從外顯子1c開始,到外顯子16終止。hHIF-3α1編碼668個氨基酸長度的蛋白質,含有N-TAD結構域,但并不含有C-TAD結構域。有趣的是,與HIF-1α、HIF-2α及其他hHIF-3α的變異體不同的是,hHIF-3α1含有獨特的亮氨酸拉鏈(leucine zipper,LZIP)結構域。LZIP結構具有介導與DNA結合和蛋白質-蛋白質相互作用的功能。hHIF-3α1的另外一個特殊的結構是,在ODD和LZIP結構域的上游具有LXXLL(Leu-Xaa-Xaa-Leu-Leu)基序。LXXLL基序主要在核受體的共因子中發現,是蛋白質相互作用的位點。LZIP和LXXLL結構在HIF-1α和HIF-2α中都不存在,表明hHIF-3α1可能具有結合啟動子序列的能力或者結合不被HIF-1α和HIF-2α識別的新蛋白質的能力。hHIF-3α2從外顯子1a開始,終止于外顯子13a,不包含外顯子1b和1c,編碼632個氨基酸長度的蛋白質。hHIF-3α2的結構與hHIF-3α1非常相似,但缺少LZIP結構域及其上游的LXXLL基序。hHIF-3α4從外顯子1a開始,終止于不完整的內含子8,內含子7沒有被剪切掉。編碼363個氨基酸長度的蛋白質,只含有 bHLH、PASa和 PASb結構域,缺少 N-TAD、CTAD、ODD和LZIP結構域及LXXLL基序,表明hHIF-3α4可能作為hHIF調控系統的負調控因子。hHIF-3α6從外顯子1b開始,缺少外顯子3和hHIF3α4相似,含有內含子7并終止于內含子8,hHIF-3α6蛋白只包含 C末端的結構域PASb。hHIF-3α7和 hHIF-3α8結構相似,但 hHIF-3α7缺少LZIP結構域。hHIF-3α9和 hHIF-3α1結構相似,差別僅在于外顯子1的不同。值得注意的是hHIF-3α10,其編碼序列被內含子1所阻斷,因此僅編碼7個氨基酸[6-7]。
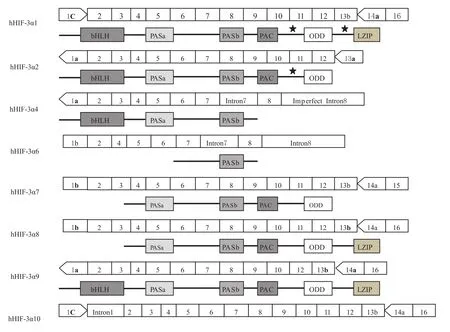
Fig 2 Multiple spliced variants of the human HIF-3α,Asterisk represents the conserved LXXLL motif
3 HIF-3α的基因表達
急性缺氧(12%O2,2 h)對 HIF-1α、HIF-2α和 HIF-1β的mRNA水平在心、肺、腎和骨骼肌組織中的表達沒有明顯的影響,但在上述組織中卻強烈地誘導HIF-3α的mRNA表達。雖然5個星期的間歇性缺氧訓練(intermittent hypoxic training,IHT)可以誘導HIF-3α的mRNA在上述組織的上調表達,但是IHT后的急性缺氧除了在骨骼肌組織可以誘導HIF-3α的mRNA表達上調外,在其他組織中HIF-3α的mRNA都沒有被誘導。這說明IHT抑制了急性缺氧在心、肺、腎組織中對 HIF-3α的mRNA的誘導作用[12]。hHIF-3α4被認為是hHIF調控系統的負調控因子。在低氧的刺激下,HIF調控的基因將會被激活從而應對由缺氧造成的細胞損傷,作為HIF系統的負調控因子hHIF-3α4將會是被抑制的。在缺氧4 h的條件下,利用實時定量PCR測定HepG2肝癌細胞和HEK293A人胚腎細胞中內源性的hHIF-3α4的表達水平,與對照組相比分別降低了75%和50%[13]。這說明hHIF-3α4作為HIF系統的負調控因子,在低氧狀態下是被抑制的,從而使細胞能夠表達氧應激相關基因來應對低氧應激。大鼠mHIF-3α(mHIF-3α)的mRNA水平可在急性缺氧的情況被誘導表達。
令人感到興奮的是,mHIF-3α除了被低氧誘導外,還可以被其他因素誘導。文獻報道[14],mHIF-3α可以由胰島素和2-脫氧-D-葡萄糖誘導表達。這提示,mHIF-3α除具有參與低氧應激的功能外,還可能具有其他方面的功能,例如可能在糖代謝的調節方面發揮重要的作用。
4 HIF3α4的負調控作用
HIF-3α4缺少N-TAD、C-TAD和 ODDD結構域,因此被認為是HIF系統的負調控因子。文獻報道,HIF-3α4可以與HIF-1α結合,從而降低了 HIF1復合物的水平,對hHIF-1α起負調控的作用。HIF-3α4可以抑制HIF-1α/HIF-β復合物與靶基因HREs序列區的結合,從而抑制了HIF-1α調控的相關基因的表達,起到負調控的作用[13]。利用HEK293A研究發現,HIF-3α4可以與HIF-2α相結合,從而降低HIF2復合物的量,降低HIF-2α的調節作用。研究表明,HIF-3α4與HIF-2α相結合后將明顯降低HIF-2α與靶基因HREs序列區的結合,從而抑制了相關基因的表達,起到負調控的作用[15]。HIF-3α4也可以與 HIF-β相結合,可以同時減少體內HIF1和HIF2復合物的量,對HIF-1α和HIF-2α同時起到負調控作用[13,15]。
5 HIF-3α在肺發育過程中的作用
肺的發育是在相對缺氧的條件下進行的,HIF信號通路在肺的發育過程中起了重要的作用。基因HIF3α/NEPAS/IPAS的缺失會導致剛出生小鼠肺重塑功能的缺損[16]。在小鼠肺上皮細胞中表達HIF-3α會導致后期支氣管形態的缺陷、肺泡的數量降低和改變上皮細胞類型的分化。實驗表明,HIF-3α基因的表達,會使Clara細胞、肺泡Ⅰ型和Ⅱ型細胞的數量有所減少,也使基底細胞處在非經典的空間位置。HIF-3α在小鼠的肺的發育過程中發揮作用,主要的機制是選擇性地抑制了HIF-2α基因的表達,并上調Sox2、Rarβ和Foxp2基因的表達[17]。Sox2基因可以直接影響基底細胞的外形[18],Rarβ基因敲除小鼠表現為肺泡提前分隔,肺泡數量也是正常小鼠的兩倍。所以,HIF-3α上調Rarβ基因,從而抑制了小鼠的肺在發育過程中肺泡數量的增加。Foxp2基因具有抑制Ccsp和遠端上皮細胞標記(Spc,T1α)的表達作用[19]。這解釋了HIF-3α表達后,Clara細胞、肺泡Ⅰ型和Ⅱ型細胞數量減少的原因。
6 HIF-3α在脂肪細胞分化中的作用
HIF-3α除了在肺的發育過程中發揮重要的作用之外,在其他組織的發育過程中也具有重要的作用。HIF-3α在3T3-L1細胞的脂肪細胞分化過程中被誘導表達,說明可能是脂肪細胞分化的促進因子,在脂肪細胞的分化過程中發揮重要的作用。基因芯片分析實驗表明,當HIF-3α過量表達時,兩個已知的脂肪細胞分化相關基因,aP2和AMPKγ1表達是上調的。脂肪細胞分化相關基因的表達上調,可能是由于HIF-3α的LZIP結構域能夠激活脂肪細胞相關基因的表達造成的[20]。
7 HIF-3α在增強耐力中的負調控作用
抑制HIF-3α的mRNA水平將明顯提高大鼠的身體耐力。除了IHT可以抑制HIF-3α的mRNA水平外,耐力訓練(endurance training,ET)也可以抑制 HIF-3α的 mRNA水平。實驗表明大鼠的HIF-3α的mRNA水平在ET聯合IHT時只有空白對照組的15%,只進行ET時為對照組的30%。IHT后的ET訓練,大鼠表現出最高的身體耐力水平。利用RNA干擾技術,在大鼠的比目魚肌和腓腸肌中抑制HIF-3α的表達,可以明顯的提高大鼠的身體耐力。這說明HIF-3α在大鼠身體耐力增強中具有重要的負調控作用[12]。
8 HIF-3α4在腦膜瘤中的作用
腦膜瘤是血管最豐富的腦瘤之一,有效抑制腦膜瘤的血管生成是一種有效的新療法。HIF-1α和HIF-2α在腫瘤的血管生成中具有重要的作用,而HIF-3α4被認為是上述兩個α亞基的負調控因子。最近的研究表明,在腦膜瘤中HIF-3α4的表達是受到抑制的,這是由于 HIF-3α4的啟動子區DNA的甲基化導致的。在富血管腦膜瘤中誘導HIF-3α4高表達,可以有效地抑制腦膜瘤的血管生成、細胞分化和物質代謝,顯著地阻滯腦膜瘤的生長。因此,HIF-3α4在腦膜瘤中發揮重要的作用,是潛在的治療腦膜瘤的潛在分子靶點[21]。
9 總結
HIF是細胞應對氧氣水平降低時的主要調節因子,HIF-1α、HIF-2α和HIF-3α是HIF的3種活性亞基。近年來,對前兩種活性亞基,特別是HIF-1α進行了大量的研究工作,對這兩個亞基的基因分布及表達調控機制、激活和降解機制以及參與生理活動的機制都有深入的了解,相比前兩個亞基而言,對HIF-3α的研究和認識還比較有限。通過最近幾年的研究表明,人體的HIF-3α具有6種剪切變異體,每一種的結構都不一樣,其發揮的功能也可能不一樣。值得注意的是,hHIF-3α4是負調控因子,對HIF信號通路系統起負調控作用,使其與其他亞基相比具有獨特性。研究還提示,HIF-3α呈現出功能的多樣性,除了參與低氧應激的反應外,還參加了體內的其他生理過程,這也是與HIF-1α和HIF-2α不同的。例如HIF-3α參與組織和器官的分化和發育,以及糖代謝的過程等。由目前的實驗結果,我們認識到HIF-3α的功能是復雜的,具有獨特性。因此,深入研究HIF-3α的功能及其作用機制是及其必要的,將會為腫瘤和高原疾病的治療提供新的思路和策略。
參考文獻:
[1]Semenza G L,Wang G L.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J].Mol Cell Biol,1992,12(12):5447-54.
[2]Kaelin W G Jr,Ratcliffe P J.Oxygen sensing by metazoans:the central role of the HIF hydroxylase pathway[J].Mol Cell,2008,30(4):393-402.
[3]Weidemann A,Johnson R S.Biology of HIF-1alpha[J].Cell Death Differ,2008,15(4):621-7.
[4]Semenza GL.HIF-1:upstream and downstream of cancer metabolism[J].Curr Opin Genet,2010,20(1):51-6.
[5]Wang G L,Jiang B H,Rue E A,Semenza G L.Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PASheterodimer regulated by cellular O2tension[J].Proc Natl Acad Sci USA,1995,92(12):5510-4.
[6]Pasanen A,Heikkil M,Rautavuoma K,et al.Hypoxia-inducible factor(HIF)-3αis subject to extensive alternative splicing in human tissues and cancer cells and is regulated by HIF-1 but not HIF-2[J].Int J Biochem Cell Biol,2010,42:1189-200.
[7]Heikkila M,Pasanen A,Kivirikko K,Myllyharju J.Roles of the human hypoxia-inducible factor(HIF)-3a variants in the hypoxia response[J].Cell Mol Life Sci,2011,68:3885-901.
[8]Makino Y,Kanopka A,Wilson WJ,et al.Inhibitory PASdomain protein(IPAS)is a hypoxia-inducible splicing variant of the hypoxia-inducible factor-3alpha locus[J].J Biol Chem,2002,277(36):32405-8.
[9]Patel SA,Simon M C.Biology of hypoxia-inducible factor-2alpha in development and disease[J].Cell Death Differ,2008,15(4):628-34.
[10]Gu Y Z,Moran SM,Hogenesch JB,et al.Molecular characterization and chromosomal localization of a third alpha-class hypoxia inducible factor subunit,HIF3alpha[J].Gene Expr,1998,7(3):205-13.
[11]Hara S,Hamada J,Kobayashi C,et al.Expression and characterization of hypoxia-inducible factor(HIF)-3alpha in human kidney:suppression of HIF-mediated gene expression by HIF-3alpha[J].Biochem Biophys Res Commun,2001,287(4):808-13.
[12]Drevytska T,Gavenauskas B,Drozdovska S,et al.HIF-3alpha mRNA expression changes in different tissues and their role in adaptation to intermittent hypoxia and physical exercise[J].Pathophysiology,2012,19(3):205-14.
[13]Maynard M A,Evans A J,Hosomi T,et al.Human HIF-3alpha4 is a dominant-negative regulator of HIF-1 and is down-regulated in renal cell carcinoma[J].FASEB J,2005,19(11):1396-406.
[14]Heidbreder M,Qadri F,Johren O,et al.Non-hypoxic induction of HIF-3alpha by 2-deoxy-D-glucose and insulin[J].Biochem Biophys Res Commun,2007,352(2):437-43.
[15]Maynard M A,Evans A J,Shi W,et al.Dominant-negative HIF-3α4 suppresses VHL-Null renal cell carcinoma progression[J].Cell Cycle,2007,6(22):2810-6
[16]Yamashita T,Ohneda O,Nagano M,et al.Abnormal heart development and lung remodeling in mice lacking the hypoxiainducible factor-related basic helix-loop-helix PASprotein NEPAS[J].Mol Cell Biol,2008,28:1285-97.
[17]Huang Y,Ochieng J K,Kempen M B,et al.Hypoxia inducible factor 3alpha plays a critical role in alveolarization and distal epithelial cell differentiation during mouse lung development[J].PLoSOne,2013,8(2):e57695.
[18]Gontan C,Munck A,Vermeij M,et al.Sox2 is important for two crucial processes in lung development:branching morphogenesis and epithelial cell differentiation[J].Dev Biol,2008,317(1):296-309.
[19]Shu W,Lu M M,Zhang Y,et al.Foxp2 and Foxp1 cooperatively regulate lung and esophagus development[J].Development,2007,134(10):1991-2000.
[20]Hatanaka M,Shimba S,Sakaue M,et al.Hypoxia-inducible factor-3alpha functions as an accelerator of 3T3-L1 adipose differentiation[J].Biol Pharm Bull,2009,32(7):1166-72.
[21]Ando H,Natsume A,Iwami K,et al.A hypoxia-inducible factor(HIF)-3αsplicing variant,HIF-3α4 impairs angiogenesis in hypervascular malignant meningiomas with epigenetically silenced HIF-3α4[J].Biochem Biophys Res Commun,2013,433(1):139-44.