短時間睡眠剝奪對全腦缺血/再灌注大鼠海馬神經元損傷的影響
趙 磊,承歐梅,余麗娟,楊 彬,王 佳,李 蓉,諶貝貝,楊俊卿
(重慶醫科大學1.藥理學教研室、2.附屬第一醫院神經內科,重慶 400016)
缺血性中風是僅次于癌癥和心肌梗死的高致死性和致殘性疾病。大量的藥物和非藥物干預措施研究用于減輕或防治缺血性損傷,然而這些干預措施對于缺血性腦損傷的臨床療效并不十分理想。因此,缺血性腦損傷機制及防治措施的研究至今仍顯得十分重要。正常的睡眠是保證機體正常運行的生理因素之一,然而大部分患者中風后表現為睡意增強和睡眠-覺醒周期紊亂,研究提示睡眠過度和紊亂可引起疲勞、注意力不集中及記憶減退等類似抑郁的表現,并加重缺血后腦損傷[1]。而一定程度的睡眠剝奪,可改善中風后睡眠紊亂[2]。近年來研究顯示,短時間睡眠剝奪對局灶性腦缺血損傷的影響多為矛盾性結果,有研究發現有保護性作用[3],也有研究發現可增強腦損傷[4];研究表明短時間睡眠剝奪能促進正常大鼠的神經發生[5],而也有報道睡眠剝奪可減少正常成年大鼠齒狀回細胞增殖[6]。造成這些矛盾性研究結果可能與動物模型、睡眠剝奪的方式和時程不同有關。目前,少見國內外對全腦缺血/再灌注腦損傷后睡眠剝奪干預作用及機制的研究報道。本研究擬對大鼠全腦缺血/再灌注后給予一定程度的睡眠剝奪,觀察其對缺血/再灌注大鼠海馬神經元損傷和增殖的影響。
1 材料與方法
1.1 主要材料 SD大鼠由重慶醫科大學實驗動物中心提供,飼養于重慶醫科大學附屬第一醫院SPF級動物實驗室;Morris水迷宮系統,淮北正華生物儀器設備有限公司;TUNEL細胞凋亡免疫組化試劑盒購自羅氏公司;5-溴脫氧尿嘧啶核苷(5-Bromo-2-deoxyUridine,BrdU)、小鼠抗BrdU單克隆抗體,均購自Sigma公司。
1.2 實驗動物分組 ♂SD大鼠42只,質量200~250 g,大鼠隨機分為3組:假手術組(S)、全腦缺血/再灌注損傷組(GCIR),全腦缺血/再灌注損傷+睡眠剝奪組(GCIR+SD),每組14只。
1.3 大鼠全腦缺血/再灌注模型制備 雙側頸總動脈夾閉合并低血壓建立全腦缺血/再灌注模型[7]。水合氯醛(0.24 mol·L-1)麻醉,分離左、右頸總動脈及右側頸總靜脈,靜脈插管,輸入肝素化生理鹽水,按照大鼠總血容量0.3體積分數抽取,夾閉雙側頸總動脈20 min,然后緩慢回輸血液,縫合。假手術組僅分離雙側頸總動脈和右側頸總靜脈。
1.4 睡眠剝奪干預及Brd U標記 睡眠剝奪采用小平臺水環境法[8]。自制裝置為直徑40 cm的水桶,桶中放置一直徑6 cm圓形平臺,平臺高出水面約1 cm,大鼠睡眠剝奪期間正常飲食。造模前1周大鼠每天站立平臺適應5 min。自再灌注后48 h開始睡眠剝奪12 h(8∶00AM~8∶00PM),連續3 d,給予自然光照環境。為排除該方法所產生的應激、活動限制等因素,全腦缺血/再灌注組和假手術組選用直徑18 cm平臺,大鼠在平臺上可以維持正常的睡眠-覺醒周期。標記干細胞增殖的大鼠于睡眠剝奪d 2~d 3,按50μg·g-1量腹腔注射BrdU(Sigma,10 g·L-1)生理鹽水,每日3次,間隔4 h。
1.5 行為學測試[9]Morris水迷宮直徑150 cm、高60 cm,內含直徑12 cm平臺一個,置于水面下1 cm。水池四壁標記A、B、C、D象限,為實驗時大鼠入水點,實驗全程實時監控,電腦記錄數據。訓練d 1將大鼠放于平臺適應1 min,由任意象限池壁放入水中讓其自由游泳至平臺,90 s內未找到平臺者,由試驗者將其引導至平臺停留15 s后終止試驗。d 2~d 4大鼠直接由4個象限沿池壁放入水中進行訓練,尋臺時間超過90 s按照90 s計算。d 5時,撤去平臺,隨機選定一個象限將大鼠放入水迷宮中,記錄大鼠尋臺潛伏期和軌跡。
1.6 組織病理學檢查 再灌注后d 7,麻醉大鼠后進行在體灌流固定。分離海馬浸泡于4 g·L-1多聚甲醛中固定48 h,梯度乙醇脫水,石蠟包埋,冠狀連續厚4μm切片,HE染色,顯微鏡下觀察海馬神經元形態結構變化。每個樣本分別取3張切片,每張切片取5個高倍視野進行細胞計數。
1.7 TUNEL法檢測細胞凋亡 上述石蠟切片進行細胞凋亡檢測,按試劑盒說明,滴加蛋白酶K(20 mg·L-1)溶液,37℃恒溫消化 60 min,滴加 Triton-X100(0.01%)通透 20 min,滴加 TUNEL(50μl)反應液,4℃過夜。復溫后滴加POD,37℃恒溫孵育60 min。DAB顯色,顯微鏡下觀察海馬陽性凋亡細胞。每個樣本分別取3張切片,每張切片取5個高倍視野進行細胞計數。
1.8 Brd U免疫組化 再灌注后d 14,麻醉大鼠后進行在體灌流固定。腦組織石蠟包埋,冠狀連續切厚4μm切片。枸櫞酸加熱修復,分別用HCl(1 mol·L-1)、HCl(2 mol·L-1)處理,滴加胰酶(1 g·L-1)處理20 min。山羊血清封閉,滴加BrdU一抗(Sigma)(PBS陰性對照),4℃過夜。加二抗 37℃30 min,滴加辣根過氧化物酶標記的鏈霉素卵白素工作液37℃30 min,DAB顯色,顯微鏡下觀察海馬增殖陽性細胞,細胞核呈深棕黃色的顆粒為增殖陽性細胞,每個樣本分別取3張切片,每張切片取5個高倍視野進行細胞計數。
1.9 統計學分析 數據用ˉx±s表示,免疫組化應用Image-pro plus6.0圖像分析,SPSS 10.0統計軟件包進行統計學處理。
2 結果
2.1 短時間睡眠剝奪對全腦缺血/再灌注大鼠學習與記憶功能的影響 水迷宮結果顯示,與假手術組比,全腦缺血/再灌注組大鼠平均尋臺潛伏期明顯延長(P<0.05)。與全腦缺血/再灌注組相比,全腦缺血/再灌注+睡眠剝奪組的尋臺潛伏期的平均時間明顯縮短(P<0.05),見 Fig 1、2。
2.2 大鼠海馬CA1區組織病理學形態變化 假手術組海馬CA1區錐體細胞核清晰,結構完整。全腦缺血/再灌注組CA1區胞核固縮深染、結構排列散亂、數量減少。與全腦缺血/再灌注組相比,全腦缺血/再灌注+睡眠剝奪組大鼠海馬神經元損傷明顯減輕(P<0.01),見 Fig 3、4。
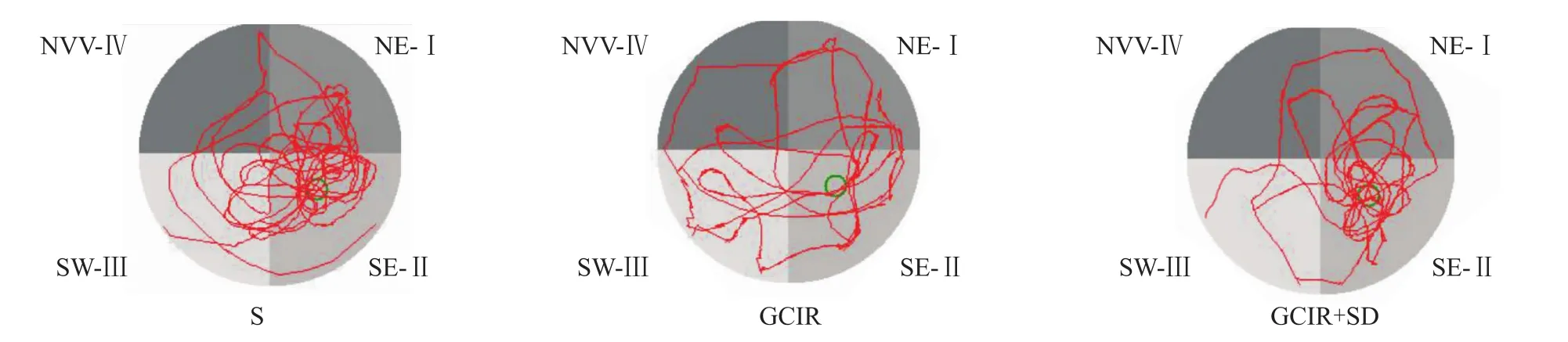
Fig 2 Morris typical track of rats
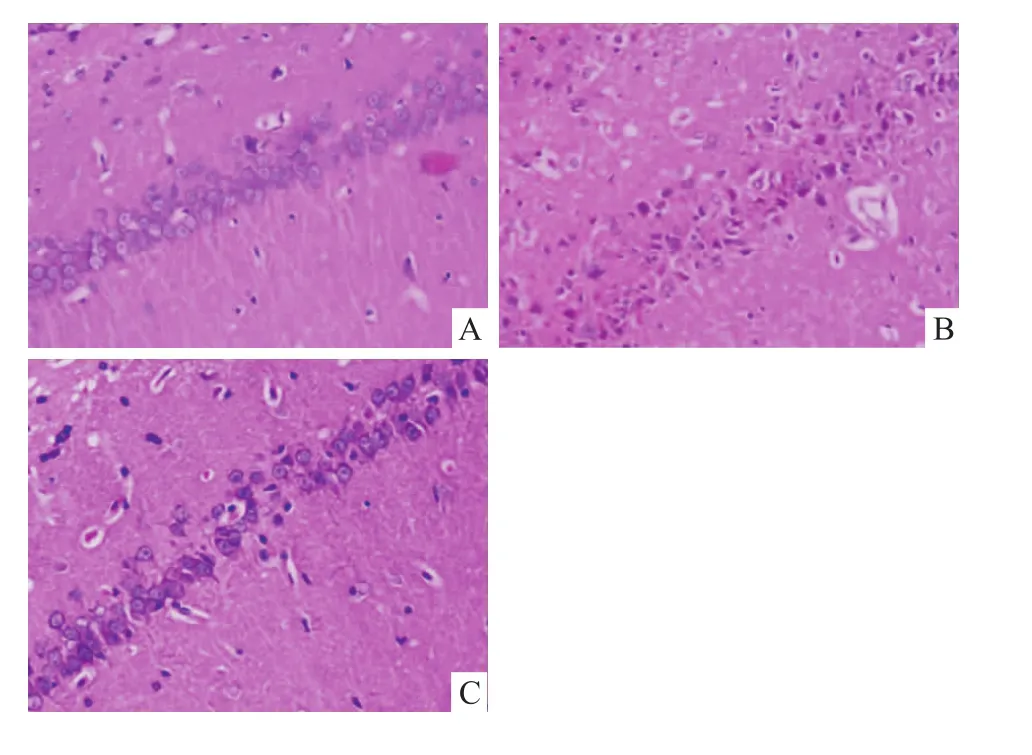
Fig 3 Effect of short-term sleep deprivation on CA1 area pathomorphology of rats 7 days after surgery.HE stain(×200)

Fig 4 Percentage of dead neurons in the CA1 area of hippocampus(ˉx±s,n=4)
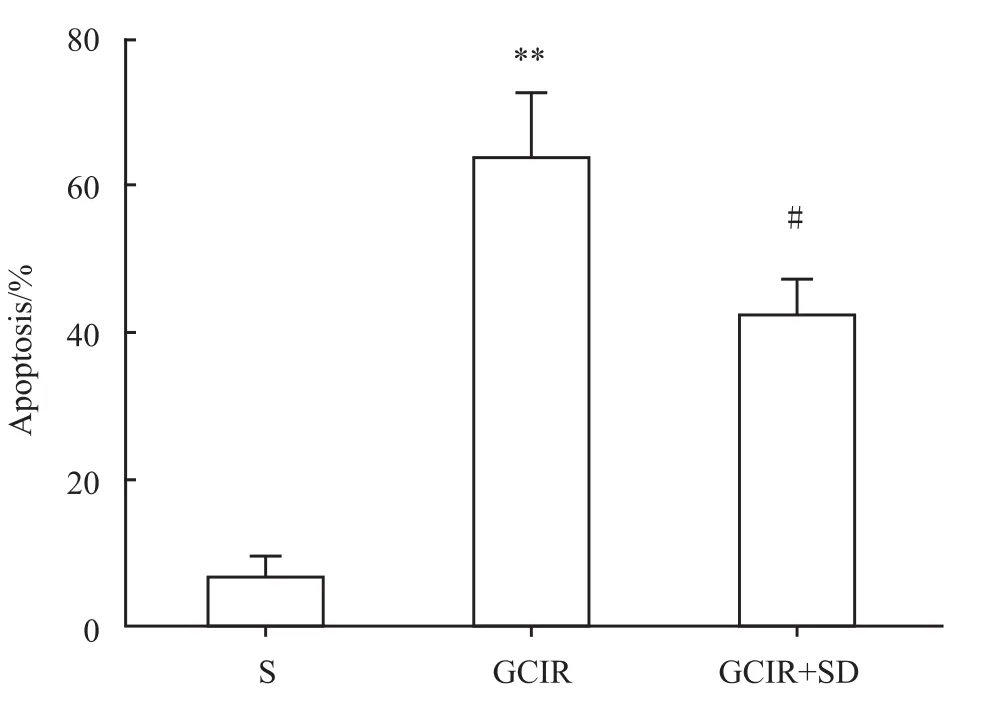
Fig 6 Percentage of positive apoptotic cells in the CA1 area of hippocampus(ˉx±s,n=4)

Fig 7 Effect of short-term sleep deprivation on the number of BrdU-positive cells in DG area 14 days after surgery(×200)
2.3 大鼠海馬CA1區細胞凋亡變化 假手術組CA1區僅有少量的散在的TUNEL陽性細胞。而全腦缺血/再灌注組和全腦缺血/再灌注+睡眠剝奪組TUNEL陽性細胞數量較假手術組明顯增多(P<0.01)。與全腦缺血/再灌注模型組相比,全腦缺血/再灌注+睡眠剝奪組大鼠海馬CA1區陽性細胞百分比明顯降低(P<0.05),見 Fig 5、6。
2.4 大鼠海馬神經細胞增殖改變 BrdU免疫組化結果顯示,假手術組海馬齒狀回僅見少量的陽性細胞。全腦缺血/再灌注組和全腦缺血/再灌注+睡眠剝奪組的陽性細胞數均有明顯增加(P<0.01)。與全腦缺血/再灌注模型組相比,全腦缺血+睡眠剝奪組大鼠海馬齒狀回區BrdU陽性細胞百分比明顯升高(P<0.05),見 Fig 7、8。
3 討論
本研究結果顯示,全腦缺血/再灌注大鼠學習記憶功能明顯下降,海馬神經元明顯核固縮、凋亡。短時間睡眠剝奪能明顯改善缺血/再灌注大鼠學習記憶障礙、海馬神經元損傷和細胞凋亡。已有相似研究發現短時間剝奪可明顯減輕局灶性缺血大鼠海馬神經細胞損傷[3]。正常情況側腦室室管膜下區(SVZ)和海馬齒狀回顆粒細胞下層區(SGZ)神經發生并不明顯,腦損傷及腦缺血等刺激可增強這兩個區域的神經元增殖分化[10],齒狀回新生神經元能替代部分丟失神經元[11],這種替代對于中風、腦損傷、癲癇等疾病的恢復起到一定的代償性保護作用[12],我們研究也發現全腦缺血/再灌注組大鼠齒狀回的BrdU陽性細胞數明顯增加,但是并不能明顯減輕全腦缺血/再灌注導致的海馬神經細胞損傷,其原因可能是此代償性保護作用尚不足以對抗全腦缺血/再灌注帶來的損傷。然而,我們也發現短時間睡眠剝奪能夠進一步明顯增加全腦缺血/再灌注大鼠齒狀回BrdU陽性細胞數,同時全腦缺血/再灌注導致的海馬神經細胞損傷明顯減輕。我們的研究結果提示,短時間睡眠剝奪能通過促進全腦缺血/再灌注大鼠齒狀回神經干細胞的增殖而發揮神經保護作用。關于短時間睡眠剝奪促進全腦缺血/再灌注大鼠海馬神經發生的機制目前并不清楚,可能與大鼠海馬腦源性神經營養因子(BDNF)的表達增加[13-14]、海馬細胞外 5羥色胺 (5-HT)持續升高[15-16]和大鼠海馬神經膠質相關炎癥反應減輕[17]等有關,但是需要進一步深入研究。
總之,我們的研究結果顯示,短時間睡眠剝奪能明顯促進海馬神經細胞增殖,從而改善全腦缺血/再灌注大鼠學習記憶障礙和海馬神經元損傷,其具體的機制需要進一步深入研究。
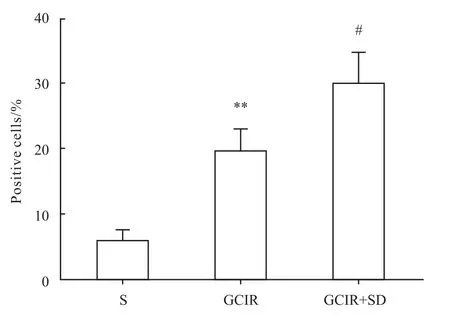
Fig 8 Percentage of positive BrdU cells in the DG area of hippocampus(ˉx±s,n=4)
參考文獻:
[1]Lavie P.The touch of morpheus pre-20th century accounts of sleepy patients[J].Neurology,1991,41(11):1841-1841.
[2]劉國軍,陳康寧.卒中后睡眠障礙研究進展[J].中國卒中雜志,2007,(05):455-8.
[2]Liu G J,Chen K N.Advance of sleep disorder after stroke[J].Chin J Strok,2007,2(05):459-462.
[3]Moldovan M,Constantinescu A O,Balseanu A,et al.Sleep deprivation attenuates experimental stroke severity in rats[J].Exp Neurol,2010,222(1):135-43.
[4]Gao B,Cam E,Jaeger H,et al.Sleep disruption aggravates focal cerebral ischemia in the rat[J].Sleep,2010,33(7):879.
[5]Grassi Zucconi G,Cipriani S,Balgkouranidou I,Scattoni R.‘One night’sleep deprivation stimulates hippocampal neurogenesis[J].Brain Res Bull,2006,69(4):375-81.
[6]Guzman-Marin R,Suntsova N,Methippara M,et al.Sleep deprivation suppresses neurogenesis in the adult hippocampus of rats[J].Eur J Neurosci,2005,22(8):2111-6.
[7]楊 彬,余麗娟,王 佳,楊俊卿,全腦缺血/再灌注大鼠皮層PGI2和TXA2時程變化特征[J].中國藥理學通報,2013,29(12):1667-71.
[7]Bin Y,Yu L J,Wang J,Yang J Q.Time course change of PGI2 and TA2 levels in rat cortex following global cerebral ischemia reperfusion[J].Chin Pharmacol Bull,2013,29(12):1667-71.
[8]Medeiros R,Lenneberg-Hoshino C,Hoshino K,Tufik S.Neuroethologic differences in sleep deprivation induced by the single-and multiple-platform methods[J].Brazilian J Med Biol Res,1998,31(5):675-80.
[9]Vorhees CV,Williams M T.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nature Protocols,2006,1(2):848-58.
[10]Kee N J,Preston E,Wojtowicz JM.Enhanced neurogenesis after transient global ischemia in the dentate gyrus of the rat[J].Exp Brain Res,2001,136(3):313-20.
[11]Bj?rklund A,Lindvall O.Neurobiology:Self-repair in the brain[J].Nature,2000,405(6789):892-5.
[12]Magavi SS,Leavitt B R,Macklis JD.Induction of neurogenesis in the neocortex of adult mice[J].Nature,2000,405(6789):951-5.
[13]Hairston I S,Peyron C,Denning D P,et al.Sleep deprivation effects on growth factor expression in neonatal rats:a potential role for BDNF in the mediation of delta power[J].J Neurophysiol,2004,91(4):1586-95.
[14]Fujihara H,Sei H,Morita Y,et al.Morita,Short-term sleep disturbance enhances brain-derived neurotrophic factor gene expression in rat hippocampus by acting as internal stressor[J].J Molecul Neurosci,2003,21(3):223-31.
[15]Penalva RG,Lancel M,Flachskamm C,et al.Effect of sleep and sleep deprivation on serotonergic neurotransmission in the hippocampus:a combined in vivo microdialysis/EEG study in rats[J].Eur J Neurosci,2003,17(9):1896-906.
[16]Lopez-Rodriguez F C.Wilson N,Maidment R,et al.Total sleep deprivation increases extracellular serotonin in the rat hippocampus[J].Neuroscience,2003,121(2):523-30.
[17]Hsu J C,Lee Y S,Chang C N,et al.Sleep deprivation prior to transient global cerebral ischemia attenuates glial reaction in the rat hippocampal formation[J].Brain Res,2003,984(1):170-81.