17β雌二醇對氯胺酮誘導皮層神經元凋亡的影響
李建立,高冬艷,杜彥茹,侯艷寧
(1.河北省人民醫院麻醉科,河北石家莊 050051;2.白求恩國際和平醫院藥劑科,河北 石家莊 050082)
Ikononmidou等[1]發現,出生 14 d內的新生大鼠使用NMDAR拮抗劑(MK-801)后能引起神經細胞凋亡樣損傷,成年大鼠卻沒有出現此現象,說明在大鼠腦發育高峰期(出生前1 d至出生后14 d)使用NMDAR拮抗劑會干擾中樞神經系統發育。氯胺酮作為一種NMDAR拮抗劑,最近大量動物實驗表明,在中樞神經系統的快速發育期反復應用氯胺酮可以影響神經系統的發育,導致神經元凋亡增加,甚至影響成年后的學習記憶功能[2-3]。另外多項體外實驗表明氯胺酮可導致原代培養的皮層神經元凋亡[4-5]。氯胺酮廣泛應用于小兒麻醉,其神經毒性令人擔憂,因此尋找有效的措施防范氯胺酮的發育期神經毒性變得尤為迫切。內源性神經甾體是一類由腦組織經膽固醇在各種酶的作用下合成的甾類化合物,被稱為第四類神經遞質,具有廣泛的生物學效應,不僅參與生長、發育、成熟及衰老過程,也參與對焦慮、抑郁、睡眠、情緒反應及學習記憶等認知功能的調節[6]。雌二醇作為一種內源性神經活性甾體,近年來大量研究表明對多種神經損傷具有保護作用,日益受到重視[7]。然而17β雌二醇是否保護皮層神經元免受氯胺酮導致的凋亡尚不清楚,因此本文就此進行了研究。
1 材料與方法
1.1 藥物及試劑 氯胺酮(福建古田藥業有限公司,批號 H35020148);DMEM培養液、胎牛血清、Neurobasal培養液、B27促生長劑購自美國Gibco公司;LY294002、17β雌二醇、DMSO、MTT購自美國Sigma公司;TUNEL試劑盒購自德國Mannheim公司;胰蛋白酶購自北京索來寶公司;Akt和pAkt抗體購自美國Cell Signal Technology公司。
1.2 皮層神經元原代培養 參照文獻方法[8],略加改進。取新生24 h內的SD幼鼠,無菌操作下迅速取出大腦,用D-Hanks液清洗后取出大腦皮質,剪成約1 mm×1 mm×1 mm大小的組織塊,經0.125%胰蛋白酶37℃消化15 min,用含10%胎牛血清的DMEM培養基終止消化,然后把細胞轉移到含10%胎牛血清的DMEM培養基中制成細胞懸液。然后經100目鋼絲篩過濾,計數后按1×109·L-1的密度接種于經多聚賴氨酸處理的培養板,37℃、5%CO2培養箱內培養24 h后,全量換neurobasal+B27培養基,以后每隔2天半量換液1次。體外培養7 d的神經元用于以下實驗。
1.3 實驗分組 觀察氯胺酮對神經元存活率影響時,氯胺酮終濃度分別為0、1、10、100、1 000μmol·L-1。觀察17β雌二醇對神經元保護作用時,分為對照組、氯胺酮組(氯胺酮終濃度為100μmol·L-1)、氯胺酮+17β雌二醇組(氯胺酮終濃度為100 μmol·L-1,17β雌二醇終濃度分別為 0.001、0.01、0.1、1μmol·L-1)。檢測各種處理對神經元形態、神經元凋亡和pAkt蛋白表達的影響時,分為對照組、氯胺酮組(終濃度為100μmol·L-1)、氯胺酮+17β雌二醇組(氯胺酮100μmol·L-1,17β雌二醇0.1μmol·L-1),氯胺酮 +17β雌二醇 +LY294002組(氯胺酮100μmol·L-1,17β雌二醇 0.1μmol·L-1,LY294002 10μmol·L-1)。
1.4 MTT法檢測神經元存活率 將細胞接種于96孔板,體外培養至d 7分別加入不同的藥物處理24 h,翻板法棄去培養液,每孔加入10μl MTT液,37℃孵育4 h,棄上清,加入200μl DMSO,輕輕振蕩溶解甲臜結晶,在多功能酶標儀上測定570 nm的吸光度值。以對照組平均吸收值為100%,以各處理組吸收值與對照組的比值計算存活率。
1.5 神經元凋亡的檢測 應用TUNEL法檢測凋亡神經元。將細胞涂片用4%多聚甲醛室溫下固定30 min,然后PBS洗3次,0.3%H2O2封閉內源性過氧化酶30 min,然后在0.1%Triton X-100的0.1%檸檬酸鈉溶液中4℃孵育5 min,將50μl TUNEL反應液在37℃濕盒中反應60 min,PBS沖洗3次,然后再加入50μl可轉變還氧化酶反應液,37℃濕盒中孵育30 min,最后加入50μl底物反應液室溫反應10 min。光鏡下觀察神經元,細胞核有棕黃色顆粒者為陽性神經元,采取5個不同的視野,計算陽性和陰性細胞數量。
1.6 Western blot法測定p Akt蛋白表達 細胞經各種處理后,收集細胞,裂解液裂解細胞,提取細胞總蛋白,BCA法檢測樣品蛋白含量。取待測蛋白質50μg加上樣緩沖液煮沸變性,于10%十二烷基硫酸鈉-聚丙烯酰胺凝膠中100V電泳1.5 h,轉膜2 h,加入 Akt、pAkt抗體(1∶2 000),4℃過夜,常規洗滌,加羊抗鼠二抗(1∶5 000),37℃孵育60 min,洗滌,電化學法發光,顯影,掃描,用凝膠圖像處理系統分析目標條帶與內參照條帶吸光度的比值。實驗重復3次,設Akt蛋白為內參。
1.7 統計學分析 所有數據采用ˉx±s表示,應用SPSS13.0軟件進行處理,采用單因素方差分析(ANOVA)和SNK檢驗進行數據分析。
2 結果
2.1 各種處理神經元存活率變化 神經元經過1、10、100、1 000μmol·L-1的氯胺酮處理 24 h后,存活率分別為(98.03±5.55)%、(79.34±5.01)%、(58.17±2.84)%、(31.41±1.84)%,其中10、100、1 000μmol·L-1氯胺酮處理后神經元存活率明顯低于對照組(P<0.01),見 Fig 1。100μmol·L-1氯胺酮處理神經元的同時分別加入0.001、0.01、0.1、1μmol·L-1的17β雌二醇共同處理24 h后,其存活率分別為(54.78±5.05)%、(75.1±9.25)%、(88.33±8.54)%、(79.54±10.25)%,其中0.1μmol·L-117β雌二醇保護效果最好,見Fig 2。

Fig 2 Effect of 17β-estradiol treatment on neuron viability±s,n=6)**P<0.01 vs control;##P<0.01 vs ketamine
2.2 各種處理對神經元形態的影響 對照組神經元胞體豐滿,突起較長,相互之間神經網絡連接緊密。100μmol·L-1氯胺酮處理24 h后,神經元胞體立體感消失,顏色變暗,細胞輪廓不清,神經元軸突斷裂,部分死亡。0.1μmol·L-117β雌二醇與100μmol·L-1氯胺酮共處理部分逆轉了氯胺酮引起的神經元細胞形態變化。而 10μmol·L-1LY294002拮抗了17β雌二醇對神經元的保護作用,見Fig 3。
2.3 各種處理對神經元凋亡的影響 100μmol·
L-1氯胺酮處理神經元24 h后,TUNEL陽性神經元較對照組明顯增加,而加入0.1μmol·L-117β雌二醇共同處理24 h,TUNEL陽性神經元較氯胺酮組明顯減少,而 10μmol·L-1LY294002預處理組TUNEL陽性神經元較17β雌二醇+氯胺酮組明顯增加,見Fig 4。
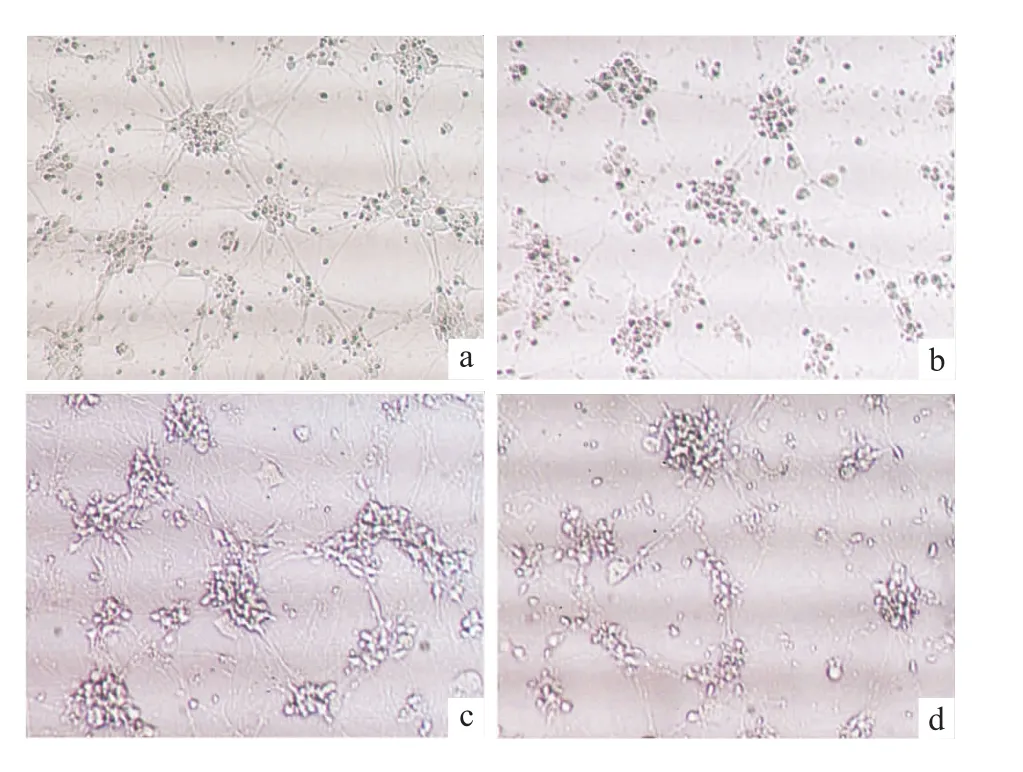
Fig 3 Effect of different treatments on structure of neuronsa:Control;b:Ketamine;c:17β-estradiol+ketamine;d:17β-estradiol+ketamine+LY294002

Fig 4 Effect of 17β-estradiol treatment on neuronal apoptosis induced by ketamine exposure(±s,n=6)**P<0.01 vs control;##P<0.01 vs ketamine;ΔΔP<0.01 vs ketamine+17β-estradiol.a:Control;b:Ketamine;c:17β-estradiol+ketamine;d:17β-estradiol+ketamine+LY294002
2.4 各種處理對pAkt蛋白表達的影響 100μmol·L-1氯胺酮處理神經元2 h后,pAkt蛋白表達降低,明顯低于對照組(P<0.01)。氯胺酮與17β雌二醇共處理2 h后,pAkt蛋白表達較氯胺酮單純處理組明顯增加(P<0.01)。加入LY294002后pAkt蛋白表達降低,明顯低于氯胺酮+17β雌二醇組(P<0.01),見 Fig 5。
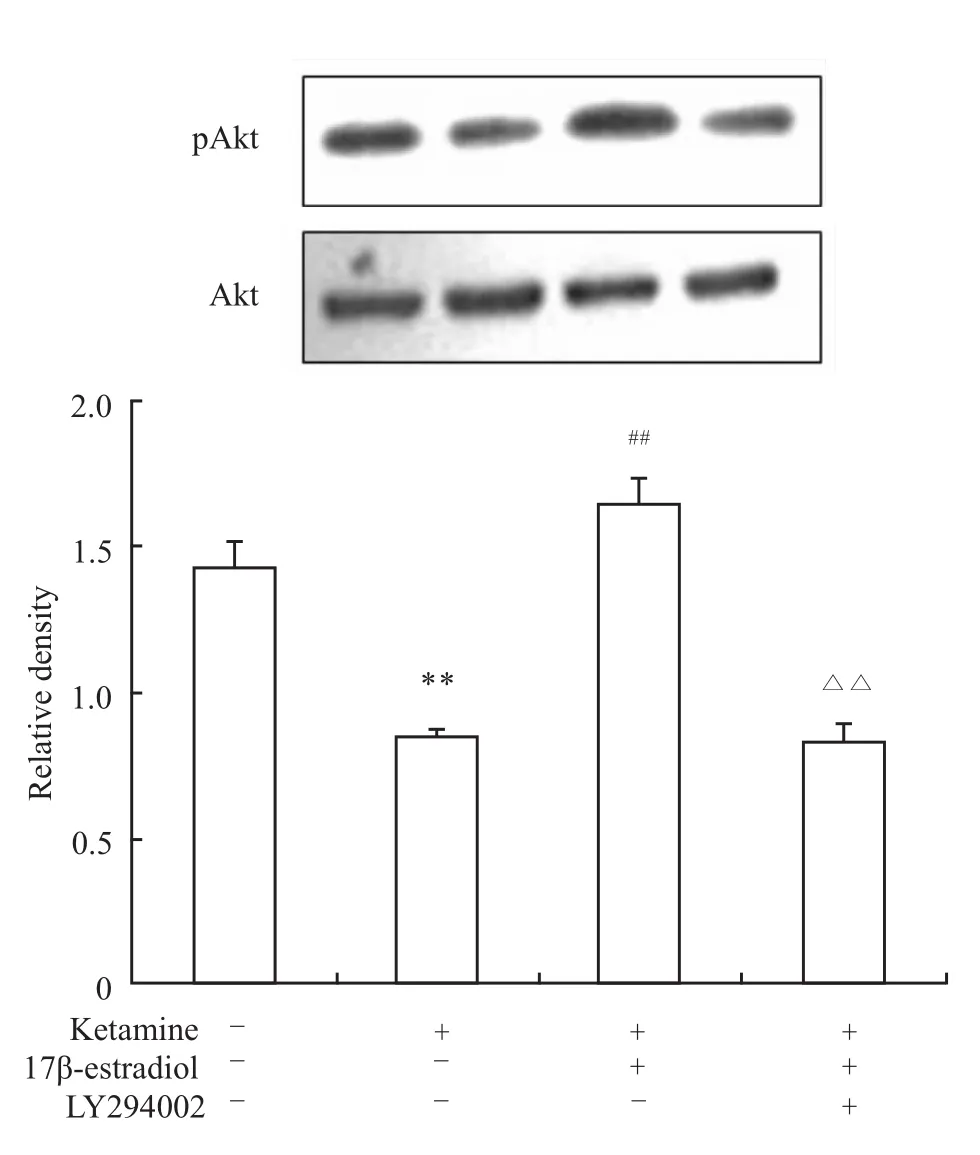
Fig 5 Effect of different treatments on p Akt level(±s,n=6)**P<0.01 vs control;##P<0.01 vs ketamine;ΔΔP<0.01 vs ketamine+17β-estradiol.
3 討論
人類大腦的快速發育期為懷孕后3個月到出生后3年,全世界每年都有數百萬嬰幼兒在此時間內由于各類外科手術或診斷需要等原因接受全身麻醉。氯胺酮是嬰幼兒麻醉最為常用的麻醉劑,最近研究表明,發育期大腦應用氯胺酮可引起神經元的大量凋亡[2-5]。因此氯胺酮的臨床應用,尤其是在嬰幼兒中的應用,引起了廣泛的關注。針對麻醉藥引起的發育期大腦損傷,NIH、FDA以及IARS要求研究者不僅要研究其發生機制,而且要尋找有效的措施來防治麻醉藥所引起發育期神經損傷。
本研究發現氯胺酮對原代培養的皮層神經元產生劑量依賴性損傷,氯胺酮引起的神經元損傷機制目前仍不清楚。據推測,持續暴露于氯胺酮可以引起神經元NMDA受體亞單位,尤其是NR1亞單位的上調,進而導致神經元的調亡,而給予NR1反義寡核苷酸可以抑制NR1蛋白的合成,進而減輕氯胺酮引起的神經元調亡[9]。
近年來,對如何防治氯胺酮引起的發育期大腦損傷進行了一系列研究,研究表明維生素D、鋰、促紅細胞生成素、肉毒堿、煙酰胺、可樂定等對氯胺酮引起的發育期神經損傷產生保護作用[4,10-14]。雌二醇作為一種內源性神經活性甾體,有研究表明,17β雌二醇可以促進神經元的存活以及功能維護[15-16]。另有研究表明 17β雌二醇可以對NMDAR拮抗劑MK801所引起的發育期大腦調亡樣損傷產生保護作用[17]。另外 Lu等[18]研究發現,雌二醇可對咪達唑侖、笑氣、異氟醚聯合應用所引起的發育期大鼠大腦廣泛凋亡樣損傷產生保護作用。然而17β雌二醇是否對氯胺酮所導致皮層神經元凋亡產生保護作用以及機制目前還不清楚,本文對此進行了研究。本研究發現17β雌二醇可對氯胺酮導致的皮層神經元損傷產生保護作用,激活PI3KAkt信號通路可能是其發揮保護作用的機制之一。
PI3K-Akt信號通路是近年來發現的一條參與細胞增殖調控的重要信號通路。PI3K通過催化底物Akt磷酸化而將活化信號轉移到細胞內部。Akt是一種絲氨酸/蘇氨酸蛋白激酶,被激活的Akt在Ser-473和Thr-308位點發生磷酸化,進而產生廣泛的生物學效應,如抗細胞凋亡和促進細胞存活等。同時NMDA受體在神經系統的發育、突觸形成等方面具有重要的作用,還具有促進神經元存活的作用,這一作用是通過PI3K-Akt信號通路實現的[19]。本研究發現,作為NMDAR拮抗劑氯胺酮通過降低神經元pAkt蛋白的表達,進而導致神經元凋亡,這與以往的研究結果一致[5,12]。另外研究表明PI3K-Akt信號通路是雌二醇發揮神經保護作用的重要通路[17-18]。因此我們假設17β雌二醇保護皮層神經元免受氯胺酮導致的凋亡是通過激活PI3K-Akt信號通路實現的。本研究通過Western blot檢測各種處理對皮層神經元pAkt蛋白表達的影響,發現氯胺酮與17β雌二醇共同作用使神經元pAkt蛋白表達增加。為了進一步證實PI3K-Akt信號通路在17β雌二醇對抗氯胺酮神經毒性中的作用,我們應用了PI3K抑制劑LY294002,觀察其對神經元pAkt蛋白表達以及神經元凋亡的影響,結果表明LY294002抑制了17β雌二醇誘導pAkt表達的上調作用,同時抑制了17β雌二醇的神經保護作用,使神經元凋亡增加。
總之,氯胺酮導致了原代培養皮層神經元凋亡,這一作用是通過阻斷NMDA受體,下調pAkt蛋白表達而實現的。17β雌二醇具有保護神經元免受氯胺酮損傷的作用,其機制可能是通過激活PI3K-Akt信號通路實現的。本研究為圍手術期應用17β雌二醇預防氯胺酮對嬰幼兒大腦產生神經損傷提供了初步的實驗依據。
參考文獻:
[1] Ikonomidou C,Bosch F,Miksa M,et al.Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain[J].Science,1999,283(5398):70-4.
[2] Huang L,Liu Y,Jin W,et al.Ketamine potentiates hippocampal neurodegeneration and persistent learning and memory impairment through the PKCgamma-ERK signaling pathway in the developing brain[J].Brain Res,2012,1476(2):164-71.
[3] Brambrink A M,Evers A S,Avidan M S,et al.Ketamine-induced neuroapoptosis in the fetal and neonatal rhesus macaque brain[J].Anesthesiology,2012,116(2):372-84.
[4] Liu F,Patterson T A,Sadovova N,et al.Ketamine-induced neuronal damage and altered N-methyl-D-aspartate receptor function in rat primary forebrain culture[J].Toxicol Sci,2013,131(2):548-57.
[5] Takadera T,Ishida A,Ohyashiki T.Ketamine-induced apoptosis in cultured rat cortical neurons[J].Toxicol Appl Pharmacol,2006,210(1-2):100-7.
[6] Kawato S,Yamada M,Kimoto T.Brain neurosteroids are4th generation neuromessengers in the brain:cell biophysical analysis of steroid signal transduction[J].Adv Biophy,2001,37(1):1-48.
[7] Melcangi R C,Panzica G,Garcia-Segura L M.Neuroactive steroids:focus on human brain[J].Neuroscience,2011,191:1-5.
[8] 于 洋,薛 改,吳紅海,等.Aβ25-35對大鼠大腦皮層皮質神經元神經甾水平的影響[J].中國藥理學通報,2010,26(6):783-6.
[8] Yu Y,Xue G,Wu H H,et al.Effect of Aβ25-35on neurosteroidogenesis in primary rat cortical neurons[J].Chin Pharmacol Bull,2010,26(6):783-6
[9] Wang C,Sadovova N,Fu X,et al.The role of the N-methyl-D-aspartate receptor in ketamine-induced apoptosis in rat forebrain culture[J].Neuroscience,2005,132(4):967-77.
[10]Turner C P,Gutierrez S,Liu C,et al.Strategies to defeat ketamineinduced neonatal brain injury[J].Neuroscience,2012,210(17):384-92.
[11]Straiko M M,Young C,Cattano D,et al.Lithium protects against anesthesia-induced developmental neuroapoptosis[J].Anesthesiology,2009,110(4):862-8.
[12]Shang Y,Wu Y,Yao S,et al.Protective effect of erythropoietin against ketamine-induced apoptosis in cultured rat cortical neurons:involvement of PI3K/Akt and GSK-3 beta pathway[J].Apoptosis,2007,12(12):2187-95.
[13]Ullah N,Ullah I,Lee H Y,et al.Protective function of nicotinamide against ketamine-induced apoptotic neurodegeneration in the infant rat brain[J].Mol Neurosci,2012,47(1):67-75.
[14]Ponten E,Viberg H,Gordh T,et al.Clonidine abolishes the adverse effects on apoptosis and behaviour after neonatal ketamine exposure in mice[J].Acta Anaesthesiol Scand,2012,56(8):1058-65.
[15]Nilsen J,Chen S,Irwin R W,et al.Estrogen protects neuronal cells from amyloid beta-induced apoptosis via regulation of mitochondrial proteins and function[J].BMCNeurosci,2006,7(3):74-85.
[16]Chen S,Nilsen J,Brinton R D.Dose and temporal pattern of estrogen exposure determines neuroprotective outcome in hippocampal neurons:therapeutic implications[J].Endocrinology,2006,147(11):5303-13.
[17]Asimiadou S,Bittigau P,Felderhoff-Mueser U,et al.Protection with estradiol in developmental models of apoptotic neurodegeneration[J].Ann Neurol,2005,58(2):266-76.
[18]Lu LX,Yon J H,Carter L B,et al.General anesthesia activates BDNF-dependent neuroapoptosis in the developing rat brain[J].Apoptosis,2006,11(9):1603-15.
[19]Sutton G,Chandler L J.Activity-dependent NMDA receptor-mediated activation of protein kinase B/Akt in cortical neuronal cultures[J].Neurochem,2002,82(5):1097-105.

