抑制Bmi-1基因表達對鼻咽癌細胞生物學行為的影響
李海玉,陳興鳳,余思穎,劉革力,宋方洲
(重慶醫科大學分子醫學與腫瘤研究中心,生物化學與分子生物學教研室,重慶 400016)
鼻咽癌(nasopharyngeal carcinoma,NPC)是中國南方省份及東南亞地區比較常見的惡性腫瘤,尤其是我國廣東、廣西,具有明顯的種族聚集性和地域性。研究表明NPC的發生發展是多因素作用的結果,其中許多重要基因參與其發生發展的過程,已報道MMP9、VIM等基因的異常表達促進了鼻咽癌的發生。因此,研究和鼻咽癌發生相關的基因,將有助于進一步揭示鼻咽癌的發病機制及預后。
Bmi-1(B-cell-specific moloney murine leukemiavirus insertion site 1,Bmi-1)基因是1991年在鼠淋巴細胞發現的多梳基因(polycomb group genes,PcG)家族的重要成員之一[1]。Bmi-1廣泛表達于多種腫瘤中并與腫瘤的發生發展密切相關,例如乳腺癌[2]、前列腺癌[3]、胰腺癌[4]等。有學者發現鼻咽癌中Bmi-1的mRNA及蛋白水平表達均較高,表明Bmi-1與鼻咽癌進展及轉移有關[5]。為了進一步研究Bmi-1與鼻咽癌侵襲遷移的關系,采用小干擾RNA技術沉默鼻咽癌細胞株CNE-1中Bmi-1的表達,觀察沉默Bmi-1表達后,CNE-1細胞生物學行為變化,為探討Bmi-1在鼻咽癌侵襲遷移中的作用機制奠定基礎。
1 材料與方法
1.1 主要試劑 RPMI 1640培養基、胎牛血清購自Hyclon公司。RT-PCR試劑盒、qRT-PCR試劑盒購自TaKaRa公司。Total RNA提取試劑盒購自OMEGA公司。Opti-MEM、Lipofectamine RNAiMAX購自Invitrogen公司。Negative control siRNA、BMI-siRNA-269由上海吉瑪基因公司合成。Bmi-1、β-actin的引物由上海生工生物公司合成。小鼠抗人的Bmi-1單克隆抗體購自Upstate公司,小鼠抗人β-actin單克隆抗體、HRP標記的羊抗鼠IgG購自Santa Cruz公司。Matrigel膠購自Bio-Rad公司,Transwell小室購自Millipore公司。
1.2 細胞培養 CNE-1細胞由重慶醫科大學分子醫學與腫瘤研究中心保存。采用含10%胎牛血清、1×105U·L-1青霉素和100 mg·L-1鏈霉素的RPMI 1640培養基,置于37℃、5%CO2、飽和濕度培養箱中培養。0.25% 胰酶消化細胞,2~3 d傳代1次,取對數生長期細胞實驗。
2 方法
2.1 siRNA的合成及轉染 由本課題組前期篩選出的有干擾效果的BMI-siRNA-269,正義鏈:5′-AUGAAGAGAAGGGAUUTT-3′,反義鏈:5′-AAUCCCUUCUCUUCAUTT-3′。陰性對照 GFP-Si正義鏈:5′-UUCUCCGAACGUGUCACGUTT-3′,反義鏈:5′-ACGUG
ACACGUUCGGAGAATT-3′。干粉 siRNA用 DEPC水稀釋成20μmol·L-1,-20℃保存。轉染前24h,取對數生長期的細胞0.25%胰酶消化,計數后每孔按2×105個細胞接種于6孔板中,待細胞融合度達到60%~70%,按Lipofectamine RNAiMAX說明書進行操作。細胞分3組:(1)空白組(只加 Lipofectamine RNAiMAX Reagent);(2)對照組(GFP-siRNA/Lipofectamine RNAiMAX復合物);(3)實驗組(BMI-siRNA269/RNAiMAX復合物)
2.2 實時熒光定量PCR檢測mRNA表達水平將轉染48 h后的空白組、GFP-Si組、Bmi-1siRNA-269組細胞提取Total RNA,核酸濃度測定儀測定其濃度和純度,按TaKaRa逆轉錄反應說明書合成cDNA。用于擴增Bmi-1cDNA的上游引物為:5′-GACCACTACTGAATATAAGG-3′,下 游 引 物 為:5′-CATTTGTCAGTCCATCTCTC-3′;β-actin的上游引物為:5-AGCGAGCATCCCCCAAAGTT-3′,下游引物 5′-GGGCACGAAGGCTCATCATT-3′。cDNA產物 10倍稀釋后以β-actin為內參進行實時熒光定量PCR,反應條件為95℃預變性5 min;95℃ 30 s,59℃ 30 s,72℃300 s(39個循環);反應結束建立溶解曲線。同一實驗重復3次,實驗數據分析采用2-▲▲ct法計算。
2.3 Western blot檢測蛋白的表達水平 siRNA轉染72 h后分別收集各組細胞,按碧云天公司蛋白提取說明書進行,采用BCA法測定蛋白濃度。取40 μg/孔蛋白樣品上樣,經12%SDS-PAGE后,將目的蛋白轉移到PVDF膜上,5%脫脂奶粉封閉2 h,與一抗(Bmi-1、β-actin)4℃搖床孵育過夜,TBST洗3次,每次10 min,再分別與相應HRP標記的二抗室溫孵育2 h,ECL化學發光。
2.4 Matrigel檢測CNE-1細胞侵襲能力 將Matrigel膠置于4℃過夜,用無血清預冷的RPMI 1640培養基按8∶1稀釋Matrigel膠混勻,每孔60μl均勻鋪在24孔Transwell上室的聚碳酸酯膜上,37℃孵箱1 h。收集轉染24 h后的各組細胞,計數后按2×103個細胞/孔接種于上室。將小室放于24孔板中,上室加入200μl無血清RPMI 1640培養基,下室加800μl含10%胎牛血清的RPMI 1640培養基,37℃、5%CO2培養24 h后取出小室,用棉簽擦掉上室細胞,PBS洗3次,800μl甲醇固定30 min,結晶紫染色15 min,PBS沖洗干凈,室溫風干。顯微鏡下取5個視野計數,取其平均值,每組重復3次。
2.5 Transwell檢測CNE-1細胞遷移能力 Tranwell實驗不鋪 Matrigel膠,37℃、5%CO2培養12 h取出小室,其余步驟參照侵襲實驗。
2.6 流式細胞術檢測細胞的周期 siRNA轉染48 h后胰酶消化收集各組細胞,1 000 r·min-1離心5 min,棄去上清液,PBS洗滌兩次,最后加入1 ml PBS重懸并轉移至1.5 ml的EP管中。加入5μl Annexin-FITC輕搖震蕩混勻,4℃孵育15 min,然后再加入5μl的碘化丙啶4℃孵育15 min,在流式細胞儀上進行細胞凋亡的檢測。每組實驗分別獨立重復3次。
2.7 流式細胞術檢測細胞凋亡 siRNA轉染48 h后胰酶消化收集各組細胞,1 000 r·min-1離心5 min,棄去上清液,PBS洗滌兩次,之后加入250μl PBS緩慢吹勻細胞,再加入750μl預冷無水乙醇,4℃固定過夜。離心后棄上清液,PBS洗滌1次,每個樣本中加500μl 1×FACS buffer和2.5μl RNaseA混勻室溫孵育15 min,再加入25μl PI,室溫避光孵育15 min,轉移至流式檢測管中,放在流式細胞儀上進行DNA含量分析。每組實驗分別獨立重復3次。
2.8 CCK-8測定細胞的生長增殖曲線 分別取對數生長期空白組、對照組和實驗組的細胞,血球計數板計數,以每孔5 000個細胞接種于96孔板中,每組3個復孔。在細胞貼壁后0、24、48、72、96 h檢測細胞生長情況,每孔加入10μl CCK-8試劑,37℃孵育2 h,在酶標儀上450 nm測OD值。
2.9 統計學分析 采用SPSS 17.0統計學軟件,計量資料用xˉ±s表示,兩組均數比較兩組均數比較采用t檢驗,多組均數比較采用單因素方差分析。
3 結果
3.1 Bmi-1 siRNA在CNE-1細胞中干擾效率的檢測 與空白組、對照組相比,實驗組Bmi-1基因mRNA和蛋白表達水平明顯下降(P<0.05),空白組和陰性對照組無明顯差別(Fig 1,2)。說明Bmi-1基因被有效沉默。

Fig 1 Bmi-1 mRNA expression detected by real-time fluorescence quantitative PCR

Fig 2 Bmi-1 protein expression detected by Western blot
3.2 抑制Bmi-1基因表達,CNE-1遷移能力的變化 siRNA轉染48 h后,顯微鏡下計數空白組、對照組和實驗組穿過Transwell上室的細胞數,并進行統計分析,結果顯示,與空白組、對照組相比,實驗組穿過小室的細胞數明顯減少(P<0.05),而空白組、對照組無明顯差異(P>0.05)。說明Bmi-1基因被沉默后,CNE-1細胞的遷移能力明顯下降(Fig 3)。
3.3 抑制Bmi-1基因表達,CNE-1侵襲能力的變化 顯微鏡下計數空白組、對照組和實驗組穿過基底膜的細胞數,并進行統計分析,結果顯示,與空白組、對照組相比,實驗組穿過基底膜的細胞數明顯減少(P<0.05),而空白組和陰性對照組的細胞數無明顯差異(P>0.05)。說明Bmi-1基因被沉默后,CNE-1侵襲能力下降(Fig 4)。
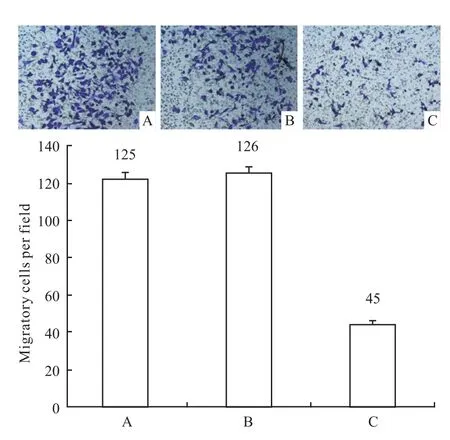
Fig 3 Transwell migration assay of CNE-1 infected with siRNAA:Blank group;B:Control group;C:Experimental group(×100)
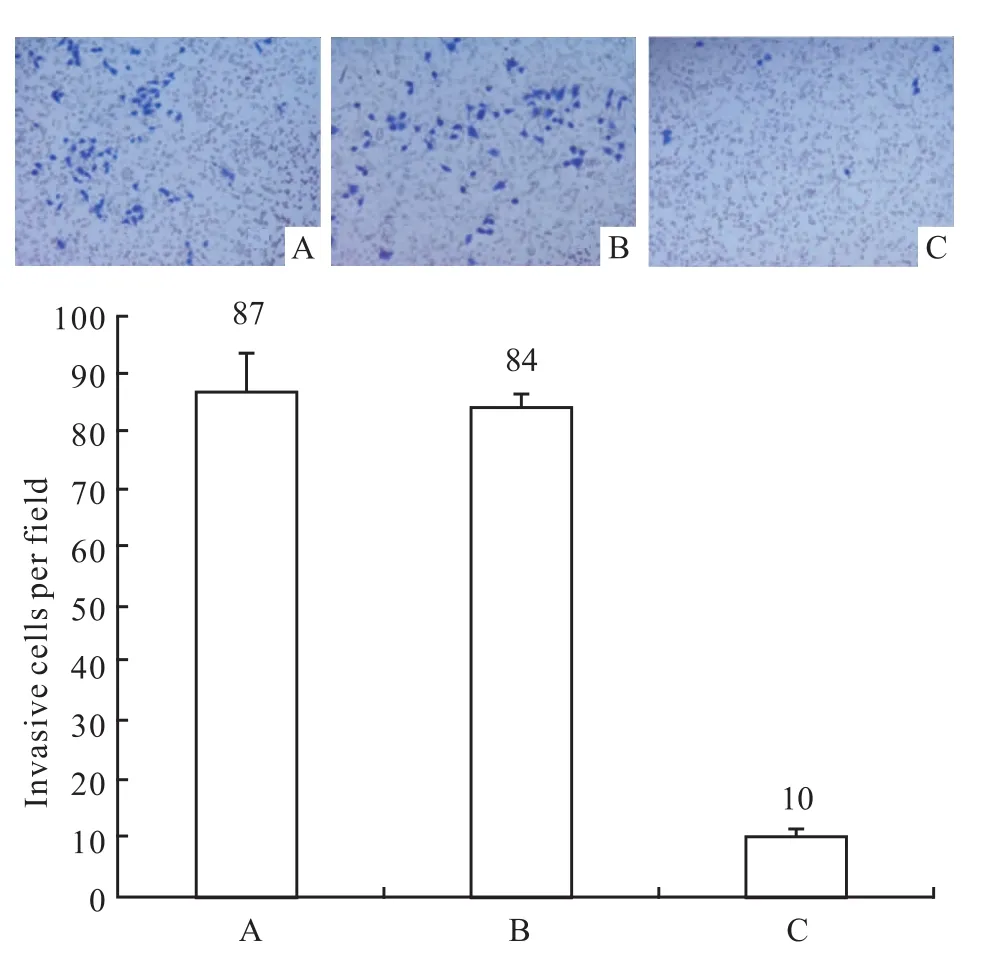
Fig 4 Matrigel invasion assay of CNE-1 infected with siRNAA:Blank group;B:Control group;C:Experimental group(×100)
3.4 抑制Bmi-1基因表達后,CNE-1細胞周期的變化 流式細胞術檢測細胞周期結果顯示:空白組和對照組的G1期細胞所占比例分別為54.61%和58.03%,S期細胞所占比例分別為35.29%和33.92%,空白組和對照組比較,差異無統計學意義(P>0.05)。實驗組G1期及S期細胞所占比例分別為73.71%和19.00%,與空白組、對照組比較,實驗組G1期細胞明顯增多,S期細胞減少,統計分析具有明顯差異 (P<0.05),見Fig 5。
3.5 抑制Bmi-1基因表達后,CNE-1細胞凋亡的變化 流式細胞術檢測凋亡結果顯示:空白組、對照組和實驗組的凋亡率分別為 1.48%、1.17%、1.31%。實驗組與空白組、對照組比較差異無顯著性(P>0.05),見 Fig 6。
3.6 CCK-8檢測細胞的生長 通過對細胞貼壁后0、24、48、72、96 h檢測,發現 Bmi-1基因被沉默后,CNE-1細胞的生長明顯受到抑制(Fig 7)。
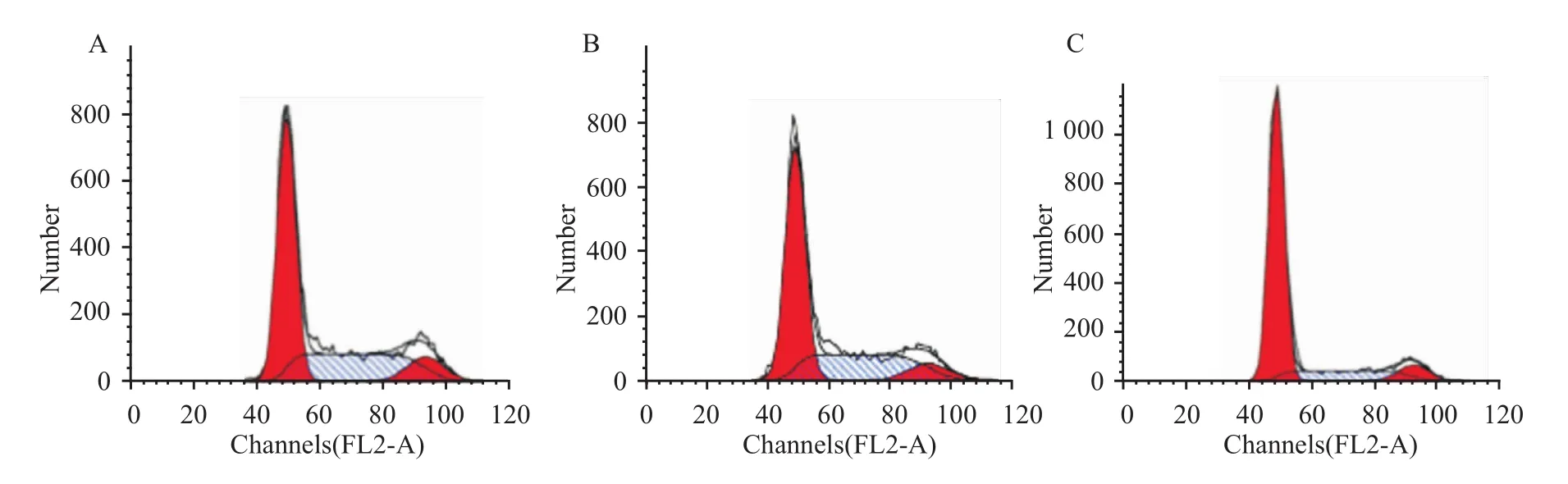
Fig 5 Cell cycle distribution of CNE-1 infected with siRNAA:Blank group;B:Control group;C:Experimental group
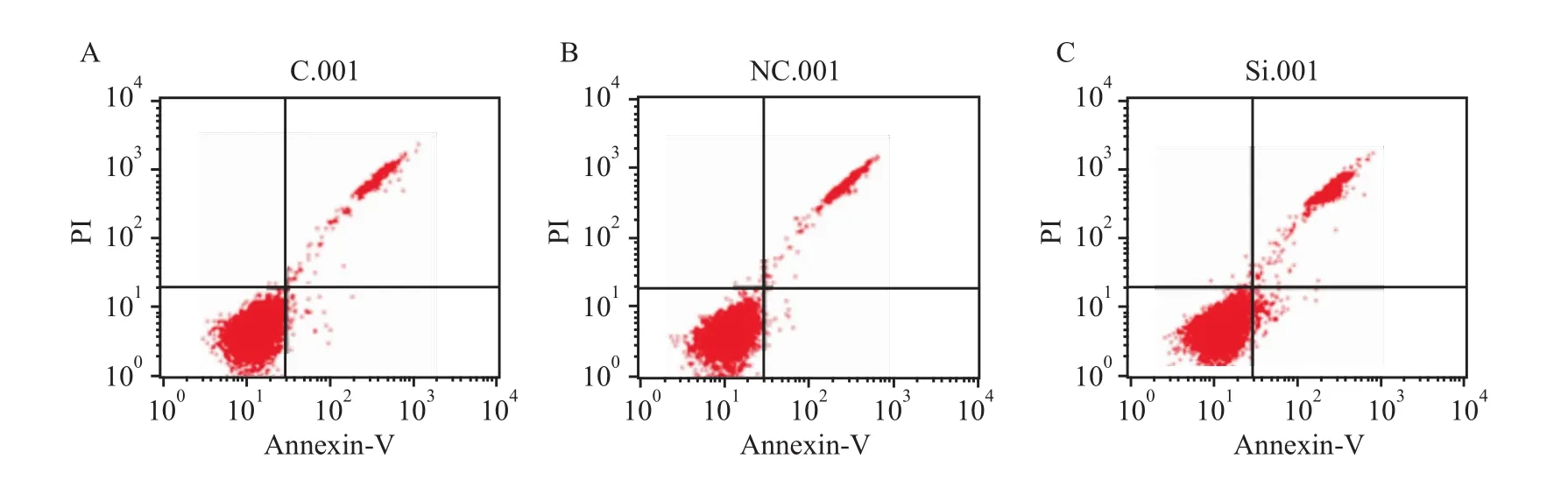
Fig 6 Cell apoptosis of MDA-MB-231 infected with siRNA measured by flow cytometryA:Blank group;B:Control group;C:Experimental group

Fig 7 Cell growth curve measured by CCK-8
4 討論
Bmi-1基因是多梳基因家族的成員,參與細胞的增殖調控,對造血干細胞自我更新及分化潛能起著至關重要的作用[6-7]。已有研究證實,Bmi-1的表達水平與多種腫瘤的惡性程度和轉移能力有關。那么,Bmi-1是否與鼻咽癌的侵襲轉移等惡性生物學行為相關呢?為探討這個問題,本實驗采用了前期課題組篩選出的針對Bmi-1基因有干擾效果的siRNA,研究Bmi-1被沉默后,鼻咽癌細胞株CNE-1生物學行為的變化。采用基質膠模型來研究腫瘤細胞侵襲遷移,它可以在體外模擬腫瘤細胞降解細胞外基質和穿過基底膜的侵襲遷移過程。敲除Bmi-1基因后,CNE-1細胞侵襲、遷移能力明顯下降,細胞被阻滯在S期,說明Bmi-1與鼻咽癌的惡性發展過程有密切關系。
Bmi-1在腫瘤的發展中起重要作用,它可負向調節ink4a位點,下調p16Ink4a和p19Arfde的表達,從而抑制c-myc基因誘導凋亡的作用,導致腫瘤的發生[8-10]。Bmi-1過表達可引起上皮間質轉化(epithelial to mesenchymal transtion,EMT),EMT促進鼻咽癌細胞的浸潤和轉移,并靶向作用于腫瘤抑制子PTEN,激活 PI3k/AKT/Snail途徑,抑制 E-cadherin生成,促進鼻咽癌的發生發展[11-12]。
Bmi-1可能通過不同的途徑在轉錄或翻譯水平調控與鼻咽癌侵襲轉移相關基因的表達。一方面,Bmi-1作為細胞癌基因,被激活后高表達于鼻咽癌細胞中,參與調控細胞的分裂。高表達Bmi-1的細胞通過抑制p16INK4a表達,延長細胞的增殖周期,阻止細胞凋亡[13]。在轉基因鼠中,Bmi-1表達抑制導致其神經功能上的缺失,還引起淋巴細胞的細胞周期嚴重停滯,而過表達Bmi-1的轉基因鼠則引發了鼠的淋巴瘤[14]。因此,有可能因為 Bmi-1下調p16INK4a的表達而導致乳腺癌細胞周期延長,增殖旺盛。另一方面,Bmi-1也可能在蛋白水平直接與腫瘤浸潤轉移相關因子發生作用,但有關這方面的文獻極少,有待進一步研究。今后的實驗重點就是找出Bmi-1作用的下游靶基因,探明Bmi-1促進鼻咽癌侵襲轉移的分子機制。總之,本研究說明Bmi-1在鼻咽癌的惡性發展中有重要作用。Bmi-1被沉默后,可以明顯抑制鼻咽癌細胞株CNE-1的侵襲、遷移能力。但是,Bmi-1基因在鼻咽癌發生發展中的作用機制,以及在侵襲遷移中的分子機制和信號通路尚需進一步的研究。我們相信本研究將為臨床治療鼻咽癌提供新的策略。
參考文獻:
[1] Van Louhizen M,Verbeek S,Scheijen B,et al.Identification of cooperating oncogenes in E mu-myc transgenic mice by provirus tagging[J].Cell,1991,65(5):737-52.
[2] Joensuu K,Hagstrom J,Leidenius M,et al.Bmi-1,c-myc,and Snail expression in primary breast cancers and their metastases-elevated Bmi-1 expression in late breast cancer relapses[J].Virchows Arch,2011,459(1):31-9.
[3] Lukacs R U,Memarzadeh S,Wu H,et al.Bmi-1 is a crucialregulator of prostate stem cell self-renewal and malignant transformation[J].Cell Stem Cell,2010,7(6):682-93.
[4] Kim J H,Yoon SY,Jeong S H,et al.Overexpression of Bmi-1 oncoprotein correlates with axillary lymph node metastases in invasive ductal breast cancer[J].Breast,2004,13(5):383-8.
[5] Song W,Tao K,Li H,et al.Bmi-1 is related to proliferation,Survival and poor prognosis in pancreatic cancer[J].Cancer Sci,2010,101:1754-60.
[6] Ye Q H,Qin L X,Forgues M,et al.Predicting hepatitis B viruspositive metastatic hepatocellular carcinomas using gene expression profi ling and supervised machine learning[J].Nat Med,2003,9:416-23.
[7] Wu J,Hu D.Down-regulation of BMI-1 cooperates with artemisinin on growth inhibition of nasopharyngeal carcinoma cells[J].J Cell Biochem,2011,112(7):1938-48.
[8] Park IK,Morrison SJ,Clarke M F.Bmi1,stem cells,and senescence regulation[J].Clin Invest,2004,113:175-9.
[9] Jiang L,Li J,Song L.Bmi-1,stem cells and cancer[J].Acta Biochim Biophys Sin(Shanghai),2009,41:527-34.
[10]Dimri GP,Martinez JL,Jacobs JJ,et al.The Bmi-1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells[J].Cancer Res,2002,62:4736-45
[11]Song L B,Zeng M S,Liao WT,et al.Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells[J].Cancer Res,2006,66(12):6225-32.
[12]Song L B,Li J,Liao WT,et al.The polycomb group protein Bmi-1 represses the tumor suppressor PTEN and induce epithelial-mesenchymal transition in human nasopharyngeal epithelial cells[J].J Clin Invest,2009,119(12):3626-36.
[13]Park IK,Qian D,Kiel M,et al.Bmi-1 is required for maintenance of adult self-renewing haematopoietic stem cells[J].Nature,2003,423(6937):302-5.
[14]沈存思,范方田,陶 麗,等.抑癌基因PTEN與腫瘤血管生成研究進展[J].中國藥理學通報,2013,29(5):597-600.
[14]Shen CS,Fan F T,Tao L,et al.Review of PTEN in tumor angiogenesis[J].Chin Pharmacol Bull,2013,29(5):597-600.

