呫噸酮并吡啶衍生物XP-16誘導人肺癌A549細胞凋亡
戴支凱,楊成芳,陳毅飛,蔣君男,車冠華,覃江克
(1.桂林醫學院藥理學教研室,廣西桂林 541004;2.廣西師范大學化學化工學院藥用資源化學與藥物分子工程國家重點實驗室,廣西桂林 541004)
呫噸酮(xanthone,氧雜蒽酮)類化合物是以呫噸酮為母體的一類化合物,主要存在于龍膽科和藤黃科植物中,是近代天然產物中的一類重要活性成分。祖國傳統醫學早已應用含呫噸酮類化合物的植物治療多種疾病[1]。現代藥理學研究顯示,呫噸酮類化合物具有調節機體免疫、呼吸及胃腸功能、降血壓、抗炎、抗過敏、抗氧化、抗血栓形成、抗腫瘤、抗HIV-1和延緩神經系統退行性疾病進程等活性[2]。腫瘤是威脅人類健康的一類疾病,呫噸酮類化合物的抗腫瘤作用已引起了醫藥學界的廣泛關注[3-5],但其抗腫瘤應用前景有待進一步探究[6],這就需要將呫噸酮類化合物的分離和合成與藥理學緊密結合,篩選出具有活性的先導化合物,并采用化學修飾等手段,使之成為廣譜、高靶向、低毒的抗腫瘤藥物[7]。為此,我們合成了呫噸酮的衍生物5,9-二(2-吡咯烷基乙酰氨基)-7H-吡啶并[4,3-c]呫噸-7-酮[N,N′-(7-oxo-7H-chromeno[3,2-h]quinoline-5,9-diyl)-bis(2-(pyrrolidin-1-yl)acetamide),XP-16],抗腫瘤篩選顯示,XP-16具有良好的抗腫瘤作用[8]。本研究以人肺癌細胞株A549為研究對象,初步探索了XP-16抗腫瘤的可能作用機制。
1 材料與方法
1.1 材料
1.1.1 細胞培養與試劑 人肺癌A549細胞(中國科學院上海生命科學研究院細胞資源中心)于含10%胎牛血清的 RPMI 1640培養基中,37℃、5%CO2培養箱中培養,按常規方法進行傳代培養。RPMI 1640培養基(Gibco公司,美國);胎牛血清(杭州四季青生物工程材料有限公司);5氟尿嘧啶(5-FU,上海旭東海普藥業有限責任公司);胰蛋白酶、噻唑藍(MTT)、Fura-2/AM、Hoechst 33258、羅丹明 123(R123)和碘化丙啶(PI)(Sigma公司,美國);TRIzol Regent、Prime ScriptTMRT reagent kit和引物[18S,Forward:5′-GAACGAGACTCTGGCATGCTAA-3′,Reverse:5′-ACGCCACTTGTCCCTCTAAGAA-3′;金屬硫蛋白 1A(metallothionein 1A,MT-1A),Forward:5′-CTCGAAATGGACCCCAACTG-3′,Reverse:5′-CAGCCCTGGGCACACTTG-3′;Bad,Forward:5′-AGTGACCTTCGCTCCACATC-3′, Reverse: 5′-CACGGATCCTCTTTTTGCAT-3′]由大連寶生物工程有限公司提供;POWER SYBR?GREEN PCR Master Mix(Applied Biosystems公司,美國)。
1.1.2 儀器設備 550型酶標儀(BioTek公司,美國);DM4000b型熒光顯微鏡(Leica公司,德國);Cary Eclipse熒光分光光度計(Agilent公司,澳大利亞);TU1810型紫外可見分光光度計(北京普析儀器有限責任公司);Mastercycler Gradient Cycler(Eppendorf AG公司,德國);iQ5 Multicolor Real-Time PCR Detection System(BioRad公司,美國)。
1.2 方法
1.2.1 XP-16對A549細胞增殖的影響 A549細胞接種于3個96孔板,每孔9 000個細胞,分為陰性對照組(Control,RPMI 1640)、陽性對照組(5-FU,100μmol·L-1,RPMI 1640配制)和5個10倍梯度的試藥組(0.01~100μmol·L-1,RPMI 1640配制),每組設4個平行孔。3個96孔板分別用于藥物作用24、48和72 h的檢測。藥物作用結束前4 h,加入5 g·L-1的MTT。結束培養后,棄上清,每孔加入150μl DMSO,于酶標儀570 nm檢測各孔的吸光度值(absorbance value,A value),計算細胞存活率和XP-16對A549細胞增殖抑制的IC50。實驗重復3次。藥物作用72 h后,小心吸棄上清,倒置顯微鏡下觀察細胞形態。
為進一步觀察XP-16對腫瘤細胞克隆的影響,A549細胞接種于6孔板,每孔100個細胞。次日分組加藥,藥物作用24 h后換成完全培養基,繼續培養10 d,吉姆薩染色,倒置顯微鏡下計數各組的細胞集落數(每個集落的細胞數大于50個細胞)。實驗重復3次,計算 XP-16對 A549細胞克隆抑制的IC50。
1.2.2 熒光顯微鏡觀察細胞凋亡 藥物作用A549細胞24 h后,應用終濃度為20 mg·L-1的PI和10 mg·L-1的Hoechst 33258染色。正常細胞染色質呈均一的藍染;早期凋亡細胞核染色質聚集,呈亮藍色;晚期凋亡細胞核碎裂,藍染,或核裂解后呈紅染。熒光倒置顯微鏡下觀察并計數凋亡細胞,計算A549細胞的凋亡百分率。
1.2.3 細胞內鈣([Ca2+]i)檢測 激發波長分別為340 nm和380 nm、發射波長為510 nm測定Fura 2-AM熒光強度比率(F340,510/F380,510),能間接反映[Ca2+]i的變化[9]。收集 A549細胞,加入終濃度為5μmol·L-1的 fura 2-AM,37℃避光孵育 30 min。洗去細胞懸液中殘余的Fura 2-AM,制成5×108·L-1的細胞懸液,37℃避光20 min。熒光分光光度計測定F340,510/F380,510比率。實驗結果以給藥前的平均比率進行標準化,用ˉx±s表示。
1.2.4 線粒體膜電位(mitochondrial membrane potential,Δψm)測定 細胞負載R123后,其熒光強度能間接反映線粒體膜去極化程度[10]。A549細胞中,加入終濃度為500 nmol·L-1的R123,37℃避光負載30 min。D-Hanks洗3遍,再用 D-Hanks液重懸細胞至4×108·L-1。熒光分光光度計測定熒光強度(激發波長488 nm,發射波長535 nm)。測定藥物作用24 h后的熒光強度。實驗結果以xˉ±s表示。
1.2.5 Real-time RT-PCR 收集藥物作用24 h后的A549細胞,采用TRIzol法收集總RNA。經氯仿萃取、異丙醇沉淀、75%乙醇洗滌、DEPC水溶解后,測定RNA的含量,制成50 mg·L-1RNA樣品。RT(37℃,15 min;85℃,5 s)和 PCR(95℃ 10 min;95℃15 s,60℃ 1 min,40個循環)后,計算目的基因的相對表達量。
1.2.6 統計學分析 實驗數據用xˉ±s表示,應用SPSS15.0統計學軟件,組間比較采用單因素方差分析。
2 結果
2.1 A549細胞體外增殖 XP-16作用A549細胞72 h后,陰性對照組細胞達到融合,存在少量脫落細胞。與陰性對照組比,XP-16作用后的細胞密度下降,細胞碎片增多,亦可見貼壁或懸浮的體積縮小的圓形細胞。MTT檢測顯示(Fig 1A),隨給藥劑量的增加和作用時間的延長,A549細胞的存活率逐漸下降。XP-16作用A 549細胞24、48和72 h的IC50分別為33.4、11.1和1.8μmol·L-1。XP-16作用A549細胞24 h后,隨XP-16劑量的增加,A549細胞克隆數逐漸減少,其中,XP-16的10和100μmol·L-1組的克隆數明顯降低(Fig 1B),其克隆抑制的IC50為 3.48μmol·L-1。
2.2 Hoechst 33258和 PI染色 熒光染色顯示(Fig 2),正常細胞染色質呈均一的藍染;早期凋亡細胞核染色質聚集,呈亮藍色;晚期凋亡細胞核碎裂,藍染,或核裂解后呈紅染。陰性對照組凋亡細胞極少。與陰性對照組比,XP-16作用后的凋亡細胞和死亡細胞明顯增多。其中,陰性對照組的凋亡細胞百分率為(3.6±2.8)%,10、50和100μmol·L-1的XP-16作用后的凋亡細胞百分率分別為(18.6±2.7)%、(34.4±5.6)%和(41.9±4.7)%,均高于陰性對照組(P<0.01)。
2.3 [Ca2+]i和 Δψm 熒光分光光度計檢測(Fig 3A)顯示,A549細胞負載 Fura 2/AM后,F340,510/F380,510比值為(2.39±0.16),10、50和 100μmol·L-1的 XP-16作用后的比值分別為(2.03±0.07)、(1.49±0.14)和(1.29±0.05),均低于陰性對照組(P<0.01)。R123熒光強度檢測顯示(Fig 3B),陰性對照組R123熒光強度為(144.61±0.55)a.u.,10、50和100μmol·L-1的 XP-16作用后的熒光強度分別為(129.56±0.54)a.u.、(123.28±0.60)a.u.和(112.23±0.53)a.u.,均低于陰性對照組(P<0.01)。
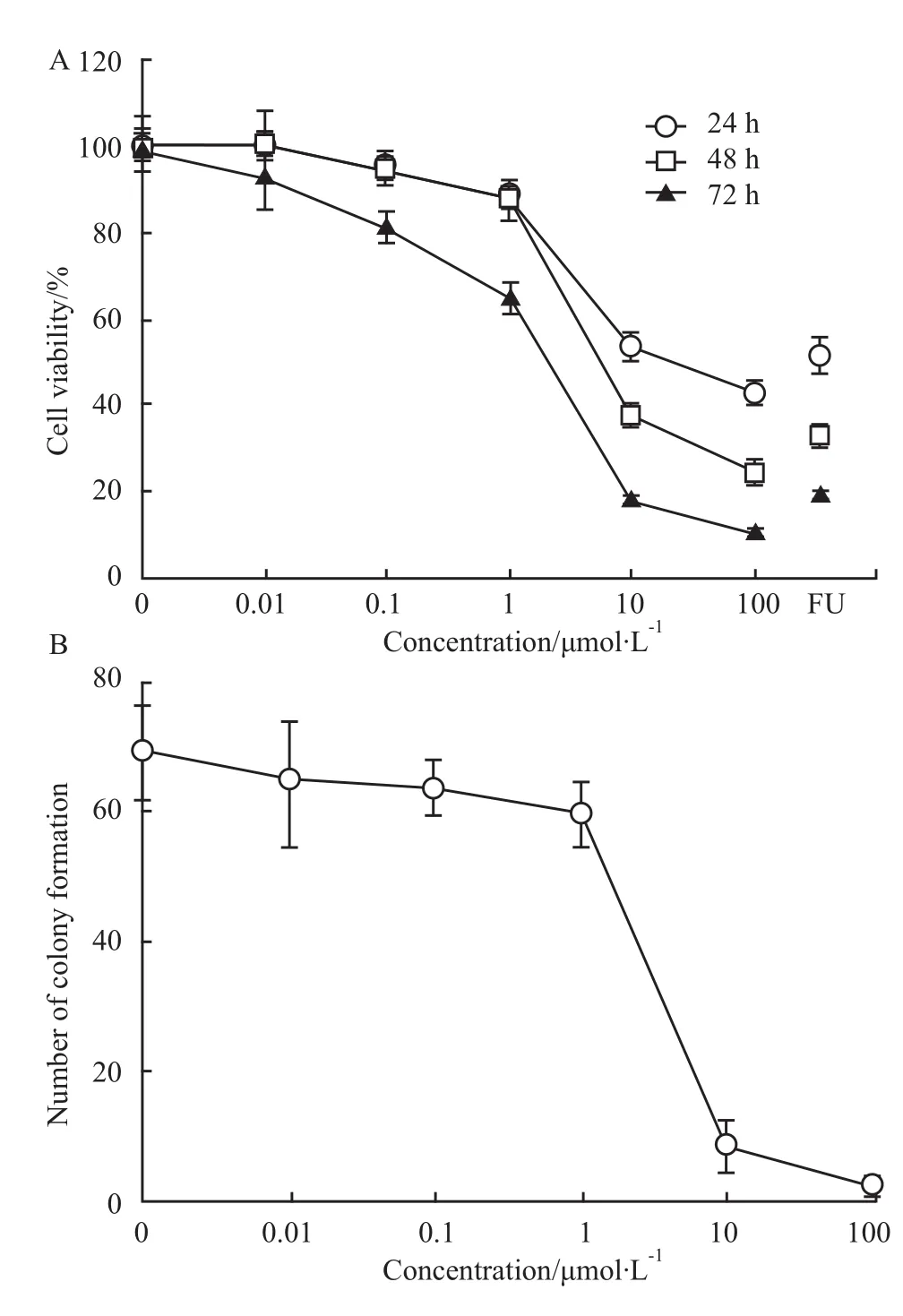
Fig 1 Effect of XP-16 on growth(A)and colony formation(B)of A549 cells

Fig 2 Hoechst 33258 and PI staining of A549 cells with XP-16 treatment(200×)A:Control;B:XP-16 10μmol·L-1;C:XP-16 50μmol·L-1;D:XP-16 100μmol·L-1
2.4 Bad和MT-1A mRNA的表達 熒光定量PCR檢測顯示(Fig 4),10、50和 100μmol·L-1的XP-16作用后,A549細胞Bad mRNA的表達分別增加26.1%、32.0%和56.8%,MT-1A mRNA的表達分別增加30.6%、168.6%和174.8%。

Fig 3 Effect of XP-16 on[Ca2+]i(A)and Δψm(B)of A549 cells**P<0.01 vs control(0μmol·L-1)
3 討論
呫噸酮類化合物具有良好的抗腫瘤發展前景[3]。我們合成了呫噸酮衍生物XP-16,具有良好的抗腫瘤前景[8]。本研究顯示,隨XP-16劑量的增加和作用時間的延長,XP-16對A549細胞增殖的抑制作用逐漸增強,XP-16作用A549細胞24、48和72 h的IC50分別為33.4、11.1和1.8μmol·L-1。細胞克隆實驗顯示,10和100μmol·L-1的 XP-16對A549細胞克隆的抑制作用明顯,其 IC50為3.48 μmol·L-1。此外,XP-16作用24 h后,A549細胞出現了明顯的凋亡形態學改變(核染色質聚集、碎裂或溶解);隨XP-16濃度的增加,凋亡A549細胞的比率逐漸增大。這些結果提示,XP-16通過誘導細胞凋亡,抑制了A549細胞增殖。
Ca2+是細胞內的一種信號分子,具有保護細胞和促進細胞死亡的雙重作用[11]。細胞內Ca2+適度升高時,Ca2+起著抗凋亡作用[12];但細胞內 Ca2+過度升高時,Ca2+起著促進細胞凋亡的作用[13]。細胞質、內質網和其它細胞器內Ca2+濃度降低時,可直接或間接引起細胞凋亡[14]。此外,線粒體功能紊亂也是導致細胞凋亡的的關鍵因素之一。線粒體膜通透性的增加可引起線粒體膜電位下降、促凋亡因子釋放(如Bad)、細胞氧化磷酸化功能障礙,從而激活細胞凋亡信號通路,最終導致細胞凋亡[15]。Bcl-2家族中的Bad具有促凋亡作用,Bad可與Bcl-xL等相互作用[16],引起促凋亡蛋白 Bax、Bak等聚集,進而促凋亡分子(如cytochrome C)從線粒體釋放進入細胞質,導致caspase激活和細胞凋亡[17-18]。本研究結果顯示,XP-16劑量依賴性地降低了A549細胞的[Ca2+]i和線粒體膜電位,上調Bad mRNA的表達。提示XP-16誘導A549細胞凋亡可能與降低細胞內Ca2+濃度和線粒體膜電位、促進Bad表達有關。
MT是一種富含半胱氨酸的小分子蛋白,與細胞的增殖和凋亡有關,可作為腫瘤侵襲程度及其預后的指標[19]。另有報道,誘導MT表達可起到抗腫瘤作用[20]。MT在腫瘤中的作用可能與腫瘤的來源、組織學類型和亞型、腫瘤生長的不均一性、腫瘤的分化、腫瘤的分期與生長方式等因素有關[21],尚待進一步研究[22]。目前,MT-1A與腫瘤的關系尚不清楚。Lu等[23]研究報道,MT-1A可通過抗凋亡和抗氧化作用,保護視網膜上皮細胞。我們以往研究報道,丹參酮IIA具有誘導細胞凋亡的作用,能升高A549細胞[Ca2+]i,下調 A549細胞 MT-1A表達[24]。本研究顯示,XP-16作用后,A549細胞生長受抑制,[Ca2+]i降低,MT-1A mRNA表達上調。我們推斷:[Ca2+]i的變化是誘導細胞凋亡的關鍵因素,MT-1A的表達上調可能是[Ca2+]i降低的結果,即MT-1A表達的變化可能是細胞內鈣離子濃度改變的下游事件,有待進一步研究。
綜上所述,XP-16具有誘導細胞凋亡的作用,可能與其降低細胞內鈣和線粒體膜電位有關。MT-1A表達的上調可能是[Ca2+]i降低的結果。

Fig 4 mRNA expression of Bad(A)and MT-1A(B)in A549 cells treated with XP-16*P<0.05,**P<0.01 vs control(0μmol·L-1)
參考文獻:
[1] 殷華芳,錢曉萍.中藥藤黃抗腫瘤研究現狀[J].現代中西醫結合雜志,2008,17(14):2264-7.
[1] Yin H F,Qian X P.Advance on anti-cancer effects of Chinese medicine Garcinia[J].Mod JIntegr Tradit Chin West Med,2008,17(14):2264-7.
[2] Fotie J,Bohle D S.Pharmacological and biological activities of xanthones[J].Anti-infect Agents Med Chem,2006,5(1):15-31.
[3] Pouli N,Marakos P.Fused xanthone derivatives as antiproliferative agents[J].Anticancer Agents Med Chem,2009,9(1):77-98.
[4] Wang H,Wei L,Yan H,et al.Antitumor activity and DNA-binding investigations of isoeuxanthone and its piperidinyl derivative[J].Chem Pharm Bull(Tokyo),2013,61(6):599-603.
[5] Azevedo CM,Afonso CM,Sousa D,et al.Multidimensional optimization of promising antitumor xanthone derivatives[J].Bioorg Med Chem,2013,21(11):2941-59.
[6] Skalli S,Zaid A,Soulaymani R.Drug interactions with herbal medicines[J].Ther Drug Monit,2007,29(6):679-86.
[7] 戴支凱,程訓佳.呫噸酮類化合物的抗腫瘤研究進展[J].中國藥學雜志,2010,45(22):1701-4.
[7] Dai Z K,Cheng X J.Advances on anticancer effects of xanthone derivatives[J].Chin Pharm J,2010,45(22):1701-4.
[8] 覃江克,韓留玉,楊政敏,等.胺基烷酰胺基呫噸酮并吡啶衍生物及其制備方法和應用[P].中華人民共和國發明專利,申請號:200910114144.9,2009-11-11.
[8] Qin JK,Han L Y,Yang ZM,et al.The preparative methods and application of aminoalkanamido-substituted xanthono-pyridine derivatives[P]:China,200910114144.9.2009-11-11.
[9] Ni X,Sullivan G J,Martin-Caraballo M.Developmental characteristics of AMPA receptors in chick lumbar motoneurons[J].Dev Neurobiol,2007,67(11):1419-32.
[10]Ward M W,Rego A C,Frenguelli B G,et al.Mitochondrial membrane potential and glutamate excitotoxicity in cultured cerebellar granule cells[J].J Neurosci,2000,20(19):7208-19.
[11]Orrenius S,Zhivotovsky B,Nicotera P.Regulation of cell death:the calcium-apoptosis link[J].Nat Rev Mol Cell Biol,2003,4(7):552-65.
[12]Yano S,Tokumitsu H,Soderling T R.Calcium promotes cell survival through CaM-K kinase activation of the protein-kinase-B pathway[J].Nature,1998,396(6711):584-7.
[13]Rekasi Z,Czompoly T,Schally A V,et al.Antagonist of growth hormone-releasing hormone induces apoptosis in LNCaP human prostate cancer cells through a Ca2+-dependent pathway[J].Proc Natl Acad Sci USA,2005,102(9):3435-40.
[14]Baffy G,Miyashita T,Williamson J R,et al.Apoptosis induced by withdrawal of interleukin-3(IL-3)from an IL-3-dependent hematopoietic cell line is associated with repartitioning of intracellular calcium and isblocked by enforced Bcl-2 oncoprotein production[J].J Biol Chem,1993,268(9):6511-9.
[15]Ly J D,Grubb D R,Lawen A.The mitochondrial membrane potential(deltapsi(m))in apoptosis;an update[J].Apoptosis,2003,8(2):115-28.
[16]Willis S N,Chen L,Dewson G,et al.Proapoptotic Bak is sequestered by Mcl-1 and Bcl-xL,but not Bcl-2,until displaced by BH3-only proteins[J].Genes Dev,2005,19(11):1294-305
[17]Wei M C,Zong W X,Cheng E H,et al.Proapoptotic BAX and BAK:a requisite gateway to mitochondrial dysfunction and death[J].Science,2001,292(5517):727-30.
[18]劉躍亮,羅進勇,張 彥,等.雙氫青蒿素對人骨肉瘤細胞株143B增殖和凋亡的作用[J].中國藥理學通報,2012,28(12):1719-23.
[18]Liu Y L,Luo J Y,Zhang Y,et al.Role of dihydroartemisinin(DHA)in proliferation and apoptosis of human osteosarcoma 143B cells[J].Chin Pharmacol Bull,2012,28(12):1719-23.
[19]Yap X,Tan H Y,Huang J,et al.Over-expression of metallothionein predicts chemoresistance in breast cancer[J].J Pathol,2009,217(4):563-70.
[20]Majumder S,Roy S,Kaffenberger T,et al.Loss of metallothionein predisposes mice to diethylnitrosamine-induced hepatocarcinogenesis by activating NF-kappaB target genes[J].Cancer Res,2010,70(24):10265-76.
[21]Jin R,Huang J,Tan P H,et al.Clinicopathological significance of metallothioneins in breast cancer[J].Pathol Oncol Res,2004,10(2):74-9.
[22]張 燕,肖婷婷,沈祥春.金屬硫蛋白的功能及藥理作用研究進展[J].中國藥理學通報,2010,26(6):821-4.
[22]Zhang Y,Xiao T T,Shen X C,et al.The advance role and pharmacological effects of metallothionein[J].Chin Pharmacol Bull,2010,26(6):821-4.
[23]Lu H,Hunt D M,Ganti R,et al.Metallothionein protects retinal pigment epithelial cells against apoptosis and oxidative stress[J].Exp Eye Res,2002,74(1):83-92.
[24]戴支凱,石京山,吳 芹,等.丹參酮ⅡA抗人肺癌A549細胞凋亡[J].中國藥理學通報,2010,26(11):1505-8.
[24]Dai Z K,Shi J S,Wu Q,et al.Apoptosis inducing effect of tanshinoneⅡA on human lung adenocarcinoma A549 cells[J].Chin Pharmacol Bull,2010,26(11):1505-8.

