試驗(yàn)方法延長(zhǎng)順酐分析用試劑適用期
王翠明(新疆鄯善吐哈石油天然氣化工廠 838200)
一、引言
順酐鐵含量分析時(shí)所用到的還原劑抗壞血酸很不穩(wěn)定,只能保存10天,10天后重新配制,為延長(zhǎng)抗壞血酸溶液的有效使用時(shí)間,節(jié)約試劑,提高工作效率,故提出對(duì)抗壞血酸的配制方法進(jìn)行改進(jìn)。
1.抗壞血酸的結(jié)構(gòu)性質(zhì)及變質(zhì)機(jī)理
抗壞血酸(C6H8O6)),又稱維生素C,無(wú)色片狀或針狀晶體味酸,溶于水,乙醇,不溶于乙醚,氯仿,苯,石油醚,和油脂,不耐熱。純品干燥時(shí)在空氣中穩(wěn)定,非純品易被氧化,見光會(huì)慢慢變色,在水溶液中即很快分解,微跡量金屬離子可加速其氧化,成為酮式結(jié)構(gòu)。
(1)抗壞血酸的酸性:抗壞血酸屬于不飽和多元醇內(nèi)酯,由其結(jié)構(gòu)式以看出,分子中的羰基和稀二醇結(jié)構(gòu),使羰基上的氫變的較易離解,因而其水溶液有較強(qiáng)的酸性(pH值在3.5~5.0之間)。
(2)抗壞血酸的氧化:
a金屬離子對(duì)抗壞血酸的氧化作用:有關(guān)資料表明,在有微跡量金屬離子存在時(shí),抗壞血酸更易被催化氧化分解,金屬離子與抗壞血酸的氧化還原反應(yīng)機(jī)理,以Cu2+為例說(shuō)明:反應(yīng)過(guò)程中,Cu2+消耗量與加入的抗壞血酸量為1:1,Cu2+一部分被還原到Cu+,另一部分催化抗壞血酸自氧化為脫氫抗壞血酸。
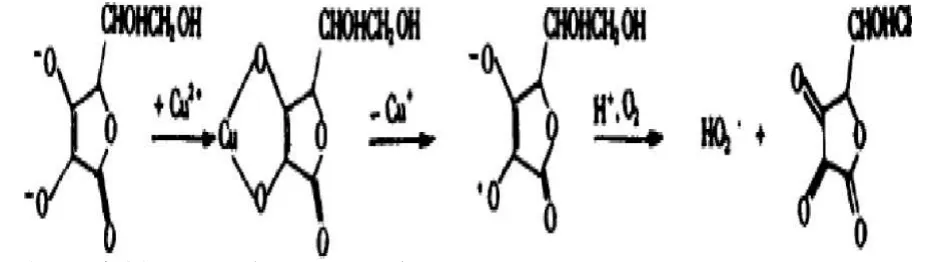
二、消除影響抗壞血酸變質(zhì)的途徑
我廠配藥所用脫鹽水中含微量Cu2+,K,+Na+,Fe,3+Al3+(控制指標(biāo)為2mg/l),這些離子能嚴(yán)重的加劇抗壞血酸的氧化,因此其使用的有效期很短。為有效的解決抗壞血酸的使用期限問(wèn)題,我們作了以下嘗試。
1.消除金屬離子對(duì)抗壞血酸的影響
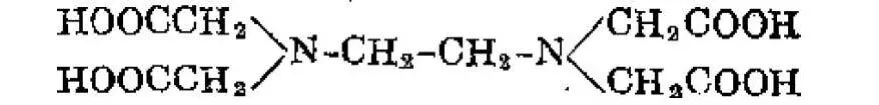
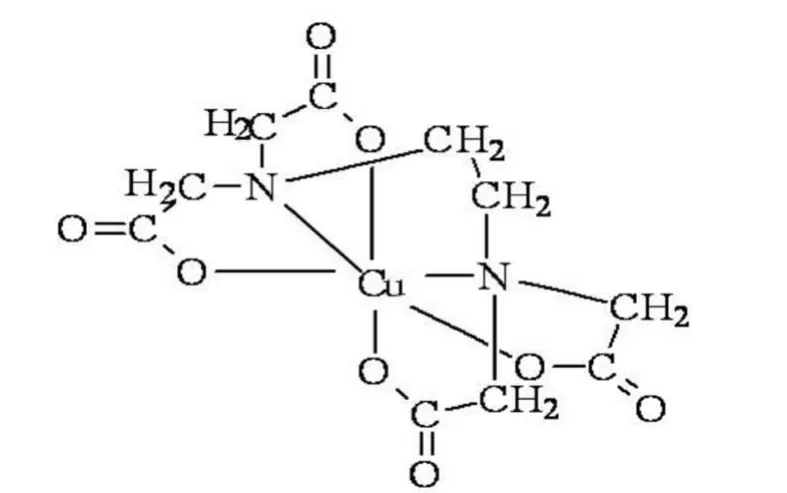
在此,我們加入了EDTA,即乙二胺四乙酸,它是典型的有機(jī)金屬絡(luò)和劑,EDTA分子結(jié)構(gòu)中含有絡(luò)和能力很強(qiáng)的氨氮(..N←)和羧氧(-C∥-O-)這兩種配位原子,與金屬離子結(jié)合時(shí)有六個(gè)配位原子,可形成五個(gè)五元螯合環(huán),具有很強(qiáng)的絡(luò)合性能,能與多數(shù)金屬離子形成穩(wěn)定的絡(luò)合物,將溶液中加入少量的EDTA可有效的將金屬離子絡(luò)和,而且反應(yīng)的速度較快,形成的螯合物非常穩(wěn)定。如下圖示為EDTA與銅離子形成的鰲和物。
因此,在進(jìn)行溶液配制前,我們對(duì)脫鹽水進(jìn)行了預(yù)處理,從而有效的祛除了脫鹽水中的金屬離子。
實(shí)驗(yàn)
⑴取1升脫鹽水加入0.0005mol/L的EDTA溶液1L,將Cu2+Fe,3+Al3+等金屬離子完全絡(luò)合(初步估算所加EDTA過(guò)量)。
用1L0.0004mol/L的氯化銅和過(guò)量的EDTA絡(luò)合,
⑶ 用0.001mol/L的NaOH溶液和過(guò)量的氯化銅產(chǎn)生氫氧化銅沉淀,將沉淀干燥后測(cè)定重量計(jì)算出沉淀中銅離子的含量,從而計(jì)算出和過(guò)量EDTA絡(luò)合所用的銅離子的量,這樣就能精確計(jì)算出處理1L脫鹽水所用EDTA的量。實(shí)驗(yàn)數(shù)據(jù)在下表給出。
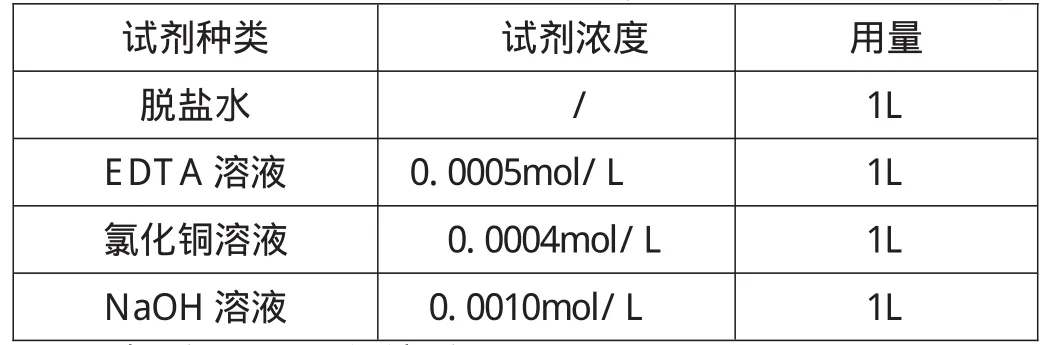
用量1L 1L 1L 1L試劑種類脫鹽水EDTA溶液氯化銅溶液NaOH溶液試劑濃度/0.0005mol/L 0.0004mol/L 0.0010mol/L
干燥后Cu(H0)2沉淀質(zhì)量 :0.02646g
反應(yīng)過(guò)程為:CuCl2+NaOH=Cu(0H)2
EDTA+Cu=EDTA-Cu
由Cu(H0)2沉淀的質(zhì)量計(jì)算出過(guò)量的EDTA的量為0.00023mol,由此,我們就能準(zhǔn)確計(jì)算出我廠1L脫鹽水需用EDTA0.04752g,就能恰好完全絡(luò)合其中的金屬離子。
綜上所述,配制100ml抗壞血酸溶液需100ml脫鹽水,此時(shí)就需要加入EDTA0.004752g,即4.0mg。
三、實(shí)驗(yàn)部分
1.改進(jìn)后的抗壞血酸在標(biāo)準(zhǔn)樣品中的適用性測(cè)定
儀器
722分光光度計(jì)
試劑
(1)鄰菲羅啉顯色的標(biāo)準(zhǔn)比色液
2.實(shí)驗(yàn)方法
(1)吸光度的測(cè)定
以未加鄰菲羅啉顯色的標(biāo)準(zhǔn)比色溶液作參比,在波長(zhǎng)510nm處,用分光光度計(jì)分別測(cè)定個(gè)每個(gè)顯色標(biāo)準(zhǔn)比色溶液的吸光度。
(2)繪制標(biāo)準(zhǔn)曲線
以100ml標(biāo)準(zhǔn)比色溶液中所含鐵的微克數(shù)為橫坐標(biāo),吸光度為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線。
(3)其他實(shí)驗(yàn)條件不變,按以上步驟用改進(jìn)法配制的抗壞血酸溶液制作校準(zhǔn)曲線。
結(jié)論
實(shí)驗(yàn)結(jié)果表明,用改進(jìn)法配制的抗壞血酸溶液測(cè)定樣品,其靈敏度,線性關(guān)系,相對(duì)誤差,均符合技術(shù)要求。改進(jìn)后的抗壞血酸溶液置棕色瓶中貯于冰箱中保存,至少可以穩(wěn)定34天,既延長(zhǎng)了使用時(shí)間,又節(jié)省了人力,節(jié)約了藥品試劑的用量,從長(zhǎng)遠(yuǎn)來(lái)看,在保證較高準(zhǔn)確度的同時(shí),節(jié)省了開支,又提高了工作效率。
[1]莎仁,韓明梅,金屬催化抗壞血酸的反應(yīng)動(dòng)力學(xué)及其應(yīng)用.武漢科技大學(xué)學(xué)報(bào).2006.32(5).201-203.
[2]陳立軍,抗壞血酸氧化還原反應(yīng)的紅外光譜分析.重慶師范學(xué)院學(xué)報(bào).2003.17(1),41-43.

