木質纖維素糖平臺基質組成結構的分析表征技術研究進展
孫付保,王亮,2,譚玲,2,曹鈺,劉健權,張震宇
(1江南大學生物工程學院,工業生物技術教育部重點實驗室和糖化學與生物技術教育部重點實驗室,江蘇無錫 214122;2華南理工大學制漿造紙工程國家重點實驗室,廣東 廣州 510640)
在當今社會,以可再生生物質資源作為原料,利用生物煉制技術大規模生產生物能源和生物基產品(生物燃料、生物基化學品和生物基材料)已成為國際上的研究熱點,以生物質資源為基本原料的生物煉制已漸漸凸顯其優勢,一個全球性的產業革命正在朝著以碳水化合物為基礎的經濟時代發展[1-2]。然而,真正的生物質經濟時代尚未到來,由于木質纖維素復雜的理化組成和多級結構的致密不均一性,致使當前在推進纖維質生物煉制工業化過程中仍面臨一系列問題[3-4],如Wyman等在分析生物煉制纖維素乙醇時認為,纖維素乙醇的過程成本占到總成本的67%,其中原料預處理的成本最高,其次是酶生產和酶水解過程[5-7]。因此,探索簡單經濟、安全高效和環境友好的木質纖維素新型預處理過程仍然是當前和今后一段時期值得關注的重點研究方向[8-10]。
在生物質原料方面,適合于生物煉制的原料來源不是單一的,它涉及許多纖維質廢棄物,這些不同種屬的原料不僅在纖維素、半纖維素和木質素三大組成含量不同,而且在每種組分內部及組分之間連接結合結構上也有很大的差異。在生物質預處理方面,目前已經涌現了很多技術[11-15],這些預處理技術從不同方面破壞木質纖維素的致密結構。而不同種屬生物質原料經不同方法預處理后的差異性就更大。因而,有必要采用現代分析手段從組織細胞、微觀和納米分子等水平上,多尺度全方位地對木質纖維素原料在預處理前、預處理后、酶解前和酶解后等各個階段進行深入系統的分析表征,不僅有助于了解不同來源(種屬和預處理)纖維基質的差異性,而且有益于理解預處理機制和優化預處理工藝,同時對后續纖維素酶選擇、酶解工藝優化和酶解機理都有指導意義。
在木質纖維素基質分析表征方面,目前針對木質纖維素組成結構進行分析表征的方法很多,如:纖維素表面質地結構的光學顯微鏡、電子顯微鏡(掃描和透射)和原子力顯微鏡觀察,化學結構里關鍵性化學鍵和官能團的(近)紅外光譜法和拉曼光譜分析,晶體特征的X射線衍射(XRD)和核磁共振(NMR)檢測等。這些分析表征方法不同程度地探究了纖維素的微觀納米結構、功能性化學基團和結晶結構,因此分別從某個方面表征了木質纖維素基質復雜的組成和多級不均一結構特點,反映了種屬和預處理后導致的纖維質差異,這對了解預處理機制和纖維質酶解機制以及優化生物質相關的預處理/酶解工藝都具有一定的指導意義。
基于此,本文著眼于目前現代儀器分析技術,尤其電子掃描顯微鏡(scanning electron microscope,SEM)、紅外光譜(infrared spectroscopy,IR)、X-射線衍射(X-ray diffraction,XRD)和核磁共振(nuclear magnetic resonance,NMR)應用于木質纖維素原料組成結構分析表征方面的研究進展,分析討論了這些方法在研究木質纖維素多糖組成結構方面的共性特征,并對個別技術應用過程中存在問題和不足進行了分析,最后總結出這些大型儀器分析方法應用于木質纖維素組成結構研究獲得的一些結論,并在此基礎上對未來木質纖維素基質的分析表征方法進行了展望。
1 木質纖維素基質的SEM觀察
目前,掃描電子顯微鏡已成為木質纖維素基質表面結構特征顯微觀察的重要技術手段。本文作者[16]用常壓甘油自催化預處理法處理小麥秸稈時利用 SEM 觀察發現,經甘油處理后,原麥草整的齊致密結構撕裂成單個或者體積較小的纖維束,纖維束松散細小,表面變得粗糙,呈現一系列不規則的微孔洞或裂痕(如圖 1)。這些結構變化增加了纖維比表面積,增加了纖維素與酶的接觸面積,增加了酶的接觸位點及酶載荷量,從而有助于提高酶解效率。
同時,SEM方法還可用于木質纖維素原料不同預處理效果的比較。本文作者[17]也利用 SEM 比較了麥草的常壓甘油自催化預處理和汽爆預處理方法,發現:常壓甘油和汽爆兩種自催化預處理方法均打破了木質纖維類生物質復雜致密的理化結構,在減小纖維的平均尺寸和增加纖維表面積的同時,也提高了纖維的粗糙度;與汽爆相比,常壓甘油水溶液預處理導致纖維束更松散,更細小,有著更多的粗糙度和比表面積(如圖2所示)。這些SEM觀察表明,各種預處理方法均影響了木質纖維素基質的表面結構,但同一種預處理方法不但在不同預處理條件下對同一種木質纖維素的預處理效果不同,同一種預處理方法在相同預處理條件下對不同種屬纖維質原料預處理效果也不同,而且不同預處理方法即使在相同預處理條件下對同一種原料的處理效果不一樣,不同預處理方法在不同條件下處理不同基質效果差異就更大。因此,不同種屬木質纖維素原料、不同預處理方法和不同預處理條件下獲得纖維基質的組成結構差異很大。

圖1 常壓甘油水溶液預處理麥草纖維表面的超微結構觀察[16]

圖2 汽爆和常壓甘油自催化預處理麥草表面結構的觀察[17]
另外,通過掃描電子顯微鏡還觀察到木質素粒子再縮合或木質素-碳水化合物復合體(Lignincarbohydrate complex,LCC)沉積在纖維表面的現象(圖3、圖4)。作者早期研究[18]中對常壓甘油自催化預處理麥草纖維表面的微觀觀察發現,纖維基質表面存在著一些細小斑點[圖 3(a)],通過進一步放大倍數[圖 3(b)、(c)]發現這些小斑點通常是由一些大小直徑約為0.1~0.2 μm的顆粒和/或一個長約0.2~0.4 μm的長條結塊構成。因此,具有超微分子結構的木質素縮合物和/或LCC可能由球形顆粒和/或塊狀物兩部分構成:球形顆粒為預處理過程中產生的木質素碎片通過再縮合而形成的木質素粒子,塊狀物質是包括半纖維素和纖維素及其降解物在內的碳水化合物。
總之,利用 SEM 只是對木質纖維素基質表面結構分析,獲得的信息和結果仍舊有限,仍需要借助其他理化分析手段才能進一步獲得準確信息。
2 木質纖維素基質的IR技術

圖3 甘油預處理麥草纖維表面的木質素-碳水化合物復合體(LCC)結構[11]

圖4 汽爆玉米芯酶解前和酶解后被純化的木質素-多糖復合體結構[18]

表1 木質纖維素基質中關鍵性化學鍵或基團特征對應的紅外光譜波數
紅外光譜已成為分析木質纖維素組成結構和化學變化的常用方法,表1總結出木質纖維素基質中關鍵性化學鍵和官能團對應的波譜。通過對各種木質纖維素預處理前后的化學基團分析表征,定性確定木質纖維素原料在預處理過程中的組成結構變化情況,以期更好地了解預處理方法對原料的作用機制和后續酶解的影響。Kim等[19]用FT-IR分析了氨水預處理玉米秸稈組成結構的化學變化,發現玉米秸稈含有愈創木基和紫丁香基兩種類型木質素,特征吸收峰分別在1218 cm?1、1268 cm?1(愈創木環C—O)、1315 cm?1(紫丁香環 C—O)和 1502~1600 cm?1(芳香骨架振動);氨循環滲漏(ammonia recycle percolation,ARP)處理后玉米秸稈樣品所有木質素吸收峰(1502~1600 cm?1)強度均比處理前明顯減弱,顯示了ARP預處理的木質素脫除效果。這方面研究表明,IR技術可用初步判斷預處理對木質纖維素基質化學組成的影響,如半纖維素和木質素脫除、纖維素/半纖維素分子內和分子間氫鍵結合、纖維素結晶度和非結晶度比例等。
同時,IR方法還可用于不同方法預處理纖維基質特征的比較。本文作者[17]先前對汽爆和常壓甘油自催化預處理麥草前后紅外分析表明(圖5),預處理前后基質在1049 cm?1處由于多聚糖(纖維素和半纖維素)中C—O—C伸展引起一個強烈的窄峰;1425 cm?1是由 C—H和 O—H彎曲造成的,1382 cm?1來源于CH2和OH彎曲,在異頭區(950~700 cm?1)的899 cm?1處小尖峰代表著多聚糖中β-葡聚糖苷鍵;與原麥草纖維相比,兩種預處理麥草纖維中在1159 cm?1和1107 cm?1處分別來源于C—O反對稱橋伸展和 C—OH骨架振動的特征峰都明顯增加,原麥草纖維在1735 cm?1處的酯鍵(C=O)峰經汽爆預處理后明顯減弱,經常壓甘油水溶液自催化預處理后幾乎消失了;這些信息表明,在汽爆和常壓甘油自催化預處理麥草的纖維中,連接多糖和木質素之間的阿魏酸、對羥基苯甲酸和對羥基肉桂酸等關鍵性酯鍵都被打斷,而且常壓甘油自催化預處理技術比汽爆技術更有效,能斷裂更多木質素和多糖之間的關鍵性酯鍵。另一方面,在 1510 cm?1和1457 cm?1處的吸收波譜,分別代表著木質素組分和芳香環的伸展,原麥草經溫和汽爆處理在此處的吸收加強而經常壓甘油水溶液自催化預處理吸收峰弱化成峰肩;這表明,汽爆自催化預處理后的麥草中仍然存有著殘渣木質素,而且木質素含量在汽爆麥草的相對含量高于在原麥草中的含量;而常壓甘油水溶液自催化預處理麥草纖維中的殘渣木質素含量已很少,相對含量比汽爆麥草中的殘渣木質素含量要低得多;IR分析表明,常壓甘油水溶液自催化預處理策略在脫出木質素方面比汽爆預處理更有效。
以上研究結果表明:①FT-IR方法用于分析表征木質纖維素基質組成結構的化學變化時,盡管有種屬和預處理方法不同,但通常有相對固定的譜帶歸屬(如表1所示);②FT-IR能定性顯示出各種方法預處理后木質纖維素組成結構變化信息,如乙酰基脫除、半纖維素/木質素鏈接酯鍵/醚鍵斷裂、纖維素分子內/間氫鍵斷裂等,能初步判斷半纖維素和木質素脫除狀況;③粗略提供纖維素分子結晶度與非結晶度比例關系,以及晶型比例等信息;④提供木質纖維素中殘存木質素類型的信息。這些信息為評價各種預處理方法對不同種屬木質素預處理效果提供了有益幫助,也為初步判斷木質纖維素后續酶解可消化性提供了幫助。然而,既然木質纖維素可消化性與許多因素有關,因此仍需要其他分析手段繼續加深對木質纖維素基質特征進行分析。
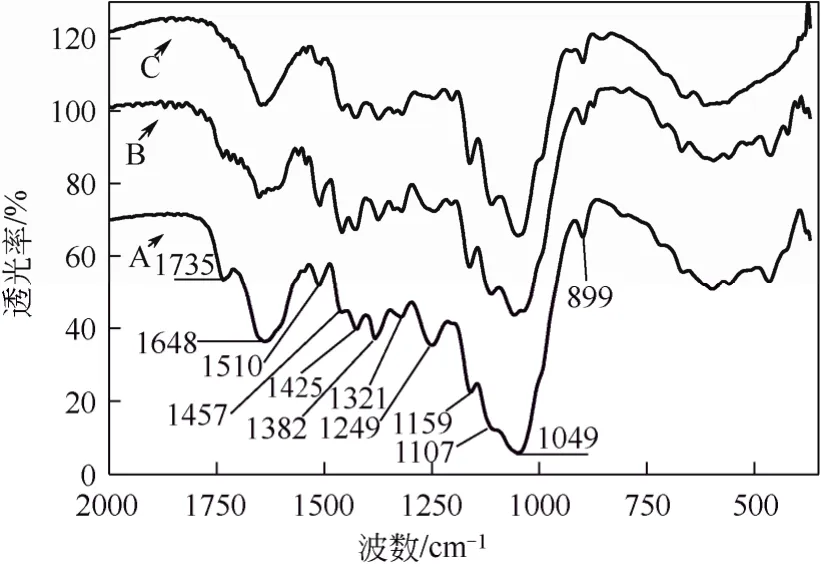
圖5 常壓甘油和汽爆自催化預處理前后麥草纖維的紅外光譜分析[17]
3 木質纖維素基質結晶結構的 XRD分析
X射線衍射(XRD)已經廣泛用于分析表征不同方法預處理的各種木質纖維素結晶度和晶體結構的變化情況。Kim等[20]利用XRD分析了石灰水預處理玉米秸的結構特征,發現石灰水處理后秸稈纖維結晶度提高可能是由于木質素/半纖維素等非結晶組分脫除而導致的。同樣,Kim 等[19]通過 XRD對ARP預處理玉米秸進行了分析,預處理后纖維結晶度指數明顯增加,認為但該預處理并未打破纖維素分子內/間氫鍵,而是由于脫除其中木質素和半纖維素等非結晶成分而纖維素相對增加所導致的。總之,研究表明,目前大多數預處理,如稀酸、稀/弱堿(石灰水、ARP)和微波等并不能作用于木質纖維素的纖維素結晶區,而是通過作用于木質纖維素非結晶區,通過脫除木質素或/和半纖維素等導致木質纖維素結晶度相對增加。
然而,Wang等[21]利用XRD對離子液AmimCl從松木溶解提取纖維素進行了分析發現,處理前松木纖維素為天然的Ⅰ型(在2θ的15°和22°出各有一個顯著峰),經離子液溶解再生出的纖維素只在2θ的25°附近有個稍寬衍射峰,表明溶解再生產品為纖維素Ⅱ型;而且發現該離子液預處理破壞了基質中纖維素的分子間/內氫鍵,使纖維結晶度明顯降低。Uju等[22]最近用XRD詳細分析了兩種離子液([Bmpy][Cl]/[Emim][OAc])預處理木質纖維素原料(甘蔗渣和桉樹)結晶度特征,發現以下幾點。①預處理甘蔗渣和桉樹纖維素都具有高結晶度,屬于纖維素Ⅰ型(天然纖維素),但桉樹纖維中含有比甘蔗渣更多的晶體結構。②離子液[Emim][OAc]處理后2種基質中代表纖維素結晶度的峰消失或減弱,[Bmpy][Cl]處理后除結晶纖維素原峰消失或減弱外,在12°出現一個纖維素Ⅱ型特征的弱峰,這些衍射方式表明經過2種離子液預處理后基質纖維素轉化為無定形和纖維素Ⅱ型,其中[Bmpy][Cl]處理后基質纖維素主要以纖維素Ⅱ型狀態存在。③進一步計算結晶度指數顯示,[Emim][OAc]預處理使桉樹纖維素結晶度指數從45%減少至21%,使甘蔗渣從42%降至30%,[Bmpy][Cl]預處理使基質纖維素結晶度指數減少不明顯,分別使桉樹和甘蔗渣纖維素結晶度指數降低至39%和37%,可能是由于該預處理方法主要使晶體纖維素從Ⅰ型轉化為Ⅱ型,而不是無定形狀態。④即使[Bmpy][Cl]預處理基質具有高的纖維素結晶度指數,后續酶解發現這些基質比[Emim][OAc]預處理基質更衣水解產糖,初步分析可能是該預處理降低了纖維素聚合度,而纖維素分子短鏈在纖維素再生過程中轉化為符合熱動力學的纖維素Ⅱ型。⑤結合酶解糖化,[Bmpy][Cl]預處理更適合用于提高木質纖維素可酶解性。
盡管純纖維素結晶度和可消化性密切相關,但對于木質纖維素卻很難測其真實的纖維素結晶度,所以常用 XRD測定包括無定形纖維素、半纖維素和木質素等非結晶物質在內整個基質的結晶度。因此,木質纖維素預處理后結晶度大小和可消化性并沒有直接對應關系,利用 XRD分析木質纖維素基質結晶度(結晶度指數)變化不能反映基質的可酶解性,對后續酶水解無明顯指導意義,但它測得纖維素Ⅱ型的晶體尺寸指標可能對評估木質纖維素可酶解性具有參考價值[12,16]。
4 木質纖維素的13C NMR結構解析
除XRD外,NMR是研究木質纖維素基質里纖維素晶體結構特征最合適的分析手段之一。由于13C NMR對于纖維素分子內部排列更靈敏,所以它測出的結晶度指數與 XRD會有所不同,它測得的結晶度指數能更準確地反映纖維素晶體實際排列[23]。纖維素NMR光譜中最有意義區域是一個分布于80~92的C4信號簇,其中有序86~92區域屬于晶體Ⅰ型(α,β)纖維素和次晶纖維素;無序80~86區域較寬,屬于無定形纖維素、纖維束表面的結晶纖維素和/或半纖維素。Wang等[21]利用13C NMR分析研究了離子液體處理前后松樹纖維質結構變化,發現原松樹包括所有纖維素和木質素的特征吸收峰,但離子液體預處理后結晶纖維素在C4(89)和C6(62)的特征吸收峰消失,僅剩下無定形纖維素在C4(84)和C6(62)的特征吸收峰,證明原松樹復雜致密的結晶結構完全轉變為無定形結構;再生纖維素光譜僅剩下纖維素和半纖維素吸收峰,沒有木質素吸收峰;松樹殘渣的光譜具有更高分辨率和木質素特征吸收峰(133、125和113),3個木質素吸收峰重疊在一起并且形成了更廣闊的吸收峰。該分析證明了離子液體預處理不僅能破壞木質纖維素中結晶纖維素的結合氫鍵,并且還作用于木質素芳香環并使其溶解。Zhang等[23]利用13C NMR研究了不同預處理前后甜高粱晶體結構變化,結合水解結果,他們發現離子液和石灰水處理使基質纖維素結晶度減小,而稀酸和汽爆處理會使結晶度增加;離子液預處理會導致纖維素發生轉型,基質纖維素結晶度從天然Ⅰ型(α,β)轉變為其他類型可能是導致水解增加的重要因素;盡管結晶度指數降低和水解率提高有些關系,但結晶度指數的下降程度和纖維素水解產糖增加沒有必然聯系,結晶度指數并不是影響酶水解的主要因素;汽爆預處理由于使基質中無定形纖維素和易水解的細微表面纖維素增加,使酶解同時發生在纖維素結晶區和非結晶區,從而增加了基質的可消化性。即使對純纖維素來說,僅僅結晶度指標也不能用來評估其可水解性。此外,與原纖維素相比,再生纖維素光譜沒有出現新信號,顯示離子液處理過程中沒有發生化學反應,這和FT-IR分析結果也是一致的。最近Husson等[24]在研究中發現,離子液體處理α纖維素后使纖維素結晶度指數從 25%下降到不到 5%,但預處理前后水解葡萄糖產量并沒有明顯變化;離子液[Emim]+[CH3COO]?預處理使較長纖維素結晶度指數無明顯變化,[Emim]+[MeO(H)PO2]?預處理使結晶度指數稍有下降(73%→58%),但后者卻使纖維素水解產糖量提高近3倍。該結果再次證明,酶水解效率和結晶度指數沒有必然的相關性,其他因素如纖維素晶型、結晶度和表面結構(比表面積和粗糙度等)應該對酶解也有較大影響。
比較XRD和NMR對木質纖維素基質組成結構分析結果,發現這兩種方法都是基于整個基質進行的纖維素結晶度、結構和晶體尺寸分析,因而在C4區域會發生半纖維素和纖維素吸收峰相重疊從而影響結晶結構測定的現象。因此,若基質中半纖維素含量較高,就會使NMR分析的結晶度指數偏高而與實際不符,這就需要其他分析方法作為補充。
5 纖維基質分析表征的新型技術
除上文所述常見的SEM表面觀察、FT-IR化學結構分析、XRD晶體結構分析和化學結構13C-NMR解析外,新近也出現一些新型分析表征方法,如高速原子力顯微鏡(atomic force microscopy,AFM)、原位原子顯微鏡(in-situ AFM)、多尺度顯譜(multi-scale visualization)和實時相關成像(correlative imagining in real time)技術等。
Igarashi等[25]利用高速AFM實時觀察單個纖維素酶組分(CBHⅠ,CBH Ⅱ)降解結晶纖維素的過程。實驗發現以下幾點。①CBH Ⅰ(TrCel7A)分子在結晶纖維素表面單向滑行,在某一時刻會類似于交通堵塞一樣集體停下來,停留片刻后又繼續前進,至于什么原因導致他們會中斷停下來,初步推斷可能是由于結晶纖維素表面的粗糙不光滑導致纖維素酶蛋白分子交通阻塞。②采用超臨界氨法處理結晶纖維素,發現結晶纖維素由晶型 Ⅰ 轉變成ⅢI,該處理能明顯增加結晶纖維素表面的可用滑道數以及滑動纖維素酶數目,這是因為結晶纖維素ⅢI表面有更多纖維素酶蛋白分子相作用的結合位點。③CBH Ⅱ(TrCel6A)單獨提前處理或與 CBH Ⅰ(TrCel7A)同時水解結晶纖維素ⅢI都會導致纖維素表面滑動酶分子數的顯著增加。因此,通過理化預處理或其他酶協同作用改進結晶纖維素表面結構狀態,如修平表面、脫除障礙物、增加滑道數和進出口數等,將有助于改進酶蛋白分子的滑動狀態,避免阻塞中斷,最終實現基質高效降解。可見,好的預處理技術應該將會增加結晶纖維素表面的纖維素酶分子結合位點,增加纖維素酶分子可用滑道數,最終有助于晶體纖維素高效水解。
Ganner等[26]利用in-situ AFM生動呈現了纖維素酶內切β-葡聚糖苷酶(EG)和外切β-葡聚糖苷酶(CBH Ⅰ和Ⅱ)單獨/協同水解纖維素基質的結構動態變化過程。通過觀察發現,纖維素由無定形區和結晶區組成,其中結晶區還可分為細小的納米結晶纖維(寬度≤15 nm,長度100~300 nm)和大的微晶(100~10 μm),納米結晶纖維因末端纖維素酶結合位點相對容易暴露出來而更容易水解,甚至比無定形區域降解還快;纖維素內/外切酶在協同水解時分工非常明確,EG和CBH Ⅱ通過脫除基質中無序的無定形區域,從而使鑲嵌于纖維素中有序的納米晶體纖維暴露出來,然后這些納米纖維被CBHⅠ有效降解而形成為新的無定形區域;分析認為纖維素酶協同作用是基質形態依賴型的,該協同作用是由分別降解無定形區和結晶區的酶之間相協作來實現的,晶體尺寸和形狀是決定晶體纖維素可水解性和水解效率的重要因素。
Chundawat等[27]利用多尺度顯譜(multi-scale visualization),包括激光掃描共聚焦顯微鏡(laser scanning confocal fluorescence microscopy,LSCM)、拉曼光譜、AFM、SEM、TEM、NMR和化學分析電子光譜學(electron spectroscopy for chemical analysis,ESCA)等,通過成像表征氨爆預處理(AFEX)前后玉米秸細胞壁細微的形態和理化性質變化,以期闡明該預處理方法在不從基質上脫除木質素和半纖維素情況下促進基質水解的機制。研究發現:AFEX首先從細胞壁部分溶解提取一部分分解產物(如氨基化合物、阿拉伯糖基寡木聚糖和木質基酚類化合物),但隨著氨氣蒸發遺失,這些物質又重新沉淀在外部細胞壁表面,導致細胞壁內部形成了像隧道一樣的納米多孔網絡;這些納米多孔的形狀、尺寸(10~1000 nm)和空間分布決定于內在的細胞壁部位和外在的預處理條件,氨爆玉米秸單位體積上孔徑表面積范圍在 0.005~0.05 nm2/nm3;氨爆預處理主要是通過斷裂木質素-碳水化合物酯鍵、部分溶解和移位細胞壁提取物到細胞壁表面,而作用于細胞壁胞間層和外部次級細胞壁部位,使細胞壁形成相互貫通如隧道狀的多孔網絡結構,這大大增加了基質的纖維素酶可及性。該研究顯示,為了促進木質纖維素基質高效水解產糖,細胞壁充分分解并不是評價和選擇預處理必須的標準。
Ding等[28]利用新型的實時相關成像技術,包括:亮視野光學顯微鏡、共焦激光掃描顯微鏡、雙色受激拉曼散射顯微鏡和原子力顯微鏡,察看了從毫米到納米級玉米秸稈細胞壁結構及其被纖維素酶水解的變化過程,評估了化學預處理后細胞壁結構在納米水平的變化及其對后續微生物酶降解的影響,得到以下結論。①真菌纖維素酶(cellulose)是相對較小的多酶混合物(mixture),細菌纖維素酶(cellulosome)是個體較大的多酶復合體(multi-enzyme complex)。②兩種纖維素酶消化植物細胞壁機制明顯不同,細菌纖維素酶主要作用于細胞壁表面,從細胞壁表面逐步剝離下單個微纖維束,而真菌纖維素酶除作用于表面外,還能穿過細胞壁表面孔洞或裂縫進入細胞壁內部的微纖維束網絡,水解周邊成空洞或凹陷深坑,所以真菌纖維素酶水解效率比細菌纖維素酶要高(約5倍)。③纖維素分子疏水面是微生物酶易于結合的關鍵區域,在初級細胞壁中疏水面是外露的,但在次級細胞壁中是被木質素屏蔽的(薄壁細胞中部分屏蔽,厚壁纖維細胞中全部屏蔽),所以強化纖維素酶與纖維素疏水表面區域的接觸將是實現木質纖維素高效降解的有效方式。④通過溫和預處理脫除木質素發現,實驗中幾乎不存在木質素的無效吸附現象,木質素含量與細胞壁的纖維素酶接觸結合具有很好的負相關性,這說明木質素的物理障礙是阻礙木質纖維素水解的關鍵。⑤理想的預處理方法應該是溫和的,只是從細胞壁中脫除木質素;在盡量脫除木質素同時,不使纖維素和半纖維素損失,也不使它們的天然質地構造發生變化,盡可能保持天然纖維相對松散、多孔原生狀的質地結構。可見,深入理解植物細胞壁化學或酶溶解機制,對于纖維素類生物質高效轉化為生物燃料是非常關鍵的。
6 問題與展望
針對當前儀器設備應用于木質纖維素基質組成結構分析表征領域的研究進展以及存在的問題,對新型分析表征技術在木質纖維素預處理和酶水解階段的運用提出了如下展望。
由于適合生物煉制的原料的多樣性以及目前預處理方法的多樣性,導致了分析檢測問題的復雜性。單一的分析表征技術不能滿足檢測的需求。同種生物質原料經過不同的預處理方法處理后,當前的分析技術可能檢測出不同甚至相反的結果;同樣,針對不同的生物質原料,單一的分析檢測技術可以得出不同的檢測結果。基于此,針對當前分析表征技術存在的問題,作者認為研究者應結合多種分析表征技術判定預處理以及酶解效果。此外,可以采用新型分析表征技術動態觀察預處理以及酶解階段基質的動態變化情況,更容易理解預處理及酶解機制。
[1]余強,莊新姝,袁振宏,等. 木質纖維素類生物質制取燃料及化學品的研究進展[J]. 化工進展,2012,31(4):784-791.
[2]許慶利,藍平,隋淼,等. 木質纖維素水解制取燃料乙醇研究進展[J]. 化工進展,2009,28(11):1906-1912.
[3]李江,謝天文,劉曉風. 木質纖維素生產燃料乙醇的糖化發酵工藝研究進展[J]. 化工進展,2011,30(2):284-291.
[4]Himmel M E,Ding S-Y,Johnson D K,et al. Biomass recalcitrance:Engineering plants and enzymes for biofuels production[J]. Science,2007,315(5813):804-807.
[5]Wyman C E. What is(and is not)vital to advancing cellulosic ethanol[J]. TRENDS in Biotechnology,2007,25(4):153-157.
[6]余強,莊新姝,袁振宏,等. 木質纖維素類生物質高溫液態水預處理技術[J]. 化工進展,2010,29(11):2177-2182.
[7]Wyman C E,Dale B E,Elander R T,et al. Coordinated development of leading biomass pretreatment technologies[J].Bioresour. Technol.,2005,96(18):1959-1966.
[8]李志強,江澤慧,費本華. 竹材制取生物乙醇原料預處理技術研究進展[J]. 化工進展,2012,31(3):533-540.
[9]Cao W-X,Sun C,Liu R-H,et al. Comparison of the effects of five pretreatment methods on enhancing the enzymatic digestibility and ethanol production from sweet sorghum bagasse[J]. Bioresour.Technol.,2012,111:215-221.
[10]Galbe M,Zacchi G. Pretreatment:The key to efficient utilization of lignocellulosic materials[J]. SciVerse Science Direct,2012,46:70-78.
[11]Cantu L P,Schreiber A. Comparison of pretreatment methods for rye straw in the second generation biorefinery:Effect on cellulose,hemicellulose and lignin recovery[J]. Bioresour. Technol.,2013,142:428-435.
[12]Yang M,Kuittinen S,Zhang J-H,et al. Effect of dilute acid pretreatment on the conversion of barley straw with grains to fermentable sugars[J]. Bioresour. Technol.,2013,146:444-450.
[13]Jung Y-H,Kim I J,Kim H K,et al. Dilute acid pretreatment of lignocellulose for whole slurry ethanol Fermentation[J]. Bioresour.Technol.,2013,132:109-114.
[14]Gao J,Chen L,Yuan H,et al. Ionic liquid pretreatment to enhance the anaerobic digestion of lignocellulosic biomass[J]. Bioresour.Technol.,2013,150:352-358.
[15]Qiu Z-H,Aita G M. Pretreatment of energy cane bagasse with recycled ionic liquid for enzymatic hydrolysis[J]. Bioresour.Technol.,2013,129:532-537.
[16]Sun F-B,Chen H-Z. Enhanced enzymatic hydrolysis of wheat straw by aqueous glycerol pretreatment[J]. Bioresour. Technol.,2008,99(14):6156-6161.
[17]Sun F-B,Chen H-Z. Comparison of atmospheric aqueous glycerol and steam explosion pretreatments of wheat straw for enhanced enzymatic hydrolysis[J]. Journal of Chemical Technology and Biotechnology,2008,83(5):707-714.
[18]Sun F-B,Chen H-Z. Organosolv pretreatment by crude glycerol from oleochemicals industry for enzymatic hydrolysis of wheat straw[J]. Bioresour. Technol.,2008,99(13):5474-5479.
[19]Kim T H,Kim J S,Sunwoo C,et al. Pretreatment of corn stover by aqueous ammonia[J]. Bioresour. Technol.,2003,90(1):39-47.
[20]Kim S,Holtzapple M T. Lime pretreatment and enzymatic hydrolysis of corn stover[J]. Bioresour. Technol.,2005,96(18):1994-2006.
[21]Wang X-J,Li H-Q,Cao Y,et al. Cellulose extraction from wood chip in an ionic liquid 1-allyl-3-methylimidazolium chloride(AmimCl)[J]. Bioresour. Technol.,2011,102(17):7959-7965.
[22]Uju,Shoda Y,Nakamoto A,et al. Short time ionic liquids pretreatment on lignocellulosic biomass to enhance enzymatic saccharification[J]. Bioresour. Technol.,2012,103(1):446-452.
[23]Zhang J-Z,Ma X-X,Yu J-L,et al. The effects of four different pretreatments on enzymatic hydrolysis of sweet sorghum bagasse[J].Bioresour. Technol.,2011,102(6):4585-4589.
[24]Husson E,Buchoux S,Avondo C,et al. Enzymatic hydrolysis of ionic liquid-pretreated celluloses:Contribution of CP-MAS 13C NMR and SEM[J]. Bioresour. Technol.,2011,102(15):7335-7342.
[25]Igarashi K,Uchihashi T,Koivula A,et al. Traffic jams reduce hydrolytic efficiency of cellulase on cellulose surface[J]. Science,2011,333(6047):1279-1282.
[26]Ganner T,Bubner P,Eibinger M,et al. Dissecting and reconstructing synergism:In situ visualization of cooperativity among cellulases[J]. Journal of Biological Chemistry,2012,287(52):43215-43222.
[27]Chundawat S P,Donohoe B S,da Costa Sousa L,et al.Multi-scale visualization and characterization of lignocellulosic plant cell wall deconstruction during thermochemical pretreatment[J].Energy & Environmental Science,2011,4(3):973-984.
[28]Ding S-Y,Liu Y-S,Zeng Y,et al. How does plant cell wall nanoscale architecture correlate with enzymatic digestibility[J].Science,2012,338(6110):1055-1060.

