應用DPO-PCR技術檢測腸出血性大腸桿菌O157∶H7
徐義剛,李丹丹,崔麗春,劉忠梅,李蘇龍
(1.黑龍江出入境檢驗檢疫局檢驗檢疫技術中心,黑龍江 哈爾濱 150001;2.海南出入境檢驗檢疫局檢驗檢疫技術中心,海南 海口 570125;3.東北林業(yè)大學研究生院,黑龍江 哈爾濱 150040)
腸出血性大腸桿菌(enterohemorrhagic Escherichia coli,EHEC)是大腸桿菌的一個亞型,主要致病菌株血清型為O157∶H7,呈全球性分布,可產生志賀氏毒素樣細胞毒素[1-2]。畜禽為本病儲存宿主和主要傳染源,如牛、羊、豬等,以牛帶菌率最高。EHEC O157∶H7傳播途徑復雜多樣,主要通過進食被污染的食物、水或與病人接觸而傳染,出現(xiàn)腹瀉、出血性結腸炎、溶血性貧血和溶血性尿毒綜合征等臨床癥狀[3-6]。常見被污染的食物有牛肉、牛奶及其制品、禽肉、羊肉、蔬菜和水果等,快餐類食品極易造成暴發(fā)性食物中毒。EHEC O157∶H7引起的危害受到廣泛關注,建立快速、準確的檢測方法對防控該致病菌具有重要意義。
傳統(tǒng)的檢測方法(分離培養(yǎng)結合生化與血清學鑒定)檢測時間長、敏感性差、嚴重影響檢測效率[7-8]。為滿足EHEC O157∶H7快速檢測要求,研發(fā)出了免疫磁珠富集法[9]、生物傳感器法[10-12]、蛋白芯片[13]、基因芯片[14]、聚合酶鏈式反應(polymerase chain reaction,PCR)[15-20]、實時熒光PCR[21-23]和LAMP[24]等檢測方法。其中,PCR方法因檢測快速、靈敏度高,成為主要采用的檢測方法。引物設計是建立有效PCR方法的關鍵因素,常規(guī)的PCR引物設計,不僅需要反復優(yōu)化引物的各項參數(shù)與反應條件,尤其是退火溫度,而且需要反復比對引物的特異性,以防止非特異性擴增,尤其是涉及多重PCR方法設計時,需要大量的實驗以驗證方法的特異性,費時又費力。
雙啟動寡核苷酸引物(dual-priming oligonucleotide,DPO)是一種新型的引物設計方法:DPO引物分為2個部分,即長5’-端(18~25 bp,Tm>65 ℃)和短3’-端(6~12 bp,GC含量為40%~80%),兩者間用多聚次黃嘌呤連接;基于DPO引物的特殊結構,引物自身以及引物間難形成二級結構且對退火溫度不敏感,實驗過程中不需要對引物進行篩選以及對退火溫度進行優(yōu)化,簡化了引物設計和實驗步驟;擴增時,只要DPO引物5’-端或3’-端有3 個以上堿基發(fā)生錯配,PCR擴增就會終止,有效地阻斷了非特異性擴增,特異性更強[25-28]。本研究利用該技術,建立了EHEC O157∶H7基于DPO引物的PCR檢測方法。
1 材料與方法
1.1 材料
1.1.1 菌株
本研究所用實驗菌株有:腸出血性大腸桿菌O157∶H7 ATCC 35150、產腸毒素大腸桿菌ATCC 35401、腸侵襲性大腸桿菌ATCC 43893、腸致病性大腸桿菌ATCC 43887、大腸桿菌ATCC 25922、阪崎腸桿菌ATCC 51329、單核細胞增生李斯特氏菌ATCC 19111、嗜水氣單胞菌ATCC 7966、空腸彎曲菌ATCC 33560、變形桿菌ATCC 49027、沙門氏菌ATCC 10708、志賀氏菌ATCC 12022、金黃色葡萄球菌ATCC 29213、小腸結腸炎耶爾森氏菌ATCC 9610、粘質沙雷菌ATCC 14756、肺炎克雷伯氏菌ATCC 10031、霍亂弧菌ATCC 14035、副溶血弧菌ATCC 27519、溶藻弧菌ATCC 33839和創(chuàng)傷弧菌ATCC 33149 美國典型菌種保藏中心(ATCC);溶血性鏈球菌CMCC 32121 中國醫(yī)學微生物菌種保藏中心(CMCC);腸出血性大腸桿菌O157∶H7分離株2 株、擬態(tài)弧菌分離株1 株和大腸桿菌分離株2 株由本實驗室分離保存。
1.1.2 試劑
細菌基因組DNA提取試劑盒 北京天根生化科技有限公司;Taq DNA Polymerase、dNTP、MgCl2日本TaKaRa公司;復合增菌培養(yǎng)基BPW 北京蘭伯瑞生物技術公司。
1.2 方法
1.2.1 引物設計
以腸出血性大腸桿菌O157∶H7 rfbE基因為靶基因,經(jīng)BLAST分析,選取rfbE基因保守區(qū)域設計DPO引物,詳見表1,引物由上海生工生物工程公司合成。
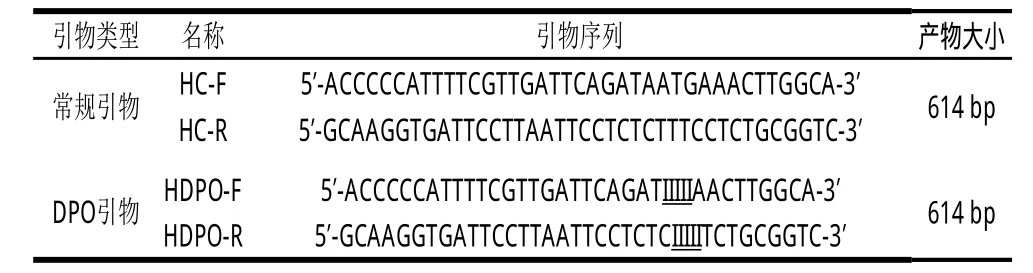
表 1 引物序列Table 1 Primers used in this study
1.2.2 細菌DNA提取
將1.1.1節(jié)中的菌株分別接種于5 mL BPW培養(yǎng)基中,培養(yǎng)過夜,取1 mL菌液,利用細菌基因組DNA提取試劑盒提取細菌DNA,-20 ℃保存?zhèn)溆谩?/p>
1.2.3 DPO-PCR反應體系優(yōu)化
反應體系為25 L:10×PCR Buffer(Mg2+free)2.5 L;Mg2+(25 mmol/L)用量范圍為0.5~5.0 L,以0.5 L遞增;dNTP(2.5 mmol/L for each)用量范圍為0.25~2.5 L,以0.25 L遞增;Taq DNA Polymerase (5 U/ L)用量范圍為0.05~0.5 L,以0.05 L遞增;DPO引物(上、下游各10 mol/L)用量范圍為0.1、0.2、0.3、0.4、0.5、1.0 L;細菌DNA 模板1 L,去離子水補充至25 L。反應條件:95 ℃ 5 min;95 ℃ 30 s,57.5 ℃ 45 s,72 ℃45 s,30 個循環(huán);72 ℃終延伸10 min。經(jīng)瓊脂糖凝膠電泳檢測擴增效果。
1.2.4 DPO-PCR退火溫度不敏感性實驗
將退火溫度范圍設為45~65 ℃,進行DPO-PCR反應,經(jīng)瓊脂糖凝膠電泳檢測其擴增效果,并與常規(guī)PCR引物進行比較。
1.2.5 DPO-PCR靈敏度實驗
將菌體濃度約為9.4×106CFU/mL的EHEC O157∶H7進行10倍梯度稀釋,提取每級稀釋度EHEC O157∶H7的基因組DNA,以此為模板進行DPO-PCR擴增,經(jīng)瓊脂糖凝膠電泳檢測確定檢測靈敏度。
1.2.6 DPO-PCR特異性實驗
利用建立的DPO-PCR方法檢測1.1.1節(jié)所示菌株以及小鼠、雞、鵝和豬腸道細菌(經(jīng)檢測不含EHEC O157∶H7)宏基因組,以驗證本方法的特異性,并與常規(guī)PCR引物進行比較。
1.2.7 方法驗證實驗
將建立的EHEC O157∶H7 DPO-PCR檢測方法應用于檢驗檢疫實踐工作中,以檢驗檢疫行業(yè)標準(SN/T 0973—2010《進出口肉、肉制品及其他食品中腸出血性大腸桿菌O157∶H7檢測方法》)檢測結果作為參照,驗證其可靠性。
2 結果與分析
2.1 EHEC O157∶H7 DPO-PCR檢測方法的建立
以EHEC O157∶H7 rfbE基因為靶基因,設計一對DPO引物,經(jīng)反應體系的優(yōu)化,建立了EHEC O157∶H7 DPOPCR檢測方法,優(yōu)化后的反應體系為(25 L):10×PCR Buffer(Mg2+free)2.5 L,Taq DNA Polymerase(5 U/ L)0.1 L(圖1A中2泳道),Mg2+(25 mmol/L)2.5 L(圖1B中5泳道),dNTP(2.5 mmol/L)1.5 L(圖1C中6泳道),上、下游DPO引物(10 mol/L)各0.5 L(圖1D中5泳道),DNA模板1 L,去離子水補充至25 L。

圖 1 EHEC O15577∶H7 DPO-PCR檢測方法的建立Fig.1 Development of DPO-PCR method for the detection of EHEC O157∶H7
2.2 DPO-PCR退火溫度不敏感性
退火溫度設為45~65 ℃時,利用DPO引物進行PCR擴增,擴增效率隨著退火溫度的變化基本保持一致,而利用常規(guī)引物進行PCR擴增時,擴增效率隨著退火溫度的升高逐漸增加后下降(圖2),表明DPO引物的退火溫度范圍較寬。

圖 2 DPO引物退火溫度不敏感性Fig.2 Insensitivity of DPO primers to annealing temperature
2.3 DPO-PCR檢測靈敏度
將菌體濃度為9.4×106CFU/mL的EHEC O157∶H7經(jīng)105倍稀釋后,利用建立的DPO-PCR方法仍能有效擴增出目的基因片段(圖3),顯示該DPO-PCR方法檢測EHEC O157∶H7的靈敏度為94 CFU/mL。
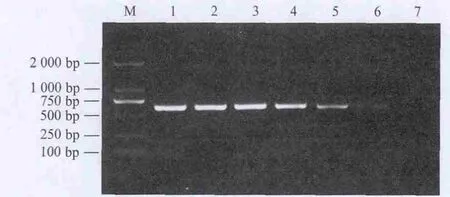
M. DNA marker 2000;1. 9.4×106 CFU/mL;2. 9.4×105 CFU/mL;3. 9.4×104 CFU/mL;4. 9.4×103 CFU/mL;5. 9.4×102 CFU/mL;6. 9.4×101 CFU/mL;7. 9.4×100 CFU/mL。
2.4 DPO-PCR檢測特異性
利用建立的DPO-PCR方法檢測1.1.1節(jié)所示細菌以及小鼠、雞、鵝和豬腸道細菌宏基因組,結果顯示:EHEC O157∶H7菌株 (ATCC 35150和2 株分離株)均為DPO-PCR陽性結果,其他為陰性結果,且未見非特異性擴增條帶出現(xiàn),而利用常規(guī)PCR引物擴增出現(xiàn)了與目的基因片段大小相近的非特異性條帶(圖4),表明本研究建立的EHEC O157∶H7 DPO-PCR檢測方法較常規(guī)PCR特異性更強。

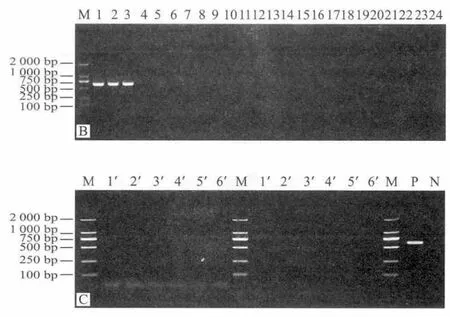
圖 4 EHEC O15577∶H7 DPO-PCR檢測方法特異性結果Fig.4 Specificity of DPO-PCR method for EHEC O157∶H7
2.5 方法實踐驗證
利用建立的EHEC O157∶H7 DPO-PCR檢測方法對228份采集的樣本進行了檢測,共檢測出4份EHEC O157∶H7陽性樣本,經(jīng)檢驗檢疫行業(yè)標準法(SN/T 0973—2010)復檢,兩者檢測結果一致,見表2,顯示該方法具有良好的實用性。
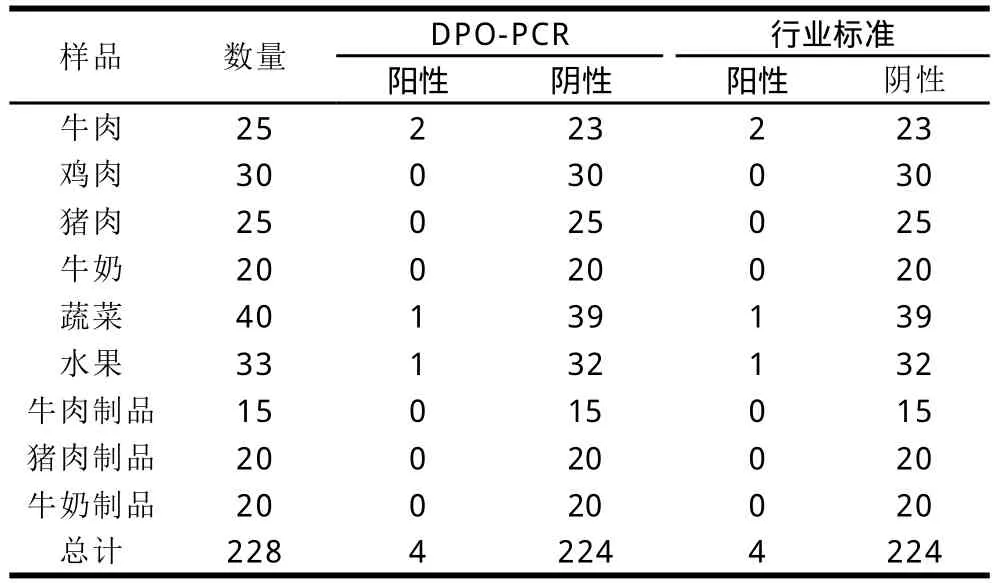
表 2 方法實踐應用Table 2 Detection of EHEC O157 H7 in real samples by the DPO-PCR method
3 結 論
DPO引物與常規(guī)PCR引物相比,設計簡易,不需要對引物參數(shù)進行反復優(yōu)化,在45~65 ℃的退火溫度范圍內,DPO引物均能保持高效率擴增。此外,DPO引物中的次黃嘌呤堿基的氫鍵結合力弱,在DPO引物引導PCR擴增時,如果5'-端或3'-端存在3 個以上堿基錯配,DPO引物便會與DNA模板發(fā)生脫離,終止PCR反應,有效地阻斷非特異性擴增,增加了檢測特異性,而且DPO引物自身以及引物間難形成二級結構,提高了擴增效率。實踐應用證明,本研究建立的EHEC O157∶H7 DPO-PCR檢測方法檢測快速、結果準確,具有良好的實用性。
[1]RILEY L W, REMIS R S, HELGERSON S D, et al. Hemorrhagic colitis associated with a rare Escherichia coli serotype[J]. New England Journal of Medicine, 1983, 308(12): 681-685.
[2]ORSKOV F, ORSKOV I. Escherichia coli serotyping and disease in man and animals[J]. Canada Journal of Microbiology, 1992, 38(7):699-704.
[3]BOLTON F J, CROZIER L, WILLAMSON L K. Isolation of Escherichia coli O157 from raw product[J]. Letters in Applied Microbiology, 1996, 23(5): 317-321.
[4]PHILLIPS C A. The epidemiology detection and control of Escherichia coli O157[J]. Journal of the Science of Food and Agriculture, 1999, 79(11): 1367-1381.
[5]王燕, 謝貴林, 杜琳. 大腸桿菌O157:H7感染流行概況[J]. 微生物學免疫學進展, 2008, 36(1): 51-58.
[6]CALL D R, BORUCKI M K, LOGE F J. Detection of bacterial pathogens in environmental samples using DNA microarrays[J].Journal of Microbiological Methods, 2003, 53(2): 235-243.
[7]宋宏新, 李宏. 腸出血性大腸桿菌O157:H7的檢測方法進展[J]. 食品科學, 2007, 28(11): 607-610.
[8]陳蘇紅, 孫國祥, 王升啟. 大腸桿菌O157:H7實驗室診斷方法研究進展[J]. 浙江預防醫(yī)學, 2005, 17(12): 52-54.
[9]俞順章, 盧林耿, 張幼展, 等. 快速檢測大腸桿菌O157菌株在流行病學上的應用[J]. 中華流行病學雜志, 1999, 20(4): 237-239.
[10]DEMARCO D R, LIM D V. Detection of Escherichia coli O157:H7 in 10 and 25-gramground beef samples with an evanescent-wave biosensor with silica and polystyrene waveguides[J]. Journal of Food Protection, 2002, 65(4): 596-602.
[11]李杜娟, 王劍平, 蓋玲, 等. 快速檢測大腸桿菌O157:H7的電化學阻抗免疫生物傳感器[J]. 傳感技術學報, 2008, 21(5): 709-714.
[12]斯城燕, 葉尊忠, 王一嫻, 等. SPR生物傳感器快速檢測大腸桿菌O157∶H7的研究[J]. 光譜學與光譜分析, 2011, 31(10): 2598-2601.
[13]LEE W, PARK K S, KIM Y W, et al. Protein array consisting of solgel bioactive platform for detection of E. coli O157:H7[J]. Biosensors and Bioelectronics, 2005, 20(11): 2292-2299.
[14]CALL D R, BROCKMAN F J, CHANDLER D P. Detecting and genotyping Escherichia coli O157:H7 using multiplexed PCR and nucleic acid microarrays[J]. International Journal of Food Microbiology, 2001, 67(1/2): 71-80.
[15]劉金華, 王蓓蕾, 馬路遙, 等. 金黃色葡萄球菌、大腸桿菌O157、普通變形桿菌和副溶血弧菌多重PCR檢測體系的構建[J]. 中國免疫學雜志, 2012, 28(12): 1120-1124.
[16]曲澤慧, 陳佩佩, 張愛芹, 等. 產腸毒素大腸桿菌雙重PCR檢測方法的建立[J]. 中國畜牧獸醫(yī), 2013, 40(7): 65-68.
[17]FACH P, PERELLE S, GROUT J, et a1. Comparison of different PCR teats for detecting Shigatoxin-Producing Escherichia coli O157 and development of an ELISA-PCR assay for specific identification of the bacteria[J]. Journal of Microbiological Methods, 2003, 55(2): 389-392.
[18]SCOTTER S, ALDRIDGE M. Validation of a method for the detection of E.coli O157:H7 in foods[J]. Food Control, 2000, 11(2): 85-95.
[19]巢強國, 楊學明, 葛宇, 等. PCR法檢測食品中大腸桿菌O157:H7[J].食品科學, 2010, 31(8): 212-215.
[20]徐曉可, 吳清平, 周艷紅, 等. 肉類中大腸桿菌O157:H7多重PCR檢測方法的建立[J]. 微生物學通報, 2008, 35(4): 619-622.
[21]胡慧, 陳雅君, 段志剛, 等. 大腸桿菌O157:H7 特異基因的實時熒光定量PCR檢測[J]. 食品科學, 2011, 32(12): 278-282.
[22]陳思, 黃昆侖, 許文濤, 等. 實時熒光定量PCR 方法檢測大腸桿菌O157:H7[J]. 農業(yè)生物技術學報, 2006, 14(5): 779-782.
[23]王力均, 許恒毅, 熊勇華, 等. 熒光定量PCR在大腸桿菌O157:H7檢測中的應用研究進展[J]. 食品科學, 2013, 34(11): 358-362.
[24]徐義剛, 崔麗春, 李蘇龍, 等. 腸出血性大腸埃希菌O157: H7環(huán)介導恒溫擴增快速檢測方法的建立與應用[J]. 中國人獸共患病學報,2010, 26(7): 618-623.
[25]CHUN J Y, KIM K J, HWANG I T, et al. Dual priming oligonucleotide system for the multiplex detection of respiratory viruses and SNP genotyping of CYP2C19 gene[J]. Nucleic Acids Research, 2007, 35(6): e40.
[26]劉梅, 黃新, 馬占鴻, 等. 應用DPO引物檢測馬鈴薯病毒的多重RTPCR技術研究[J]. 植物病理學報, 2009, 39(4): 431-434.
[27]徐煥洲, 平芮巾, 季汝武, 等. 應用DPO 引物技術同時檢測5 種蚊媒病毒的多重RT-PCR方法[J]. 中國國境衛(wèi)生檢疫雜志, 2012, 35(2):73-75.
[28]WOO H Y, PARK H, KIM B I, et al. Evaluation of dual priming oligonucleotide (DPO)-based multiplex PCR for detection of HBV YMDD mutants[J]. Archives of Virology, 2008, 153(11):2019-2025.

