新霉素半定量膠體金試紙條的研制
王麗哲,趙 瑜,唐慧林,王麗麗,于重楠,劉 敏,何艷玲
(1.北京陸橋技術有限責任公司,北京 100123;2.中國檢驗檢疫科學研究院,北京 100123)
新霉素屬于常見氨基糖苷類藥物之一,在獸醫臨床飼料添加劑中有廣泛應用,對于奶牛乳房炎、子宮內膜炎的治療上有很都有很好地療效[1-2]。然而,新霉素對人類具有明顯的毒害作用,尤其是耳毒性與腎臟毒性。隨著新霉素的大量使用,該藥物的殘留檢測也漸漸被人所重視,國家及歐盟對新霉素的殘留有嚴格要求[3-6],我國農業部發布的“動物性食品中獸藥殘留限量”(農業部235號公告)中規定,新霉素在牛乳中殘留不能超過500 μg/kg,與歐盟規定的牛乳中新霉素殘留最高限量一致。
本研究開發了一種半定量檢測牛乳中新霉素的膠體金試紙條,在傳統膠體金檢測技術[7-9]的基礎上加以改進,包含有一條控制線(C線),兩條不同限量的檢測線T1、T2(均包被目標檢測物全抗原),用于牛乳樣品中目標殘留物的半定量檢測。通過牛乳樣品中的目標殘留物與呈橫條狀分布于免疫層析膜上的 T1、T2線共同競爭性的與膠體金標記抗體反應,由免疫層析膜上T1、T2線的顯色情況來判定待檢樣品中目標殘留物的含量范圍,當層析膜上的T1、T2均顯色時,說明待檢測樣品中的殘留物含量低于最低檢測限;當層析膜上T1、T2線只有一條顯色,說明待檢測樣品中殘留物的含量在最低檢測限和最高檢測限之間;當層析膜上T1、T2線均不顯色,僅有C線顯色時,說明待檢測樣品中殘留物的含量超過了最高檢測限。該新霉素半定量金標快速檢測試劑盒,最低檢測限為200 μg/kg,最高檢測限為400 μg/kg。設定的最低檢測限可以滿足企業對于優質奶源分級篩選的要求,根據市場調查,客戶在選用快速檢測產品時,多要求檢測靈敏度低于國家標準,故最高檢測限400 μg/kg在滿足國家對新霉素藥物最高殘留限量要求的同時,更適合企業實際檢測要求。
1 材料與方法
1.1 材料與試劑
氯金酸、羊抗鼠抗抗體、新霉素標準品 美國Sigma公司;硝酸纖維素膜、膠體金結合墊、樣品墊、吸水墊、塑料背襯 美國Millipore公司;其他試劑均為國產分析純。
1.2 設備與儀器
BioJet XYZ 3050點膜儀 美國BioDot公司;ZQ5000數控斬切機 上海金標生物技術公司;3K15高速低溫離心機 美國Sigma公司;BT-47水浴鍋 日本Yamato公司;Ic160恒溫培養箱 瑞士Salvis公司;HJ-3恒溫磁力攪拌器 金壇市科興儀器廠;FF40冰箱 青島海爾集團;MDF-192AT冷藏柜 日本Sanyo公司;MS1 Minishaker渦旋振蕩器 德國IKA公司。
1.3 方法
1.3.1 新霉素偶聯抗原合成[10-14]
新霉素屬于小分子抗原,需要與其他蛋白偶聯制備成全抗原方具有免疫原性,并得以競爭法制備膠體金試紙條。稱取20 mg新霉素硫酸鹽和10 mg牛血清白蛋白(bovine serum albumin,BSA),分別溶解于1 mL的蒸餾水中,將BSA溶液逐滴加入到新霉素溶液中,室溫下于磁力攪拌器上攪拌2 h以上。取70 mg 1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽(1-ethyl-3(3-dimethyllaminopropyl) carbodiie hydrochlide,EDC·HCl)溶于1 mL蒸餾水中,再逐滴加入到上述溶液中,在室溫條件下繼續攪拌1 h以上,然后于4 ℃放置過夜。用PBS(1 L配方:KH2PO40.27 g、Na2HPO41.42 g、NaCl 8 g、KCl 0.2 g、pH 7.2~7.4)透析3 d后,分裝,-20 ℃貯存。
1.3.2 抗體-膠體金標記
1.3.2.1 膠體金溶液的制備
將1 g氯金酸溶于超純水配制得0.01%的氯化金溶液,取100 mL加熱至沸騰,在攪動狀態下加入1.5 mL的1%檸檬酸三鈉溶液。繼續加熱煮沸15 min,隨后冷卻至室溫,用超純水恢復至原體積,在510~550 nm波長范圍內測定其最大吸收波長,4 ℃避光保存。
1.3.2.2 最適標記pH值的確定
取15 個1.5 mL試管,分別加入1 mL 制備好的膠體金溶液;用0.1 mol/L K2CO3溶液調節pH值分別為3、4、5、6、7、8、9、10,混合后室溫放置10 min;加入質量濃度為0.2 mg/mL的新霉素抗體,每管各60 L,混合后室溫放置30 min;觀察膠體金顏色變化直到室溫條件下放置2 h,仍保持紅色,且實驗結果符合檢測靈敏度的為最低pH值。
1.3.2.3 最低標記蛋白量的確定
取6 個1.5 mL試管,分別加入1 mL 制備好的膠體金溶液;用0.1 mol/L K2CO3溶液調節pH值為最適pH值,混合后室溫放置10 min;加入0.2 mg/mL的新霉素抗體,分別為5、1 0、1 5、2 0、2 5、30 L混合后室溫放置30 min;加入25 mg/mL聚乙二醇20000封閉,封閉液終質量濃度為4 mg/mL,顏色仍保持紅色,且最終檢測靈敏度符合實驗要求的最小蛋白用量即最小蛋白標記量。
1.3.2.4 抗體-膠體金復合物制備
取已制備好的膠體金溶液50 mL,用0.1 mol/L K2CO3溶液調pH值至最適標記pH值。攪拌中加入抗體至最適標記蛋白量,繼續攪拌20 min,加入10% BSA溶液直至BSA的終含量為1%,繼續攪拌10 min;在4 ℃、12 000 r/min離心30 min,小心棄去上清液,加入50 mL 0.01 mol/L Tris-HCl溶液(pH 8.2,含1% BSA,簡稱TBS)再重復清洗一次,最后用100 mL 0.01 mol/L TBS將沉淀重懸,0.22 μm微孔濾膜過濾,按照2 mL量包被1 cm×30 cm玻璃纖維,37 ℃恒溫培養箱2 h,烘干備用。
1.4 免疫層析膠體金試紙條的制備[15-18]
1.4.1 檢測線、控制線包被濃度的確定
用包被緩沖液(PBS,配方同1.3.1節)稀釋新霉素偶聯抗原,設置點膜儀參數為0.1 L/mm,包被T1、T2兩條不同質量濃度的新霉素偶聯抗原在2.5 cm×30 cm硝酸纖維素膜上(無需封閉),作為層析試紙條的檢測線;包被二抗(兔抗鼠抗體)在同一硝酸纖維素膜上作為層析試紙條的控制線,其中控制線包被在兩條檢測線上方,37 ℃恒溫培養箱2 h,烘干備用;以抗體-膠體金復合物在膠體金結合墊上作為游離反應物,通過分析對添加新霉素標準品的檢測結果,調整T1、T2兩條檢測線的包被質量濃度,使T1、T2在檢測牛乳樣品時,新霉素最終靈敏度分別為200 μg/kg和400 μg/kg。
1.4.2 膠體金試紙條各組分的組裝
樣品墊(預先切割成2 cm×30 cm規格的玻璃纖維),經預處理液(Na2B4O710H2O 38.130 g、PVP-10 10 g、BSA 1 g、Triton X-100溶液 10 mL,溶于1 L蒸餾水,硼酸顆粒調節pH(8.5±0.1))處理:1 000 mL樣品墊預處理液倒入塑料盒中,放入200 條樣品墊充分浸泡5 min,用手去掉多余的液體。將處理后的樣品墊放于已洗凈并烘干的篩網上,整齊平鋪后放于37 ℃干燥箱中過夜干燥。
吸水墊制備用裁紙刀切割成3.8 cm×30 cm的規格備用。依次將吸水墊、包被有T1、T2線和C線的硝酸纖維素膜、膠體金結合墊和樣品墊依次貼到PVC背襯上,組裝成大卡,粘貼5.5 cm×30 cm Max線標簽于膠體金結合墊和樣品墊上將其固定;然后將大卡用斬切機切割成4 mm寬度的試紙條,用于后續實驗。
1.4.3 樣品檢測
向不含氨基糖苷類抗生素的陰性牛乳樣中添加0~500 μg/kg的新霉素標準品,檢測試紙條T1、T2線的靈敏度,每個添加樣品平行數為10,并對50 份未知牛乳樣,分別使用試紙條和儀器方法GB/T 21323—2007 《動物組織中氨基糖苷類藥物殘留量的測定:高效液相色譜-質譜法/質譜法》進行檢測,比對結果的一致性。
取所需數量空白酶標板微孔,置于微孔板上;向每個微孔中依次加入100 L樣品稀釋液(PBS)和100 L待測牛乳樣,混勻,待測。從塑料筒中取出檢測條,向每孔中插入試紙條,等待5 min觀察結果,20 min后結果無效。結果判定:T1、T2線和C線均顯色,判斷為陰性;T1線不顯色,T2線及C線顯色,判斷為高靈敏度陽性;T1、T2線均不顯色,C線顯色,判斷為低靈敏度陽性;C線不顯色,判定試紙條失效。
2 結果與分析
2.1 膠體金溶液的制備
所制備的膠體金顏色為紅色,透明,用全波長酶標儀在510~550 nm波長范圍內測定其最大吸收波長,其最大吸光度為1.149,對應的吸收波長為528 nm(圖1)。
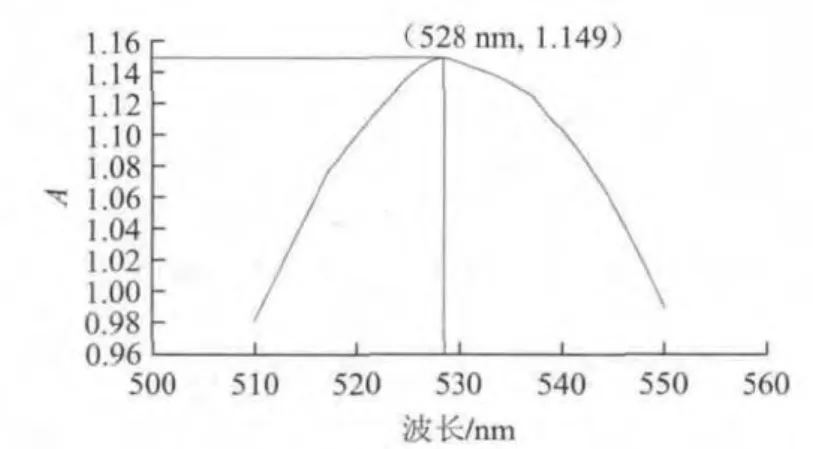
圖 1 膠體金溶液最大吸收波長掃描圖Fig.1 Maximum absorption wavelength of the colloidal gold solution
2.2 最適pH值的確定
從上述實驗確定最適標記pH值為8,與大多數小分子膠體金抗體標記最適pH值相近。
2.3 最低標記蛋白量的確定
最終實驗結果,確定最小蛋白用量為15 L,即3 g/mL,符合競爭法蛋白標記量較低的預期量。
2.4 免疫層析膠體金試紙條的制備
制備的半定量膠體金試紙條與傳統膠體金試紙條相比,多了一條檢測線,經實驗檢測最終結果驗證,確定控制線包被質量濃度為0.3 mg/mL,兩條檢測線T1、T2抗原包被質量濃度分別為0.03 mg/mL和0.1 mg/mL。
2.5 樣品檢測
試紙條檢測含有100、200、300、400 μg/kg和500 μg/kg的新霉素時,添加至100 μg/kg時,T1、T2線顏色均有變淺趨勢,添加至200 μg/kg,100% T1檢測線消線,添加至400 μg/kg,100% T2檢測線消線,因此組裝的免疫膠體金試紙條檢測牛乳樣品,T1、T2兩條檢測線的靈敏度可分別達到200 μg/kg和400 μg/kg(圖2、3)。且樣品僅需稀釋即可上樣檢測,5 min之內即可出結果,方法簡便,可實現現場快速檢測,肉眼觀察結果可維持20 min不變(圖4),結果穩定。
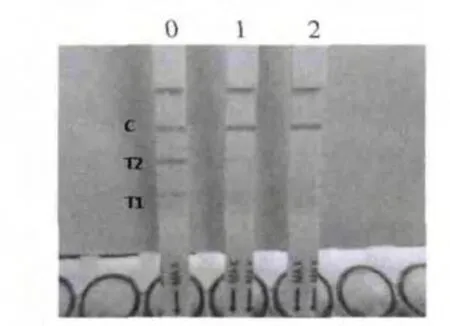
圖 2 陰性牛乳樣品添加新霉素標準品200 g/kg和400 g/kg檢測結果Fig.2 Results obtained from the strip for negative milk samples spiked neomycin standard at 200 g/kg and 400 g/kg
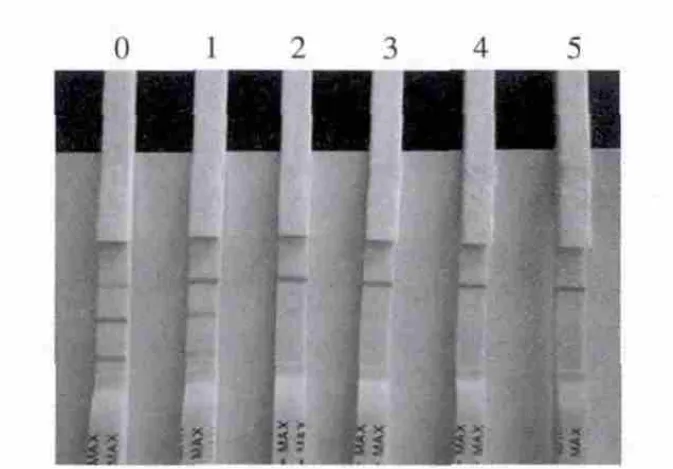
圖 3 陰性牛乳樣品添加新霉素標準品100~500 g/kg檢測結果Fig.3 Results obtained from the strip for negative milk samples spiked with neomycin standard at concentrations of 100–500 g/kg
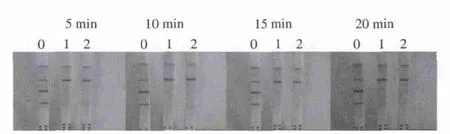
圖 4 試劑條檢測含200 g/kg和400 g/kg新霉素牛乳在5、10、15、20 min時的檢測結果Fig.4 Results obtained from the strip for milk samples spiked with neomycin standard at 200 and 400 g/kg at different testing times (5, 10,15 and 20 min)
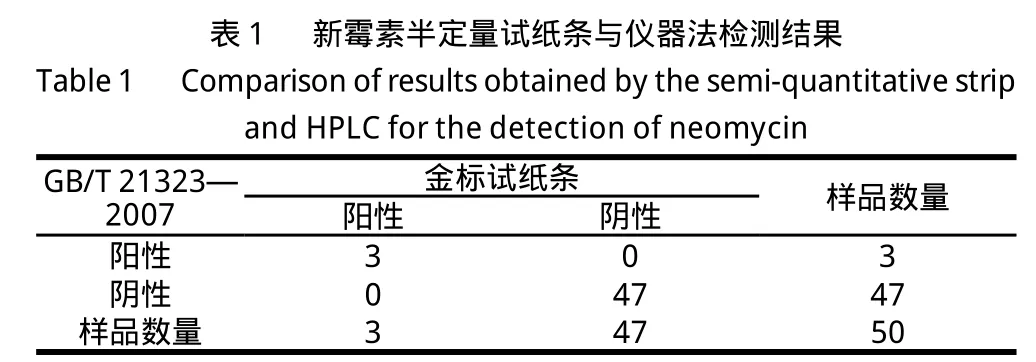
注:χ2=0;P>0.05;符合率:100%。
對50 份盲樣牛乳的檢測結果,與高效液相色譜-質譜法一致,結果準確可靠(表1)。
3 討論與結論
膠體金免疫層析技術是出現于20世紀80年代的一種獨特的免疫學檢測技術,其操作簡單、快速、特異性好,結果清楚,易于判斷和保存,且無需儀器。但由于目前只能進行定性測定,因此阻礙了這一技術的進一步應用。為此本研究就膠體金免疫層析技術進行半定量測定改進[19-20],相對于酶聯免疫吸附半定量方法來說,操作更簡便,不需要酶標儀等設備,能夠實現現場快速檢測,使膠體金試紙條這一檢測方法精確度更高,滿足市場對牛乳質量檢測監控的需要。
本研究所制備的免疫層析試紙條在檢測牛乳樣品時,檢測方法簡單,所需檢測時間短,可實現現場快速檢測,為不僅實現對樣品的定性檢測,更能對樣品進行半定量檢測,為乳制品質量控制技術提供了便捷的方法。
[1]陳敏艷, 孫濤, 王香敏, 等. 藥物殘留及其危害[J]. 動物醫學進展,2005, 26(10): 111-113.
[2]劉曉冬, 林洪, 江潔. 動物源性食品中氨基糖苷類抗生素檢測技術的研究進展[J]. 安徽農業科學, 2010, 38(8): 4128-4132.
[3]Colloidal Gold Conjugation Protocol, 2004 Schleicher & Schuell BioScience, E1/9/04[S].
[4]KOTRETSOU S I. Determination of aminoglycosides and quinolones in food using tandem mass spectrometry[J]. Critical Reviews in Food Science and Nutrition, 2004, 44(3): 173-184.
[5]EDDER P, COMINOLI A, CORVI C. Determination of streptomycin residues in food by solid-phase extraction and liquid chromatography with post-column derivatization and flurometric detection[J]. Journal of Chromatography A, 1999, 830(2): 345-351.
[6]付云潔, 劉志國, 武玉香, 等. 膠體金免疫層析法快速檢測食品中金霉素殘留[J]. 食品科學, 2010, 31(2): 191-194.
[7]HOEBUS J, YUN Liming, HOOGMARTENS J. An improved gas chromatographic assay for spectinomycin hydrochloride[J].Chromatographia, 1994, 39(1/2): 71-73.
[8]OGURI S, MIKI Y. Determination of amikacin in human plasma by high-performance capillary electrophoresis with fluorescence detection[J]. Journal of Chromatography B, 1966, 686(6): 205-210.
[9]SAMSONOVA J, BASHKUROV M, IVANOVA N, et al. ELISA of streptomycin in buffer and milk: effect of reagents structure and analysis format on assay performance[J]. Food and Agricultural Immunology, 2005: 16(1/4): 47-57.
[10]鄧省亮, 賴衛華, 許楊. 膠體金免疫層析法快速檢測黃曲霉毒素B1的研究[J]. 食品科學, 2007, 28(2): 232-236.
[11]張改平, 劉宣冰, 彩鴻翔, 等. 新霉素人工抗原的合成與鑒定[J]. 中國飼料, 2008(17): 38-41.
[12]HAASNOOT W, STOUTEN P, CAZEMIER G, et al.Immunochemical detection of aminoglycosidesin milk and kidney[J].Analyst, 1999, 124: 301-305.
[13]BHOGTE C P, PATRAVALE V B, DEVARAJAN P V.Fluorodensitometric evaluation of gentamicin from plasma and urine by high-performance thin-layer chromatography[J]. Journal of Chromatography B, 1977, 694(5): 443-447.
[14]劉淑華, 何方洋, 馮才偉, 等. 牛奶中新霉素殘留膠體金免疫層析快速檢測技術的研制[J]. 食品工業科技, 2013, 34(6): 73-76.
[15]MAYHEW J W, GORBACH S L. Gas-liquid chromatographic method for the assay of aminoglycoside antibiotics in serum[J]. Journal of Chromatogrphy, 1978, 151(15): 133-146.
[16]KAALE E, LEONAED S, van SCHEPDAEL A, et al. Capillary electrophoresis analysis of gentamicin sulphate with UV detection after pre-capillary derivatization with 1,2-phthalic dicarboxaldehyde and mercaptoacetic acid[J]. Journal of Chromatography A, 2000,895(1): 67-79.
[17]許定花, 劉麗強, 鄭蓓蓓, 等. 膠體金免疫層析法參數的優化[J]. 食品科學, 2009, 30(20): 155-159.
[18]CHERLET M, BAERE S D, BACKER P D. Determination of gentamicin in swine and calf tissues by high performance liquid chromatography combined with electrospray ionization mass spectrometry[J]. Journal of Mass Spectrometry, 2000, 35(11): 1342-1350.
[19]刑廣旭, 王方雨, 胡驍飛, 等. 新霉素快速半定量ELISA試劑盒的研制[J]. 核農學報, 2013, 27(6): 811-816.
[20]王喜亮, 金秀娥, 李奎, 等. 膠體金試紙條半定量檢測雞蛋中磺胺嘧啶殘留[J]. 中國獸醫學報, 2008, 28(8): 57-61.

