地下水污染與防治——電化學技術去除地下水中三氯乙烯
羅 曄
(安徽理工大學 安徽淮南 232001)
1 我國地下水污染現狀
相對于地下水較強程度的開發利用,地下水資源保護就顯得薄弱。地下水資源的環境問題主要指地下水環境質量,也就是地下水污染問題。據《科學通報》13期報道:人類活動導致塔克拉瑪干沙漠水體地下水輕度污染。衛生部最新的統計顯示,2006年惡性腫瘤成為我國城鄉居民的首要死因。而太湖、巢湖等地癌癥村的陸續出現,引起了人們對水污染這種環境因素與癌癥發病率之間關系的廣泛關注。我國地下水污染面積在不斷擴大,在我國平原地區,目前要找出一塊未被污染的地下水區域竟成了一件很不容易的事情。在水資源相對短缺的北方地區,污染狀況更加令人觸目驚心,“有河皆枯,有水皆污”并非虛言。
2 地下水污染的防治
2.1 合理開發和利用地下水資源
從可持續發展的角度出發,有計劃地開發和利用這些有限的地下水資源。保護地下水資源,制止過量開采地下水,減少地下水位下降幅度,防止地面沉降等,以減少污水的下滲。在開發利用過程中做到采補平衡,嚴格控制地下水開采量的同時,還應采取多種措施加大對地下水的回灌補給。
2.2 提高公眾環境意識并加強地下水保護宣傳力度
嚴格貫徹執行我國的《水污染防治法》《水法》等法規,本著“誰污染,誰治理”的原則,加強執法力度,使每個人都能準確地理解我們的行為給地下水質造成了什么影響。建設必要的污水處理設施;抓好重點污染源的綜合治理,對毒性大的污染物,必須在廠內處理,對于毒性小的污染物匯入城市污水處理廠進行集中處理。統籌規劃、合理布局。
2.3 建立水質監測網并重點做好水質監測工作
加強基礎設施建設,建立水質監測站網,迅速補充和完善地下監測井網,逐步建立和完善水環境監測體系。設立地下水觀測專用井,建立地下水動態監測與分析預測服務系統。對重點污染地區(段)進行重點監測,系統掌握區域地表水、地下水水質的污染發展變化及動態特征,為開發利用和管理保護提供及時、科學的依據。
2.4 開展地下水環境脆弱性調查評價及編制評價圖冊
歐洲、北美和澳大利亞等地區,在地下水污染防治工作中,已經從以污染治理為重點轉變為以防止污染為重點,其中采取的一個重要措施即是進行地下水環境脆弱性評價,并編制評價圖冊。這種方法值得我國借鑒。
3 電化學技術去除地下水中TCE
3.1 實驗原理
相關文獻報道TCE可以通過催化加氫脫氯生成乙烷[1,2,3],存在H2和O2,Pd催化劑的體系中會生成H2O2[4,5],但是這一發現并沒有在相關的調查中提到。而H2O2具有氧化TCE的潛力,并且在Pd催化劑存在的條件下能活化H2O2生成具有強氧化性的·OH(氧化還原電位:2.8V/SHE)[5,6]。基于·OH的強氧化性,溶液中生成的·OH也可以進一步氧化TCE并生成CO2。Pd存在的條件下,催化劑表面能形成·OH[7,8]。但是,在Pd,H2和O2共同存在的條件下H2O2和·OH對TCE降解的貢獻從來沒有被探索過。本文根據這一思路展開實驗,并且驗證了不同實驗條件下TCE降解的主導方式。

當溶液中不存在Fe(II)時,溶液中發生如下反應:陰極產生H2(2)溶解在溶液中----溶解的H2擴散到Pd催化劑的表面——H2吸附在Pd催化劑表面并且活化成兩個活性[H]原子(7)——在不存在Fe(II)的情況下,TCE通過加氫脫氯,形成順式DCE,乙烯,最終生成乙烷。同時溶解在溶液中的O2擴散并吸附到Pd催化劑的表面,首先氧氧雙鍵被拉長[9](4),接著進一步結合Pd表面的活性[H]生成H2O2,然后H2O2在Pd表面被分解為·OH。因此,在不存在Fe(II)的情況下,仍有少部分的TCE被氧化。整個反應過程以加氫脫氯還原為主導反應途徑。
當溶液中存在Fe(II)時,溶液中發生如下反應:溶液中首先發生(1)(2)兩個反應——生成的H2和O2吸附到Pd催化劑的表面并結合生成H2O2——由于溶液中存在Fe(II)離子,H2O2與Fe(II)離子結合大量生成強氧化性的·OH(9)——·OH氧化溶液中的TCE,生成有機酸,并進一步氧化成CO2(8)。因此,存在Fe(II)的情況下,大部分的TCE被氧化。整個反應過程以TCE氧化為主導反應途徑。
3.2 實驗設計
TCE的降解在如圖所示的裝置中進行,環境溫度為(25±1℃)。
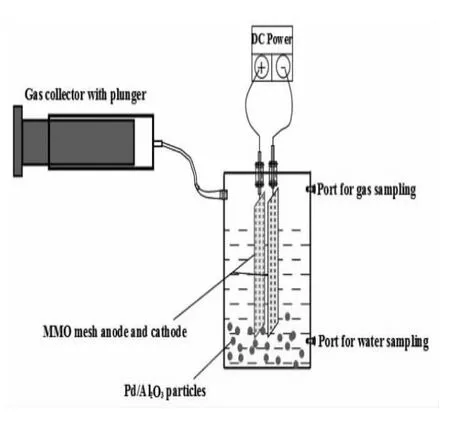
150mL帶活塞的注射器連接反應裝置,電解過程中氣體的膨脹。兩塊混合金屬氧化物(MMO)電極被用作陰極和陽極,電極尺寸為85×15×1.8 mm(長×寬×厚),兩塊電極相隔42 mm平行放置。每一組實驗,加入400mLNa-SO4溶液,1 g/LPd/Al2O3,13.6mg/LFe(II)。Pd/Al2O3催化劑和 Fe(II)的劑量根據實驗結果來制定。10mLTCE飽和溶液加入電解質水溶液中形成初始濃度為198 uM(26.1mg/L)的TCE溶液。立即密封實驗裝置,并用磁力攪拌器攪拌10min幫助TCE在溶液中混合均勻。通過一個聚四氟乙烯的小磁子維持溶液的攪拌速度在600 rpm。施加7 V電壓在電解系統上以獲得恒定的100mA電流(10mA/cm2)。取水樣進行 TCE,順式 DCE,Cl-,有機酸,pH,氧化還原電位(ORP),Fe(II),H2O2濃度檢測。取氣體進行氣相的頂空測試。為檢測反應的降解效率,在加入電解質溶液前通入N2幾分鐘以趕走溶液中存在的CO2。1mM NaSO4和0.5mM CaSO4加入溶液中模擬地下水化學環境。通過加入20mLTCE飽和水溶液使初始TCE濃度增加一倍到396 uM。所有實驗一式兩份。
3.2.1 存在和缺乏Fe(II)離子時,TCE的降解
實驗條件:環境溫度為25±1℃,電極為MMO電極,磁力攪拌器轉速為600 rpm,電流為100mA,催化劑量為1 g/LPd/Al2O3,初始pH為4.0,電解質溶液為1mM NaSO4和0.5mM CaSO4,初始TCE濃度為396 uM。一組反應中加入13.6mg/LFe(II),一組不加Fe(II),通過加入和不加Fe(II)離子的兩種情況,驗證Fe(II)離子對實驗反應的影響,從而得出不同情況下TCE降解的主導途徑。

實驗結果為:TCE不在MMO電極上發生氧化或還原反應,Pd催化劑不吸附溶液中的TCE。這兩組實驗證實,TCE的降解要在電極和Pd催化劑下共同作用。不存在Fe(II)離子,反應80min,溶液中TCE的濃度從396 uM降低到160 uM。而存在Fe(II)離子,反應80min,溶液中TCE的濃度從396 uM降低到20.2 uM。并且,存在Fe(II)離子時,主要的反應產物是CO2,這說明當存在Fe(II)離子時,溶液中的TCE主要發生氧化反應,在這樣的條件下氧化為TCE的主導反應。
3.2.2 Fe(II)離子濃度對TCE降解的影響
實驗條件:環境溫度為25±1℃,電極為MMO電極,磁力攪拌器轉速為600 rpm,電流為100mA,催化劑量為1 g/LPd/Al2O3,初始pH為4.0,電解質溶液為1mM NaSO4和0.5mM CaSO4,初始TCE濃度為396 uM。分別設置5組不同Fe(II)離子濃度來判斷Fe(II)離子濃度對TCE降解反應的影響。濃度分別設置為0mg/L、1.4mg/L、6.8mg/L、13.7mg/L、27.3mg/L。

實驗結果:Fe(II)離子濃度越高,TCE的降解效果越好。H2O2的積累量隨著Fe(II)離子濃度的升高而降低,這是由于Fe(II)離子能促進H2O2的分解。Fe(II)離子濃度越高,·OH濃度越高。Fe(II)離子濃度在0—13.6mg/L的范圍時,隨著Fe(II)離子濃度濃度的升高,TCE的降解效果越好,·OH的產生量越高。其中·OH的量和TCE的降解效果的相關系數為0.85,說明·OH是TCE降解的主要活性物種。
3.2.3 pH和Pd/Al2O3劑量對TCE降解的影響
實驗條件:環境溫度為25±1℃,電極為MMO電極,磁力攪拌器轉速為600 rpm,電流為100mA,催化劑量為1 g/LPd/Al2O3,初始pH為4.0,電解質溶液為1mM NaSO4和0.5mM CaSO4,初始TCE濃度為396 uM。分別設置不同的初始pH值和Pd催化劑量觀察pH、Pd催化劑量對TCE降解效果的影響。pH分別設置為3.0、4.0、5.5、7.0、8.5;Pd催化劑量設置為 0 g/L、0.2 g/L、0.5 g/L、1.0 g

實驗結果:pH8.5時,TCE的降解受到抑制,隨著pH的降低TCE的降解效果顯著增加。在較高的pH時,·OH的產生受到限制,并且溶液中存在的Fe(II)離子以氫氧化物的沉淀形式存在。pH的降低有利于有利于·OH的形成,因此TCE的降解效果更好。催化劑量越大,TCE的降解效果更好。催化劑量越大,能促進吸附更多的H2形成更多的[H],同時也能吸附更多的O2。因此,就能形成更多的H2O2,在有Fe(II)離子存在的條件下,就能生成更多的·OH。所以,TCE的降解效果更好。
3.2.4 地下水化學組成對TCE降解的影響
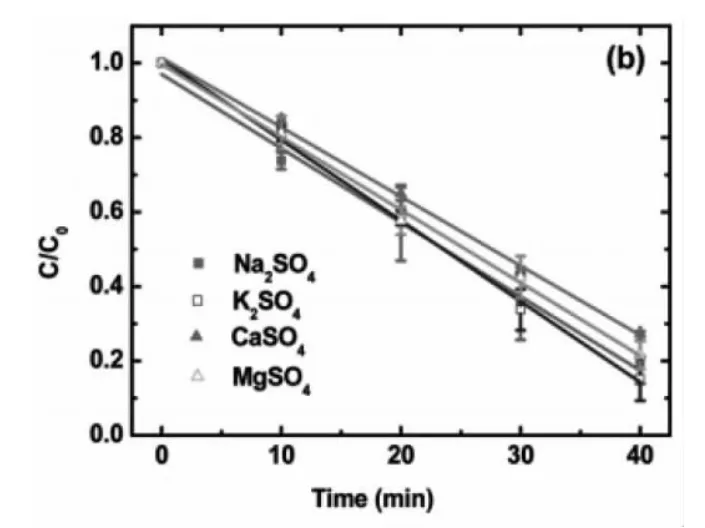
實驗條件:環境溫度為 25±1℃,電極為MMO電極,磁力攪拌器轉速為600 rpm,電流為 100 mA,催化劑量為1 g/L Pd/Al2O3,初始 pH為4.0,電解質溶液為1 mM NaSO4和0.5mM CaSO4,初始TCE濃度為396 uM。設置4組實驗,分別加入10mM NaSO4、K2SO4、CaSO4、MgSO4。
實驗結果:10mM NaSO4、K2SO4、CaSO4、MgSO4對 TCE的降解效果的影響是相同的,它們只是作為電解質,并不能影響改變TCE的降解途徑。
4 結論
在體系缺乏和存在Fe(II)的不同情況下,通過利用金屬鈀和電解產生的H2和O2來降解模擬地下水中的三氯乙烯(TCE)。在體系中缺乏Fe(II)的情況下,加氫脫氯主導TCE的降解,其中H2O2含量累積達到了17mg/L。在弱酸性條件下,由于H2O2的分解,檢測到了低濃度的氧化性羥基自由基,它對TCE的氧化降解略有貢獻。
體系中存在Fe(II)時,TCE的降解效率在369μM時80分鐘內提高到94.9%。產物的分布情況證明了降解路徑轉換,即從體系缺乏Fe(II)時79%TCE加氫脫氯到存在Fe(II)時84%的TCE被羥基自由基氧化。在體系中溶液PH=4,初始Fe(II)的濃度從0增加到27.3mg/L時,反應速率常數從2.0增加到4.6 uM/min,TCE的降解遵循零級動力學方程。
TCE的降解速率常數和羥基自由基生成速率常數之間的相關性證明了,羥基自由基是TCE氧化的主要反應活性劑。
體系中存在 10mM的 Na2SO4,K2SO4,CaSO4,和 MgSO4并不會顯著影響TCE的降解。一種新型的Pd電極電化學過程提出了治理地下水的方案。
[1]Mcnab,JR.W.W.;Ruiz,R.Palladium-catalyzed reductive dehalogenation of dissolved chlorinated aliphatics using electrolytically-generated hydrogen.Chemosphere1998,37,925-936.
[2]Lowry,G.V;Reinhard,M.Pd-catalyzed TCE dechlorination in water:Effectsof[H2](aq)and H2-utilizing competitive soluteson the TCE dechlorination rate and product distribution.Environ.Sci.Technol.2001,35,696-702.
[3]Lowry,G.V;Reinhard,M.Pd-catalyzed TCE dechlorination in groundwater:Solute effects,biological control,and oxidative catalyst regeneration.Environ.Sci.Technol.2000,34,3217-3223.
[4]Edwards,J.K.;Solsona,B.;Ntainjua,N.E.;Carley,A.F.;Herzing,A.A.;Kiely,C.J.;Hutchings,G.J.Switchingoffhydrogen peroxidehydrogenation in thedirectsynthesisprocess.Science2009,323,1037 1041.[5]Choudhary,V.R.;Samanta,C.;Jana,P.Decomposition and/or hydrogenation of hydrogen peroxide over Pd/Al2O3catalyst in aqueous medium:Factors affecting the rate of H2O2destruction in the presence ofhydrogen.Appl.Catal.A2007,332,70-78.
[6]Yuan,S.H.;Fan,Y.;Zhang,Y.C.;Tong,M.;Liao,P.Pd-catalytic in situ generation ofH2O2from H2and O2produced bywaterelectrolysis for the efficient electro-Fenton degradation of rhodamine B.Environ.Sci.Technol.2011,45,8514-8520.
[7]Hildebrand,H.;Mackenzie,K.;Kopinke,F.D.Highly active Pd-on-magnetite nanocatalysts for aqueous phase hydrodechlorination reactions.Environ.Sci.Technol.2009,43,3254-3259.
[8]Schueth,C.;Kummer,N.A.;Weidenthaler,C.;Schad,H.Field application of a tailored catalyst for hydrodechlorinating chlorinated hydrocarbon contaminants in groundwater.Appl.Catal.B2004,52,197 203.
[9]Staykov,A.;Kamachi,T.;Ishihara,T.;Yoshizawa,K.Theoretical study of the directsynthesisofH2O2on Pd and Pd/Au surfaces.J.Phys.Chem.C2008,112,19501-19505.

