海帶巖藻多糖的提取工藝優化及初步結構分析
李國瑩,袁 方,羅 瑋,李漢廣,余曉斌,*
(1.江南大學生物工程學院,糖化學與生物技術教育部重點實驗室,江蘇無錫 214122;2.齊魯工業大學食品與生物工程學院,山東濟南 250353)
巖藻多糖(fucoidan)一種復雜的硫酸酯多糖,主要成分為L-巖藻糖(fucose)、硫酸基團,還包括半乳糖、木糖和甘露糖等成分[1],存在于褐藻的細胞壁基質中[2]。它具有多種生物學活性[3],如抗凝血、抗氧化、抗血栓、抗癌等功效[4-7],成為中外學者的研究熱點。海帶一種大型褐藻且資源豐富,可為巖藻多糖的研究與開發提供原料保證。
由于褐藻中巖藻多糖含量低且結構復雜,高純度巖藻多糖價格昂貴,為使優質巖藻多糖生產進一步產業化,巖藻多糖的提取工藝一直備受關注[8],采取傳統提取過程中添加輔助提取步驟,從而提高多糖提取率,如酶法[9]、超聲波[10]、微波[11]超濾[12]等技術應用于多糖的提取。程仕偉等[13]水提制備海帶巖藻多糖提取率為4.99%,而崔艷麗等[14]利用復合酶酶解法提取巖藻多糖提取率為13.9%,可見輔助方法的添加與傳統提取工藝相比,具有更高的提取率。
本實驗采用高壓均質與酶法結合提取巖藻多糖,采用高壓均質處理原料提取巖藻多糖的報道鮮有。高壓均質與酶共同作用,促使細胞間質中多糖充分溶出。在單因素實驗基礎上,利用響應面優化提取工藝進一步提高得率,利用紅外及色譜技術初步檢測自制巖藻多糖的成分及結構,為巖藻多糖的研究提供依據。
1 材料與方法
1.1 材料與儀器
海帶 市售;葡聚糖標準品、10種單糖標準物Sigma公司;纖維素酶、木瓜蛋白酶 南寧東恒華道生物科技有限公司;所用其他試劑 均為分析純。
粉碎機 常州五谷農場食品有限公司;膠磨機上海正奧泵業制造有限公司;可見光分光光度計 上海精科;紫外分光光度計 海優尼科;冷凍離心機Thermo公司;冷凍干燥機 Virtis公司;FEI Quanta 200掃描電子顯微鏡 FEI公司;HPGLC Waters公司;ICS-5000離子色譜儀 Dionex公司。
1.2 實驗方法
1.2.1 海帶預處理 海帶洗凈曬干,粉碎,酒精∶三氯甲烷∶水(4∶2∶1)脫脂,過濾,烘干。將粉碎機、膠磨機、高壓均質機處理得到不同的海帶漿分別提取巖藻多糖,考察不同預處理方式對多糖得率的影響,選取最佳的海帶處理方法。
1.2.2 巖藻多糖提取 取適量海帶漿,水浴55℃,加入酶(纖維素酶、木瓜蛋白酶)適量,酶解2h,溫度升至90℃,10min使酶失活,離心取上清液,上清液加CaCl2溶液,離心取上清,加乙醇,使其終濃度為60%,4℃過夜,離心,棄上清。沉淀依次用乙醚,丙酮洗滌,冷凍干燥,巖藻多糖粗糖。
1.2.3 單因素及響應面優化實驗 單因素實驗基本條件為:料水比1∶20,酶用量1.0%,酶解pH5.0,酶解溫度50℃。改變其中一個條件,固定其他條件分析所選因素對巖藻多糖得率的影響。各因素梯度分別為:料水比:1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40;酶用量:1%、1.5%、2%、2.5%、3%;酶解pH:4.0、4.5、5.0、5.5、6.0、7.0;酶解溫度(℃):35、40、45、50、55、60。
根據單因素實驗結果,利用響應面分析軟件Box-Behnken Design(BBD)模型,設料水比(A)、酶解pH(B)、酶用量(C)三因素為自變量,巖藻多糖得率Y為響應值,設計三因素三水平實驗,確定提取工藝的最佳參數,實驗因素與水平取值見表1。

表1 Box-Behnken實驗因素與水平Table 1 Factors and levels of Box-Behnken
1.3 測定方法
1.3.1 粗多糖得率的測定 粗巖藻多糖得率(%)=粗多糖質量/海帶粉質量×100
1.3.2 巖藻糖標準曲線的繪制 以巖藻糖濃度為橫坐標,吸光值為縱坐標繪制標準曲線[15],標準曲線方程y=0.0135x+0.0066,R2=0.9991。
1.3.3 多糖含量的測定 取適量一定濃度的海帶粗多糖待測液于試管中,按標準曲線的測定方法測定吸光值,計算粗糖中多糖的含量。巖藻多糖含量(%)=多糖質量/粗多糖總質量×100
1.4 巖藻多糖初步結構分析
1.4.1 粗多糖純化 取上述粗多糖溶于水,等體積加入CaCl2溶液,室溫放置,4000r/min離心10min,取上清Sevage法脫蛋白,直到中間層無沉淀產生為止,收集上層液,加乙醇至濃度為60%,4℃放置過夜,8000r/min離心10min,收集沉淀,加水,透析(透析袋截留分子量8000~14000u),冷凍干燥得巖藻多糖,所得多糖用于以下多糖成分分析實驗。
1.4.2 巖藻多糖紅外光譜分析[16]取多糖1mg與干燥的溴化鉀研磨混勻,壓片,用紅外光譜儀初步分析巖藻多糖結構。
1.4.3 巖藻多糖分子量的測定 采用高效凝膠過濾色譜法[17](HPGFC),色譜條件:色譜柱:UltrahydrogelTMLinear 300mm×7.8mm id×2;流動相:0.1mol/L NaNO3;流速:0.9mL/min;柱溫:45℃;葡聚糖標準品作為標樣,繪制分子量校正曲線。所用葡聚糖分子量(Mw)分別為33800、41100、1000、2500u。樣品的前處理:取純化多糖溶解于流動相中,用微孔過濾膜過濾后供進樣。
1.4.4 巖藻多糖單糖組分分析:離子色譜-脈沖安培法[18](IC-PAD)色譜條件:色譜柱:CarboPac PA20;流動相:H2O,250mmol/L NaOH,1mol/L NaAc;流速:0.5mL/min;檢測器:脈沖安培檢測器。
樣品前處理:稱取多糖樣品1mg,溶于1.0mL 4mol/L三氟乙酸,充氮氣封管,90℃水解1h,冷卻后用氮氣吹干,加水10mL溶解,用微孔過濾膜過濾后供進樣。
1.5 數據處理
采用Design Expert 8.0,Origin 8.5和Excel 2010進行數據處理。
2 結果與分析
2.1 海帶粉的處理方法的選擇
以經過不同處理的海帶漿為原料,提取巖藻多糖,結果如圖1所示。由圖1可知僅經粉碎機處理的海帶粉顆粒大,得率較低;經膠體磨處理后,顆粒較細,得率有所提升;高壓均質處理,得率進一步提升,可能是由于高壓均質具有破壁效果[19]與酶作用使細胞間質的多糖充分溶出因而得率提高,但過高的機械作用也會破壞多糖結構,如糖鏈的斷裂,SO42-的脫落等。故本實驗參考Rosa M等的研究結果[20],選擇高壓均質的壓力為200Bar與酶相結合處理海帶粉,以期獲得更高的得率。

圖1 不同海帶漿的多糖提取結果Fig.1 polysaccharide extraction result of different kelp
2.2 單因素實驗結果
2.2.1 料水比對巖藻多糖得率的影響 由圖2可知,隨料水比的增加,巖藻多糖得率明顯提高。是由于加入溶劑量少時,材料本身吸水膨脹,影響細胞與酶充分結合;隨著溶劑量的增大,細胞內物質溶出,多糖得率隨之增大。但隨著溶劑量的繼續增加,多糖得率增加趨于穩定,選擇1∶30為自變量料水比的零水平。
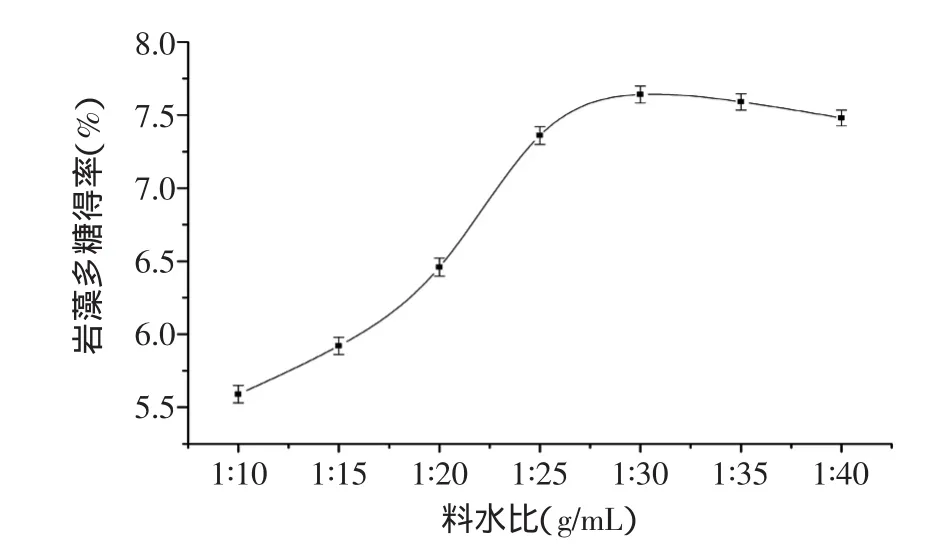
圖2 料水比對巖藻多糖提取的影響Fig.2 Effect of alga/water ratio on extraction of fucoidan
2.2.2 酶用量對巖藻多糖提取的影響 由圖3可知,未添加酶與添加酶處理相比較,多糖得率提高較明顯,當用量達2.5%時多糖得率達最大值,繼續增大用量得率幾乎無變化,由于加酶濃度達到一定值,酶分子飽和,底物水解速度增加不再顯著,故選擇2.5%為自變量酶用量的零水平。

圖3 酶用量對巖藻多糖提取的影響Fig.3 Effect of enzyme dosage on extraction of fucoidan
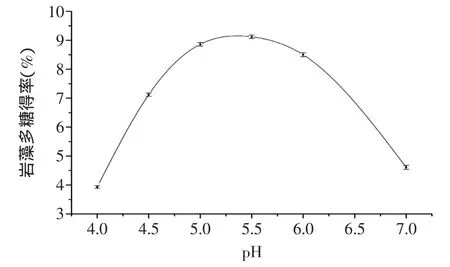
圖4 pH對巖藻多糖提取的影響Fig.4 Effect of pH on extraction of fucoidan
2.2.3 pH對海帶巖藻多糖提取的影響 pH是影響酶活力的重要因素。纖維素酶的最適pH4.0~5.5,木瓜蛋白酶的最適pH6~7。本實驗采用兩種酶復合作用,結果如圖4所示,pH<4.0或pH>7.0時,酶的活性降低,多糖得率低;兩種酶混合后最適pH范圍為5.0~6.0,其中pH為5.5時多糖提取最為理想,選擇5.5為自變量pH的零水平。
2.2.4 溫度對海帶巖藻多糖提取的影響 溫度是影響酶活力的另一重要因素。纖維素酶的最適溫度在45~65℃,而木瓜蛋白酶的最適合溫度55~65℃。由圖5可知,兩種酶混合后的適合溫度范圍為45~55℃,其中溫度為50℃時多糖提取最為合適。

圖5 溫度對巖藻多糖提取的影響Fig.5 Effect of temperature on extraction of fucoidan
2.3 響應面Box-Behnken實驗設計與結果
單因素實驗中,溫度與pH均為酶學性質參數,但pH對得率的影響要大于溫度,故在單因素實驗確定的中心點的基礎上,以酶解溫度50℃,酶解時間2.0h為條件,設計3因素3水平實驗,結果見表2。

表2 Box-Behnken實驗設計及結果Table 2 Test design and results of Box-Behnken
2.3.1 數據分析 以多糖得率為響應值,根據表3的實驗結果,Design Expert 8.0軟件對數據進行二次回歸分析,該數學模型的R2=0.9570,說明該數學模型與實驗擬合較好且可靠性高,可用于預測巖藻多糖的得率及其優化提取條件。
回歸方程為:Y1=14.51+2.26A+1.32B-0.32C+0.83AB-1.07AC+0.6BC-2.39A2-1.30B2-1.32C2,其方差分析見表3。由表3可知,A和B對Y1的影響均為顯著,尤其因素料水比(A)的影響極為顯著,與文獻[15]報道相吻合;由F值可知,3個因素對Y影響的排序為:料水比>酶用量>酶解pH。

表3 模型方差分析結果Table 3 The results of variance analysis
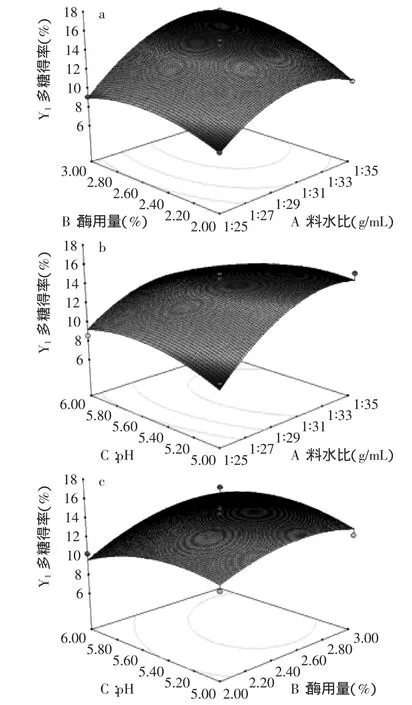
圖6 各兩因素交互影響巖藻多糖得率的響應面圖Fig.6 Each interaction of two factors on fucoidan yield
響應面優化過程中,所選三個因素的交互作用的響應面圖見圖6。圖6(a)中,隨料水比的增加,多糖得率增加,適當增加酶用量也可增加多糖得率;圖6(b)中料水比與pH影響均呈拋物線,二者交互影響較顯著;圖6(c)中酶用量與pH對多糖得率影響較明顯,但二者的交互作用不顯著。
2.3.2 最優值選擇 經軟件分析,該模型的最大估計值為15.42%,對應自變量值為料水比1∶35,酶用量2.57%,酶解pH5.32,故選取料水比1∶35,酶用量2.5%,酶解pH5.32。為確定實驗結果的可靠性,對上述優化條件進行驗證實驗,巖藻多糖得率為14.53%±0.05%,與預測值15.42%接近,驗證模型的準確性,測定多糖含量為75.36%±0.12%。
利用高壓均質與酶法結合,通過響應面優化提取工藝后,較傳統提取方法而言,提取時間縮短,能耗減少,巖藻多糖得率及純度均提高,為獲得優質巖藻多糖的產業化提供依據。
2.3.3 紅外光譜 巖藻多糖紅外光譜圖(圖7),3425、2925、1616cm-1處吸收峰為糖類特征性吸收峰;1255cm-1附近處是由硫酸基S=O伸縮振動引起的,證明巖藻多糖含有硫酸基;1051cm-1處為C-O的伸縮振動峰;821cm-1為C-O-S鍵的吸收峰,證明硫酸基連接在糖環上;在1700~1750cm-1附近未檢測到吸收峰,說明不含糖醛酸[21],與張文清等[22]報道巖藻多糖單糖組分不含糖醛酸,結構類似。

圖7 巖藻多糖的紅外光譜圖Fig.7 IR spectrum of fucoidan
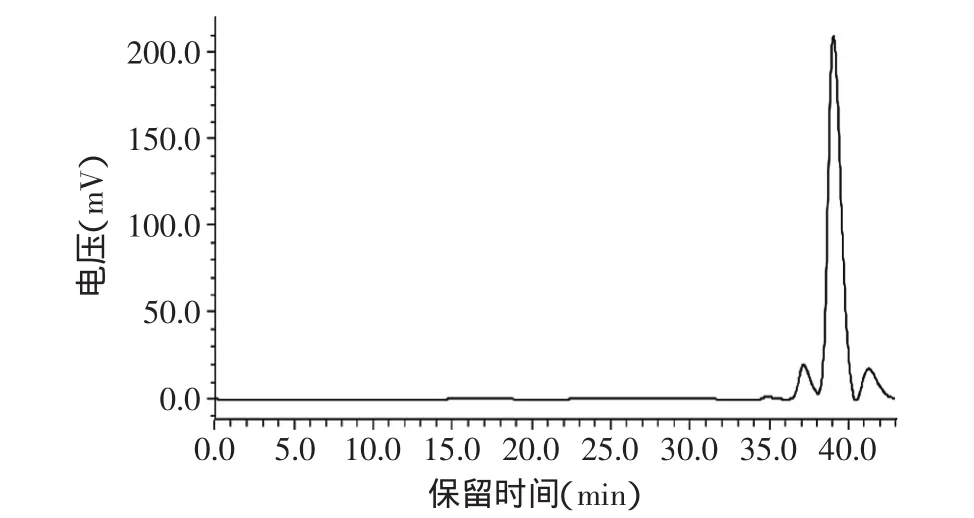
圖8 海帶巖藻多糖HPGFC色譜圖Fig.8 HPGFC chromatograms of laminaria japonica fucoidan
2.3.4 巖藻多糖分子量的測定 葡聚糖標準品為標樣,以葡聚糖的分子量對數為縱坐標與保留時間為橫坐標繪制分子量校正曲線,得y=-0.43x+12.31,R2=0.991。如圖8所示,分離得到三個峰,其分子量為別為639、248、79ku,與有關文獻[23]報道相差較大,這與原材料不同提取方法不同有關。
2.3.5 巖藻多糖單糖組成的測定 巖藻多糖水解后產物進行IC-PAD分析,如圖9所示,通過與標準單糖的保留時間(圖10)比較,得知巖藻多糖樣品由7種單糖組成,分別為巖藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖;糖含量分別為42.81%、1.95%、1.57%、31.35%、3.30%、5.56%、13.30%,與文獻[23]報道結果相近,不含有葡萄糖醛酸,與上述紅外結果一致。
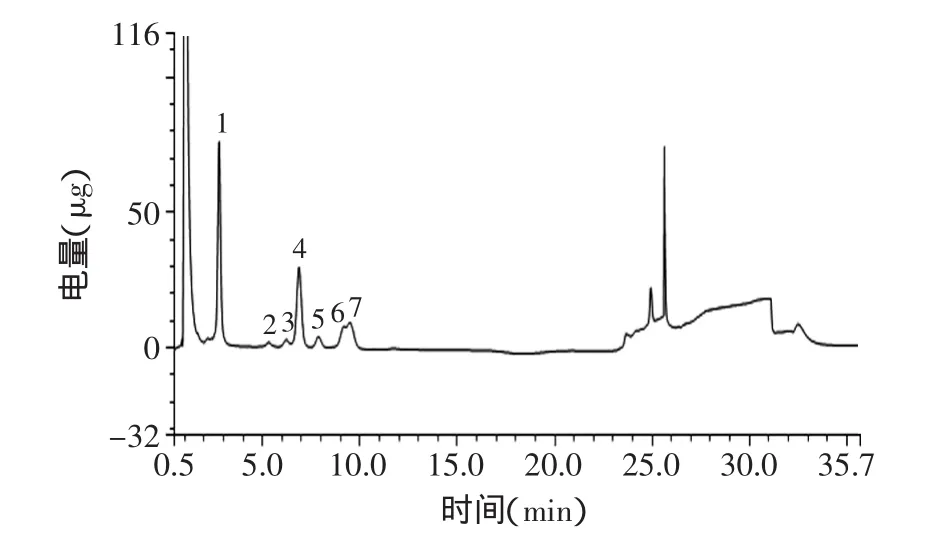
圖9 海帶巖藻多糖離子交換色譜圖Fig.9 Ion exchange chromatogram of mixed standard solution

圖10 混合標準液離子交換色譜圖Fig.10 Ion exchange chromatogram of mixed standard solution
3 結論
在單因素實驗基礎上,運用響應面實驗優化巖藻多糖的提取工藝,其最佳條件為料水比1∶35,酶用量為2.5%,酶解pH為5.32,得率14.53%±0.05%;HPGFC測定巖藻多糖分子量為639、248、79ku;利用IC-PAD檢測巖藻多糖的組成成分及含量為:巖藻糖42.81%、鼠李糖1.95%、阿拉伯糖1.57%、半乳糖31.35%、葡萄糖3.30%、木糖5.56%、甘露糖13.30%。
[1]劉舒.三種褐藻中巖藻聚糖硫酸酯的純化及結構分析[D].大連:大連海洋大學,2013.
[2]婁翠,湯順清.海帶巖藻多糖的分離純化及結構特性的初步研究[J].食品工業科技,2012,33(4):135-137,141.
[3]諶素華,王維民.褐藻巖藻聚糖硫酸酯生物活性研究進展[J].食品工業科技,2009,30(6):371-374.
[4]Jing Wang,Feng Wang,Quanbin Zhang,et al.Synthesized different derivatives of low molecular fucoidan extracted fromLaminaria japonicaand their potential antioxidant activityin vitro[J].International Journal of Biological Macromolecules,2009,44(5):379-384.
[5]Kim WJ,Koo YK,Jung M,et al.Anti-coagulating activities of low-molecular weight fuco-oligosaccharides prepared by enzymatic digestion of fucoidan from the sporophyll of Korean Undaria pinnatifida.[J].Archives of Pharmacal Research,2010,33(1):125-131.
[6]董詩竹.海帶低分子量巖藻聚糖硫酸酯的制備及其抗血栓活性研究[D].青島:中國海洋大學,2011.
[7]李小婷,殷辰俞,孟徐蓮,等.褐藻糖膠抑制人肝癌細胞HepG2增殖的機制[J].南京醫科大學學報:自然科學版,2011(9):1261-1265.
[8]Thomas Hahn,Siegmund Lang,Roland Ulber,et al.Novel procedures for the extraction of fucoidan from brown algae[J].Process biochemistry,2012,47(12):1691-1698.
[9]趙前程,滕釗,汪秋寬,等.復合酶法提取海帶多糖的研究[J].沈陽農業大學學報,2007(2):220-223.
[10]賁永光,鐘紅茂,吳曉燕.海帶中褐藻糖膠的超聲提取工藝的優化[J].廣東藥學院學報,2010(5):466-469.
[11]Claudia P Passos,Manuel A Coimbra.Microwave superheated water extraction of polysaccharides from spent coffee grounds[J].Carbohydrate Polymers,2013,94(1):626-633.
[12]王健,吳永沛,于立國.超濾制備海帶巖藻聚糖的工藝研究[J].食品工業科技,2012,33(19):210-213.
[13]程仕偉,陳超男,馮志彬,等.海帶巖藻多糖的水提制備及其抗氧化活性研究[J].食品科學,2010(6):101-104.
[14]崔艷麗,王培培,周軍明,等.復合酶酶解法提取褐藻糖膠及其結構分析和抗氧化性研究[J].浙江大學學報:理學版,2011(5):536-540,549.
[15]鐘方曉,任海華,李巖.多糖含量測定方法比較[J].時珍國醫國藥,2007(8):1916-1917.
[16]臺文靜.3種海藻中巖藻聚糖的提取分離、結構表征及其對纖溶系統影響的研究[D].青島:中國海洋大學,2012.
[17]翟春,盛家榮.粘度法和高效凝膠滲透色譜法在普通念珠藻多糖分子量測定中的應用[C].//第六屆全國精細化學品化學學術會議論文集,2001:113-115.
[18]李靜,李仁勇,梁立娜,等.毛細管型離子色譜-脈沖安培法檢測枸杞多糖的單糖組成[J].分析化學,2012,40(9):1415-1420.
[19]孫海翔,尹卓容,馬美范.高壓均質破碎啤酒酵母細胞壁的研究[J].食品工業科技,2002,23(2):66-67.
[20]Rosa M Rodriguez-Jasso,Solange I Mussatto,Lorenzo Pastrana,et al.Microwave-assisted extraction of sulfated polysaccharides(fucoidan) from brown seaweed[J].Carbohydrate Polymers,2011,863.
[21]宮雪,丁黎,司敏達,等.植物多糖組分中糖醛酸的分析技術及其應用[J].藥學進展,2007(11):496-501.
[22]張文清,左萍萍,徐辰,等.海帶中巖藻多糖的分離純化與結構分析[J].食品科學,2012(1):68-71.
[23]劉穎.低分子量海帶巖藻多糖的制備及其抗腫瘤活性的研究[D].合肥:安徽農業大學,2012.

