胰島β細胞功能衰退之謎?——內質網應激在β細胞功能衰退中的作用
解放軍總醫(yī)院內分泌科 母義明
胰島素抵抗和胰島β細胞功能障礙是2型糖尿病(T2DM)的兩大發(fā)病機制[1]。研究顯示,胰島素抵抗早期即可發(fā)生,與非肥胖的正常糖耐量(NGT)者相比,肥胖的NGT者的胰島素敏感性已經下降了29%,肥胖的葡萄糖耐量異常(IGT)者的胰島素敏感性進一步下降28%,而β細胞功能衰退的發(fā)生及速度則決定了糖尿病的發(fā)病及進程[2]。因此,胰島素抵抗可能是T2DM發(fā)生的始動因素,當胰島β細胞功能不能繼續(xù)代償胰島素生理需求時血糖開始升高,最終進展為糖尿病[3],其中胰島素的早相分泌喪失發(fā)生較早,而各種因素所導致的胰島β細胞數(shù)量減少及功能紊亂是糖尿病致病機制的核心[4]。
胰島β細胞衰退的揭秘
2013年第49屆歐洲糖尿病研究學會(EASD)學術年會上將第48 屆Minkowski獎授予來自比利時布魯塞爾大學(ULB)伊拉斯姆斯醫(yī)院的Miriam Cnop教授,以表彰她長期致力于β細胞功能基礎研究的巨大貢獻。
Miriam Cnop教授的研究小組一直關注胰島β細胞及凋亡在單基因糖尿病及T2DM發(fā)病中的作用,闡明了游離脂肪酸(free fatty acid,F(xiàn)FA)誘導β細胞凋亡的信號轉導通路,發(fā)現(xiàn)內質網(endoplasmic reticulum,ER)應激在FFA誘導的β細胞凋亡中發(fā)揮了重要作用,并積極尋找能保護β細胞的治療靶標及干預策略。
1.T2DM的一級親屬早期即存在胰島β細胞功能的減退
Cnop等[5]研究在33名T2DM患者的非糖尿病一級親屬中連續(xù)7年采用靜脈及口服葡萄糖耐量試驗觀察其胰島素敏感性(insulin sensitivity,SI)、β細胞功能、葡萄糖自身代謝效應(glucose effectiveness,Sg)及葡萄糖耐量情況,結果顯示受試者的體重和腹圍雖然逐漸增加,但其SI、葡萄糖刺激后急性胰島素反應(AIRg)、Sg并未見顯著變化。然而當調整了胰島素敏感性對胰島素釋放的作用后,作為反映β細胞功能的葡萄糖處置指數(shù) [disposition index,DI(=AIRg*SI)]下降了22%(P<0.05)。初始評估為NGT的受試者,在之后的隨訪中有部分進展為IGT,與未進展為IGT的受試者相比,那些進展為IGT的受試者的DI下降達50%(P<0.05)。因此提示,T2DM的一級親屬的糖耐量減低與β細胞功能減退相關。
2.β細胞功能喪失的關鍵是β細胞的衰亡增加而并非增生能力下降
與嚙齒類動物不同,隨著年齡增加,人和哺乳動物的許多組織細胞尤其是那些氧化應激水平較高、壽命較長的組織細胞如神經元細胞、心肌細胞、胰島β細胞內的脂褐素小體(lipofuscin bodies,LBs))沉積增加。在胰島細胞,不僅線粒體和內質網膜經自噬作用(autophagy)發(fā)生溶酶體酶解退化,而且過量的分泌顆粒及細胞內膜也發(fā)生酶解退化,從而使胰島β細胞內的色素及金屬離子在細胞內堆積,形成LBs,因此LBs的沉積代表著廢物的貯存并聚集在細胞內而不能運送出細胞外。細胞內LBs沉積的速率、大小及成分與細胞活動如ER應激、線粒體更新、分泌顆粒降解等有關,所以評估脂褐素沉積的量可以作為細胞老化和細胞壽命的標志。人類尸檢的電鏡標本顯示,在生命早期(1歲)時胰島β細胞內就有脂褐素沉積存在,隨年齡增加β細胞LBs沉積量顯著增加,胰島內含有LBs的β細胞比例也有增加。在其他靈長類動物如猴子(5~30歲)的研究中也有相似的結果。但作為嚙齒類的小鼠試驗的結果則顯示細胞內LBs的含量不足人類的10%,只在60周齡以上的小鼠細胞內LBs才有所增加。然而人體內分裂旺盛的細胞,如人類胰島瘤細胞中的LBs含量也表現(xiàn)較少,且與年齡無關。正常情況下估算,人在20歲時LBs陽性的胰島β細胞比例可達97%,因此提示分化新生的胰島β細胞比例極少(不足3%),大部分的胰島β細胞在20歲以前已經形成并達到高峰,無證據(jù)表明20歲以后β細胞還有不斷新生和復制。不管是LBs含量還是LBs陽性細胞比例均與BMI或T2DM無關,提示成人胰島并非以細胞復制來應對胰島素需求增加。因此認為,β細胞的功能異常和凋亡,而非β再生能力下降是T2DM發(fā)病的關鍵因素[6,7]。綜上,正常人和T2DM患者的胰島β細胞增生都不活躍,早期即可發(fā)生的β細胞凋亡和功能異常是T2DM發(fā)生、發(fā)展的關鍵。
3.目前公認的導致胰島β細胞衰退的原因有以下幾種:
3.1 脂毒性作用 Cnop等[8]研究顯示,人的胰島β細胞內有富含LDL及vLDL的脂質貯存顆粒(lipid-storing vesicles,LSVs)的聚集。隨著增齡,β細胞內LSVs含量逐漸增加,這可能導致β細胞長期暴露于高脂環(huán)境下。β細胞內FFA聚集可誘導NO合酶產生及NO介導的β細胞凋亡;FFA增加線粒體的脂質氧化,使線粒體ATP生成減少,代謝偶聯(lián)因子下降,并從而產生更多的活性氧(ROS),誘導激活自噬溶酶體的酶解作用;FFA還通過誘導β細胞的ER應激引發(fā)細胞凋亡。因此,脂毒性促進β細胞衰退,是導致T2DM發(fā)病的重要因素[9]。
3.2 葡萄糖毒性作用
研究表明,中、重度血糖增高可以降低機體葡萄糖誘導的胰島素分泌(glucose-induced insulin secretion,GIIS),促進IGT進展為糖尿病。長期暴露于高糖條件下的大鼠胰島β細胞的表型發(fā)生改變[10]。事實上,長期暴露于高糖條件具有雙重作用,一些研究結果表明,β細胞的GIIS缺陷是由于高糖誘導下的ATP合成減少,稱之為“對葡萄糖的敏感性下降”;而另一些研究則顯示,β細胞暴露于高糖環(huán)境使其對高糖的敏感性增高,從而刺激線粒體代謝、胰島素原的合成及胰島素的分泌,這將引發(fā)在β細胞即使在低濃度葡萄糖時也存在ATP生成過多。因此在長時間暴露于高糖條件下時,雖然部分存活的β細胞仍存在對“葡萄糖的高敏感性”,但同時部分β細胞也已經發(fā)生了凋亡[11]。此外,Bachar等[12]研究還發(fā)現(xiàn),高糖通過增高IRE1α蛋白水平及激活JUN途徑,可以促進FFA誘導的ER應激,促進β細胞功能紊亂及導致β細胞凋亡的發(fā)生。
3.3 氧化應激及線粒體途徑
研究表明,GIIS可增強線粒體ATP信號,從而增加胰島β細胞線粒體的代謝流,而高脂可以增強這個作用。高糖、高脂通過呼吸鏈增加線粒體代謝流,進而增加活性氧(ROS)的生成;另一方面,隨之通過解偶聯(lián)蛋白2(UCP2)的作用降低線粒體膜的電壓,從而降低呼吸鏈的代謝流和活性氧的生成,發(fā)揮對ROS誘導損傷的保護性機制,但同時降低由代謝物質誘導的胰島素的分泌[13]。β細胞由于缺乏抗氧化酶的表達,尤其易受到ROS攻擊;增高的ROS破壞GIIS,降低β細胞關鍵基因的表達,并誘導細胞凋亡[14]。此外,氧化應激還觸發(fā)胰島素抵抗,從而在T2DM的發(fā)生發(fā)展過程中起重要的作用[15]。3.4 內質網(ER)應激途徑
ER應激是在細胞在高分泌活動時的重要適應性細胞信號反應,又稱非折疊蛋白反應(unfolded protein response,UPR)。這種細胞反應的目的是通過降低蛋白質翻譯,上調ER的分子伴侶(因此增加ER折疊能力)以及降解錯誤折疊的蛋白從而恢復ER穩(wěn)態(tài)[16]。當錯誤折疊的蛋白質聚集在內質網腔內引發(fā)ER應激時,導致ER膜蛋白IRE1、ATF6及PERK活化,這些ER應激轉換蛋白與ER分子伴侶(BiP)解離而激活,導致細胞內信號的轉導[17](見圖1)。

圖1 ER應激信號轉導途徑[17]
胰島β細胞大量合成胰島素(占所有合成蛋白質的50%以上),并高水平表達ER應激的轉換蛋白IRE1和PERK。臨床中可以看到,PERK的基因(EIF2AK3)突變可導致新生兒及嬰兒糖尿病(Wolscott-Rallison綜合征)[18];編碼ER Ca2+通道的WFS1基因突變導致Wolfram綜合征伴糖尿病[19];而特異性針對β細胞的胰島素基因突變也可導致新生兒糖尿病[20,21],這些突變可能是引起胰島素的錯誤折疊從而引發(fā)ER應激,進而破壞胰島細胞功能,導致β細胞凋亡和數(shù)量減少;動物研究顯示,攜帶Ins2基因錯義突變 (Cys96Tyr)的Akita小鼠自發(fā)出現(xiàn)高血糖和β細胞數(shù)量減少,而無胰腺炎和肥胖。在Akita小鼠發(fā)生糖尿病的過程中,ER分子伴侶BiP的mRNA表達增高,并誘導胰腺中ER應激相關凋亡因子CHOP的表達增加。體外試驗中,小鼠MIN6 β細胞過表達突變的胰島素insulin 2C96Y也誘導CHOP表達并導致β細胞凋亡;而破壞CHOP基因的表達可延緩雜合子Akita小鼠(Ins2WT/C96Y)糖尿病發(fā)病達8~10周[22]。
越來越多的研究表明,T2DM患者的胰島β細胞存在ER應激,例如,T2DM患者的胰腺組織切片顯示ER應激的標志物表達增高[23];T2DM患者β細胞的ATF3表達增高,eIF2α的下游蛋白ATF4[24]和CHOP[25]表達也增高。
研究發(fā)現(xiàn)[26],在INS-1細胞,棕櫚酸和油酸誘導CHOP、ATF-4、BiP、XBP-1,激活ATF-6 啟動子,提示這種FFA引發(fā)的ER應激反應可能在脂毒性所導致的β細胞凋亡的過程中發(fā)揮重要作用。研究顯示[27,28],飽和脂肪酸所誘導的ER應激是重要的T2DM發(fā)生機制,棕櫚酸誘導的β細胞凋亡主要是通過PERK依賴的CHOP途徑介導的。
棕櫚酸誘導的ER應激,分別經PERK-CHOP途徑,通過抑制Bcl-2,誘導Caspase 3的表達而引發(fā)細胞凋亡;經IRE1途徑,通過募集腫瘤壞死因子受體相關蛋白(TRAF2),激活下游JUN途徑進而促進凋亡發(fā)生;此外,IRE1還可直接激活Caspase 12,引發(fā)β細胞凋亡[29]。
此外,ER應激還與高脂飲食喂養(yǎng)誘導的肥胖小鼠肝臟及脂肪組織的胰島素抵抗有關[30];在肥胖者的脂肪和肝臟組織中也檢測到ER應激標志物的表達增高[31,32]。因此,ER應激可能是T2DM兩大病理生理紊亂,包括胰島素抵抗和β細胞功能衰退的共同機制[33]。
利拉魯肽保護胰島β細胞功能
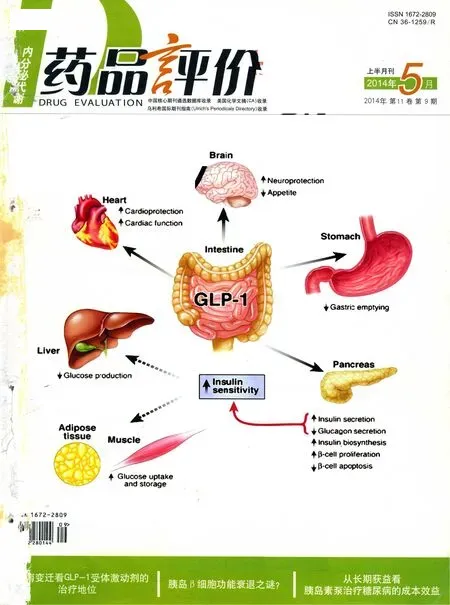
胰高血糖素樣肽-1(glucagon-like peptide-1,GLP-1)受體激動劑是一類新的具有多種效應的抗糖尿病藥物,這類藥物通過刺激胰島素分泌,抑制胰高糖素分泌等發(fā)揮降糖療效。近年來人GLP-1類似物利拉魯肽(Liraglutide)的相關研究顯示,其減少β細胞凋亡的相關證據(jù)越來越多。
Friedreich共濟失調(FRDA)是一種少見的由于Frataxin基因突變而致其功能喪失,從而導致呼吸鏈功能障礙而引發(fā)的一種神經變性疾病。該病可合并糖尿病(約占10%~30%),但機制不清。Cnop等[34]通過對41例FRDA患者的研究發(fā)現(xiàn),患者的葡萄糖處置指數(shù)顯著降低,提示存在胰島β細胞功能失調;對部分病例的尸檢胰腺病理切片分析,還發(fā)現(xiàn)FRDA患者胰島中的β細胞數(shù)量減少。這一結論在Frataxin敲除的大鼠β細胞研究中也得到證實,F(xiàn)rataxin敲除的大鼠β細胞及人胰島均有葡萄糖刺激的胰島素分泌減少及β細胞凋亡,這可能與Frataxin缺乏使β細胞對油酸及ER應激誘導的凋亡更加敏感有關。而GLP-1和葡萄糖依賴性胰島素釋放多肽(GIP)可以保護保護Frataxin缺失的β細胞免于凋亡。
利拉魯肽的體外研究[35],在高糖(25mmol/L)或正常糖(5mmol/L)條件下,分別加入利拉魯肽或3-methyadenine分別孵育INS-1細胞24小時后檢測細胞活力、自噬作用的相關指標,結果顯示,高糖處理后INS-1細胞活力降低;自噬作用被抑制,INS-1細胞活力下降,凋亡也增加;而同時在高糖條件下加入利拉魯肽INS-1細胞活力較單獨高糖處理時有顯著增加。因此認為利拉魯肽可以保護INS-1細胞免受高糖誘導的凋亡以及與之相伴隨的顯著增加的自噬作用的影響。
用原代新生大鼠胰島進行的體外研究顯示[36],天然GLP-1和利拉魯肽可以通過劑量依賴的方式抑制細胞因子和FFA誘導的胰島β細胞凋亡;并且這一抗凋亡效應是通過GLP-1受體發(fā)揮作用的。在體的動物實驗[37],在10周齡大的雄性db/db及m/m小鼠分別接受利拉魯肽或生理鹽水每日2次皮下注射共2周,比較治療前后胰島形態(tài)和生化、以及基因表達的改變情況。結果顯示,利拉魯肽改善db/db小鼠的代謝指標和胰島素敏感性,其不僅增加葡萄糖刺激的胰島素分泌(GSIS)及胰島內胰島素含量,降低胰島內甘油三酯含量,還可下調促凋亡基因、ER應激及脂質合成的基因,上調細胞抗凋亡及抗氧化應激的基因等。形態(tài)學上的分析包括胰島細胞的增殖、凋亡及氧化應激結果與基因分析結果相一致。
糖尿病前期的動物試驗結果也顯示[38],12周齡的OLEFT大鼠分別以利拉魯肽50μg/kg、100μg/kg、200μg/kg劑量或生理鹽水每日2次皮下注射共計12周,測定體重、攝食量、血脂、炎癥標志物(纖維蛋白原、高敏C反應蛋白、IL-6、TNFα、PAI-1)、血糖、胰島素敏感性及凋亡因子(Bcl-2和Bax)表達。結果發(fā)現(xiàn)12周齡的OLETF大鼠有顯著的體重及攝食量增加,血脂水平升高,炎癥因子及胰島素水平增高。FPG水平顯著增高但不超過7.0mmol/L且無IGT。治療12周以后,對照組IFG、IGT、胰島素抵抗、血脂、炎癥狀態(tài)均進一步惡化;胰島體積增大且結構紊亂,炎性細胞浸潤,而三組利拉魯肽治療組的IFG、IGT、增高的血脂及炎癥標志物均得到逆轉;胰島素抵抗程度與治療前水平相當;且利拉魯肽恢復胰島結構,上調Bcl-2表達,下調Bax表達,提示利拉魯肽可能是通過調整凋亡因子及改善血脂代謝和炎癥狀態(tài)而恢復胰島功能,從而抑制糖尿病前期的OLETF大鼠向糖尿病演變。
總結
在T2DM發(fā)生發(fā)展過程中,胰島β細胞數(shù)量減少及β細胞功能紊亂是核心的致病因素,其中涉及各種不同的發(fā)生機制,其中近年來ER應激研究進展較快,并且ER應激被認為是β細胞功能衰退的重要原因之一。利拉魯肽具有抗ER應激、促進β細胞增殖、分化,抗凋亡、抗氧化應激等多重作用從而抑制β細胞的凋亡,能夠更好地保護胰島功能和保存胰島細胞數(shù)量,因此在T2DM治療中具有美好的前景。
[1]Ferrannini E.Insulin resistance versus insulin deficiency in non-insulin-dependent diabetes: problems and prospects.Endocrine Rev, 1998, 19(4): 477-490.
[2]Jallut D, Golay A, Munger R, et al.Impaired glucose tolerance and diabetes in obesity: a 6-year follow-up study of glucose metabolism.Metabolism, 1990,39(10):1068-1075.
[3]Defronzo RA.BantingLecture.From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus.Diabetes, 2009, 58(4):773-795.
[4]Spellman CW.Islet cell dysfunction in progression to diabetes mellitus.J Am Osteopath Assoc, 2007, 107(Suppl): S1-S5.
[5]Cnop M, Vidal J, Hull RL, et al.Progressive loss of beta-cell function leads to worsening glucose tolerance in first-degree relatives of subjects with type 2 diabetes.Diabetes Care, 2007, 30(3): 677-682.
[6]Cnop M, Igoillo-Esteve M, Hughes SJ, et al.Longevity of human islet α- and β-cells.Diabetes Obes Metab, 2011, 13(Suppl 1): 39-46.
[7]Cnop M, Hughes SJ, Igoillo-Esteve M, et al.The long lifespan and low turnover of human islet beta cells estimated by mathematical modeling of lipofuscin accumulation.Diabetologia, 2011, 53(2):321-330.
[8]Cnop M, Grupping A, Hoorens A,et al.Endocytosis of low-density lipoprotein by human pancreatic beta cells and uptake in lipid-storing vesicles, which increase with age.Am J Pathol, 2000, 156(1):237-244.
[9]Cnop M.Fatty acids and glucolipotoxicity in the pathogenesis of Type 2 diabetes.Biochem Soc Trans, 2008, 36(Pt 3): 348-352.
[10]Kaiser N, Leibowitz G, Nesher R.Glucotoxicity and β-cell failure in type 2 diabetes mellitus.J Pediatr Endocrinol Metab, 2003, 16(1): 5-22.
[11]Cnop M, Welsh N, Jonas JC, et al.Mechanisms of Pancreatic β-Cell Death in Type 1 and Type 2 Diabetes:Many Differences, Few Similarities.Diabetes, 2005, 54(Supp 2): S97-107.
[12]Bachar E, Ariav Y, Ketzinel-Gilad M, et al.Glucose amplifies fatty acid-induced endoplasmic reticulum stress in pancreatic beta-cells via activation of mTORC1.PLoS One, 2009, 4(3):e4954.
[13]Lenzen S.Oxidative stress: the vulnerable beta-cell.Biochem Soc Trans, 2008,36(Pt 3):343-347.
[14]Simmons RA.Developmental origins of diabetes: The role of oxidative stress.Best Pract Res Clin Endocrinol Metab, 2012, 26(5): 701-708.
[15]Pitocco D, Tesauro M, Alessandro R, et al.Oxidative stress in diabetes:implications for vascular and other complications.Int J Mol Sci, 2013, 14(11):21525-21550.
[16]Eizirik DL, Cardozo AK, Cnop M.The role for endoplasmic reticulum stress in diabetes mellitus.Endocr Rev, 2008, 29(1):42-61.
[17]Cnop M, Igoillo-Esteve M, Cunha DA, et al.An update on lipotoxic endoplasmic reticulum stress in pancreatic beta-cells.Biochem Soc Trans, 2008,36(Pt 5): 909-915.
[18]Delepine M, Nicolino M, Barrett T, et al.EIF2AK3, encoding translation initiation factor 2-alpha kinase 3, is mutated in patients with Wolcott-Rallison syndrome.Nat Genet, 2000, 25(4):406-409.
[19]Inoue H, Tanizawa Y, Wasson J, et al.A gene encoding a transmembrane protein is mutated in patients with diabetes mellitus and optic atrophy (Wolfram syndrome).Nat Genet, 1998, 20(2):143-148.
[20]Colombo C, Porzio O, Liu M, et al.Seven mutations in the human insulin gene linked to permanent neonatal/infancy-onset diabetes mellitus.J Clin Invest,2008, 118(6):2148-2156.
[21]Stoy J, Edghill EL, Flanagan SE, et al.Insulin gene mutations as a cause of permanent neonatal diabetes.Proc Natl Acad Sci USA, 2007, 104(38): 15040- 15044.
[22]Oyadomari S, Koizumi A, Takeda K, et al.Targeted disruption of the Chop gene delays endoplasmic reticulum stress-mediated diabetes.J Clin Invest, 2002,109(4): 525-532.
[23]Laybutt DR, Preston AM, Akerfeldt MC, et al.Endoplasmic reticulum stress contributes to beta cell apoptosis in type 2 diabetes.Diabetologia, 2007, 50(4):752-763.
[24]Hartman MG, Lu D, Kim ML, et al.Role for activating transcription factor 3 in stress-induced β-cell apoptosis.Mol Cell Biol, 2004, 24(13): 5721-5732.
[25]Huang CJ, Lin CY, Haataja L, et al.High expression rates of human islet amyloid polypeptide induce endoplasmic reticulum stress mediated β-cell apoptosis, a characteristic of humans with type 2 but not type 1 diabetes.Diabetes, 2007, 56(8): 2016-2027.
[26]Kharroubi I, Ladriere L, Cardozo AK, et al.Free fatty acids and cytokines induce pancreatic beta-cell apoptosis by different mechanisms: role of nuclear factor-kappa B and endoplasmic reticulum stress.Endocrinology, 2004, 145(11):5087-5096.
[27]Cunha DA, Hekerman P, Ladriere L, et al.Initiation and execution of lipotoxic ER stress in pancreatic β-cells.J Cell Sci, 2008, 121(Pt 14): 2308-2318.
[28]Pirot P, Ortis F, Cnop M, et al.Transcriptional regulation of the endoplasmic reticulum stress gene chop in pancreatic insulin-producing cells.Diabetes, 2007,56(4): 1069-1077.
[29]Cnop M, Ladriere L, Igoillo-Esteve M, et al.Causes and cures for endoplasmic reticulum stress in lipotoxic β-cell dysfunction.Diabetes Obes Metab, 2010,12(Suppl 2): 76-82.
[30]Ozcan U, Cao Q, Yilmaz E, et al.Endoplasmic reticulum stress links obesity,insulin action, and type 2 diabetes.Science, 2004, 306(5695): 457-461.
[31]Boden G, Duan X, Homko C, et al.Increase in endoplasmic reticulum stress related proteins and genes in adipose tissue of obese, insulin-resistant individuals.Diabetes, 2008, 57(9): 2438-2444.
[32]Sharma NK, Das SK, Mondal AK, et al.Endoplasmic reticulum stress markers are associated with obesity in nondiabetic subjects.J Clin Endocrinol Metab,2008, 93(11): 4532-4541.
[33]Eizirik DL, Cardozo AK, Cnop M.The role for endoplasmic reticulum stress in diabetes mellitus.Endocr Rev, 2008, 29(1): 42-61.
[34]Cnop M, Igoillo-Esteve M, Rai M, et al.Central role and mechanisms of b-cell dysfunction and death in Friedreich ataxia–associated diabetes.Ann Neurol,2012, 72(6):971-982.
[35]Chen ZF, Li YB, Han JY, et al.Liraglutide prevents high glucose level induced insulinoma cells apoptosis by targeting autophagy.Chin Med J (Engl), 2013, 126(5):937-941.
[36]Bregenholt S, Moldrup A, Blume N, et al.The long-acting glucagon-like peptide-1 analogue, liraglutide, inhibits beta-cell apoptosis in vitro.Biochem Biophys Res Commun, 2005, 330(2):577-584.
[37]Shimoda M, Kanda Y, Hamamoto S, et al.The human glucagon-like peptide-1 analogue liraglutide preserves pancreatic beta cells via regulation of cell kinetics and suppression of oxidative and endoplasmic reticulum stress in a mouse model of diabetes.Diabetologia, 2011, 54(5):1098-1108.
[38]Guo N, Sun J, Chen H, et al.Liraglutide prevents diabetes progression in prediabetic OLETF rats.Endocr J, 2013, 60(1):15-28.