利用擬南芥鑒定雙孢蘑菇Hsp20和Adcs基因的耐溫功能
鄧立新,盧鐘磊,沈月毛,宋思揚*
(1.廈門大學生命科學學院,福建 廈門 361102;2.山東大學藥學院,山東 濟南 250012)
雙孢蘑菇[AgaricusbisporusLange(Imbach)]是目前世界上栽培最廣泛、產量最高、消費量最大的食用菌,屬于穩(wěn)溫結實性的菌類,在炎熱的夏季,菌絲體幾乎無法存活,培育耐高溫的菌株具有十分重要的經濟意義[1-2].由于雙孢蘑菇遺傳上相當保守,傳統(tǒng)的育種技術,已經逐漸無法滿足人們對雙孢蘑菇現(xiàn)代育種的要求.雙孢蘑菇不同菌株間存在著種質差異,通常抗逆性好的不優(yōu)質、而優(yōu)質的抗逆性差:02菌株是典型的高產菌株,其耐熱性也比較好,可在25~28 ℃下栽培,但其子實體質量較差,易開傘,制罐得率低;商業(yè)化菌株8213菌株與02菌株親緣關系非常近,為優(yōu)質型菌株,但耐熱能力差,只能在16~22 ℃下栽培.比較02菌株和8213菌株的差異基因,將有希望從分子水平闡明02菌株的耐溫本質,為耐熱優(yōu)質轉基因蘑菇的育種奠定基礎[3].
我們實驗室前期從02菌株中克隆了數(shù)十條差異表達基因cDNA全長[4].為了確定哪些基因真正與耐溫有關,需要建立一種耐溫基因的鑒定方法.通過模式生物擬南芥(Arabidopsisthaliana)鑒定耐熱基因是一種成熟的方法[5-7].真菌的耐熱基因分析基本上以模式生物釀酒酵母為主,利用模式植物擬南芥鑒定雙孢蘑菇的耐溫基因尚未見報道.本文挑選02菌株相對8213菌株組成性上調表達基因4-氨基-4-脫氧分支酸合成酶基因(Adcs)和02菌株熱脅迫后誘導性上調表達基因熱休克蛋白20基因(Hsp20),探討利用轉基因擬南芥耐熱表型鑒定雙孢蘑菇耐溫基因.
1 材料與方法
1.1 實驗材料
轉化雙孢蘑菇Adcs基因的農桿菌(Agrobacterium) ATEG5(GV3101)由盧鐘磊提供[4];載體pDONR207、pEarleygate 201和大腸桿菌(Escherichiacoli)菌株DB3.1為本實驗室保存;哥倫比亞野生型擬南芥(Col-0)由陶懿老師實驗室提供;attB和attP位點之間的重組(BP)克隆酶和attL和attR位點之間的重組(LR)克隆酶購自美國 Invitrogen 公司;Taq DNA聚合酶,DNA Marker購自寶生物工程(大連)有限公司;蛋白質Marker、ECL發(fā)光液購自廈門鷺隆生物有限公司;草銨磷購自上海生工生物工程股份有限公司;羊抗鼠二抗購自杰克遜免疫研究實驗室(Jackson Immuno Research Laboratories,INC);流感病毒血凝素標簽抗體購自美國Origene公司;引物合成及DNA樣品測序委托廣州英濰捷基公司;Murashige and Skoog 基礎培養(yǎng)基購自美國Sigma Aldrich公司.
1.2 ATEG2載體構建
根據(jù)Gateway 克隆原理構建ATEG2載體,構建流程圖如圖1.采用兩輪PCR將BP克隆酶識別的attB位點構建入Hsp20基因ORF的兩側,酶用ExTaq.第一輪PCR,引物為attB1-2F111:5′-AAAAAGCAGGCTTCATGTCTACTTTCTTCTACGA-3′和attB2-2F111:5′-AGAAAGCTGGGTTTCAATGCCTCAGCTGGGCATC-3′,擴增條件為95 ℃預變性2 min;95 ℃變性30 s,68 ℃延伸30 s,15個循環(huán);最后 72 ℃延伸2 min;第二輪PCR,引物為attB1-接頭:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTTC-3′和attB2-接頭:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTT-3′,擴增條件為95 ℃預變性1 min;94 ℃變性30 s,55 ℃退火30 s,68 ℃延伸30 s,25個循環(huán);最后 68 ℃延伸2 min;PCR產物電泳,切膠回收500 bp目的片段.BP 反應 (5 μL):attB-PCR產物 (25 fmol/L),pDONR-207 質粒 (25 fmol/L),BP克隆酶1 μL,補超純水至5 μL;25 ℃反應過夜;1 μL 蛋白酶K,37 ℃處理10 min;稀釋至10 μL,取1 μL 轉化大腸桿菌DB3.1感受態(tài)細胞,涂布LB 平板 (含慶大霉素10 μg/mL),挑選陽性單克隆,菌液PCR 驗證,克隆測序,提取入門克隆(Entry clone)質粒,測定濃度;LR反應 (5 μL):入門克隆 (25 fmol/L),pEarleygate201載體(25 fmol/L),LR克隆酶1 μL,補超純水至5 μL;25 ℃反應過夜;1 μL 蛋白酶K,37 ℃處理10 min;稀釋至10 μL,取1 μL 轉化大腸桿菌DB3.1感受態(tài)細胞,涂布LB 平板 (含卡那霉素50 μg/mL),挑選陽性單克隆,菌液PCR 驗證,克隆測序.提取出最終的表達克隆 (expression clone) 質粒ATEG2,-20 ℃保存.

圖1 ATEG2 載體構建流程圖Fig.1 A flow chart illustrating construction of ATEG2 vector
1.3 ATEG2載體轉化農桿菌
加入1 μL ATEG2質粒(0.1 μg)到50 μL農桿菌感受態(tài)細胞GV3101中,冰上混勻放置5 min;轉移入2 mm電擊轉化杯中,設置電轉化儀參數(shù)(電容:25 μF,電壓:2.47 kV,電阻:400 Ω,脈沖時間:9 ms)電擊轉化;電轉化完成,冰上放置5 min,加入 10 mL 新鮮LB培養(yǎng)基,28 ℃活化1 h;涂布質粒抗性LB平板(含福霉素50 μg/mL,慶大霉素 10 μg/mL),28 ℃倒置培養(yǎng)2 d后挑取菌落進行PCR鑒定.成功轉化雙孢蘑菇Hsp20基因的農桿菌標記為ATEG2(GV3101).
1.4 轉基因擬南芥植株的獲得
采用花序浸漬法分別使農桿菌ATEG2(GV3101)、ATEG5(GV3101)侵染花器官以轉化擬南芥[8].收獲T1代種子,幼苗以30 mg/L 草銨磷噴藥篩選,每周1次,共3次,抗性植株繼續(xù)種植到自交T3代,T3代植株用于純合子鑒定、PCR鑒定、Western blot鑒定以及耐熱表型分析.
1.5 轉基因擬南芥純合子的鑒定
轉基因擬南芥T3代,在平板上以含10 mg/L草銨磷的1/2 MS培養(yǎng)基篩選,通過T3代抗性性狀分離比來判定其對應的T2代株是否為純合子.單基因交換雜合子經抗生素篩選將有1/4左右小苗白化死亡,而純合子則全部為正常小苗.收集純合子種子T3代,擴大種植收種,用于隨后的生理、機理實驗.
1.6 轉基因擬南芥植株PCR鑒定
以擬南芥葉片為材料采用SDS法提取基因組DNA,檢測過表達轉基因植株所用的PCR引物采用pEarleyGate201載體通用引物attB1-接頭:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTTC-3′和attB2-接頭:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTT-3′.ATEG2轉基因植株檢測使用rTaq酶;擴增條件為95 ℃預變性5 min;95 ℃變性30 s,57 ℃退火35 s,72 ℃延伸30 s,35個循環(huán);最后72 ℃延伸10 min;目的片段500 bp.檢測ATEG5轉基因植株使用LaTaq酶;擴增條件為95 ℃預變性5 min;95 ℃變性30 s,57 ℃退火35 s,72 ℃延伸2 min,32個循環(huán);最后72 ℃延伸10 min;目的片段 2 200 bp.
1.7 轉基因擬南芥植株Western blot鑒定
將擬南芥葉子用液氮研磨至粉末,取10 mg 左右的干粉加入到40 μL磷酸鹽緩沖液(含10 mg/L苯甲基磺酰氟和20 mg/Lβ-巰基乙醇)中,漩渦震蕩混勻,再冰浴抽提10 min;最后 4 ℃ 20 000g離心15 min,去除不溶性碎片,取上清30 μL 加入10 μL 的4×上樣緩沖液混勻,100 ℃煮10 min.ATEG2和ATEG5 樣品分別使用質量分數(shù)15%和10% SDS-聚丙烯酰胺(PAGE)膠分離蛋白,按40 μg/孔上樣.蛋白膠轉聚偏二氟乙烯膜(PVDF)后,進行Western blot鑒定.一抗為流感病毒血凝素標簽(HA)抗體1∶2 000(體積比);二抗為羊抗鼠二抗1∶5 000(體積比).化學發(fā)光(ECL)法顯色后,使用Bio-RAD凝膠成像系統(tǒng)印跡成像.

表1 轉基因擬南芥T3代苗純合子鑒定Tab.1 Homozygote identification for transgenic A. thaliana T3 generation seedlings
注:Col-0:哥倫比亞野生型擬南芥;2M-1、2M-2、2S-1、2S-2、2S-3:轉基因ATEG2 擬南芥;5F-1、5F-2、5G-1、5G-2、5L-1、5L-2:轉基因ATEG5擬南芥.
1.8 轉基因擬南芥植株耐熱表型分析
下胚軸和根的耐熱表型分析:在1/2 MS 平板背面上畫一直線,在平板正面線上均勻點種25粒左右已消毒的擬南芥種子,4 ℃避光春化3 d.取出平板,置23 ℃培養(yǎng)箱,避光垂直培養(yǎng)2 d,當觀察到至少80% 以上種子萌發(fā)長出,根和下胚軸總長度約0.8~1 cm時開始熱激.各取15顆幼苗標記根和下胚軸的位置.45 ℃熱激1 h后,恢復23 ℃避光垂直培養(yǎng),熱激后3 d 內每天記錄根和下胚軸的延伸距離;實驗3次重復[4].
幼苗耐熱表型分析:經過表面消毒的種子,在1/2 MS平板上均勻點種,4 ℃春化3 d.取出平板,置25 ℃光照培養(yǎng)箱培養(yǎng)7 d 使小苗長出.45 ℃熱激1 h后,恢復25 ℃光照培養(yǎng),熱激后7 d內觀察并記錄小苗的存活情況;實驗3次重復[5].
2 結果與分析
2.1 轉基因擬南芥植株的獲得
成功侵染的T1代擬南芥種子攜帶pEarleyGate201表達載體的草丁膦乙酰轉移酶(phosphinothricin acetyltransferase)基因(bar),具有草銨磷抗性[9].T1代擬南芥種子種植后,經過2~3次草銨磷噴藥篩選,再經過7 d的生長,能長出4片以上真葉的存活小苗基本上可確認具有草銨磷抗性,如圖2中箭頭所示.轉基因擬南芥T1代種子種植后,長出小苗經過30 mg/L草銨磷3次噴藥篩選,分別保留15棵左右存活小苗,傳代獲得純合子.

圖2 轉基因擬南芥苗草銨磷噴藥篩選Fig.2 Basta resistance selection of transgenic A. thaliana seedlings
2.2 轉基因擬南芥純合子鑒定
選擇轉基因擬南芥T3代種子ATEG-基因-系-株(T3)(以下簡化為geneline-strain)用于純合子鑒定.各轉基因植株分別取36粒種子點種1/2 MS培養(yǎng)基(含10 mg/L 草銨磷),25 ℃培養(yǎng)7 d,記錄存活的綠苗數(shù)(表1).ATEG2中綠苗數(shù)超過3/4比例的為2M-2、2S-3,但仍為雜合子.ATEG5有4個植株已經是純合子,分別是5F-1、5F-2、5G-1、5G-2.
2.3 轉基因擬南芥植株PCR鑒定
圖3(a)中,ATEG-2(T3代)小苗2M-1、2M-2、2S-1、2S-2、2S-3、2M(2M為ATEG2 T2代樣品)分別取葉子,提取DNA,以attB1-接頭和attB2-接頭為引物PCR均得到500 bp陽性片段,而野生型擬南芥無此特異條帶,說明2M-1、2M-2、2S-1、2S-2、2S-3、2M均已成功轉化Hsp20基因,陽性對照以ATEG2質粒轉化的大腸桿菌DB 3.1菌液為模板同樣能擴增到500 bp條帶;圖3(b)中,ATEG-5(T3代)小苗5F-1、5F-2、5L-1、5L-2、5G-1、5G-2以attB1-接頭和attB2-接頭為引物PCR均得到2 200 bp左右的陽性片段,而野生型擬南芥無此特異條帶,說明5F-1、5F-2、5L-1、5L-2、5G-1、5G-2均已成功轉化Adcs基因,陽性對照以ATEG5質粒轉化的大腸桿菌DB 3.1菌液為模板同樣能擴增到2 200 bp條帶.
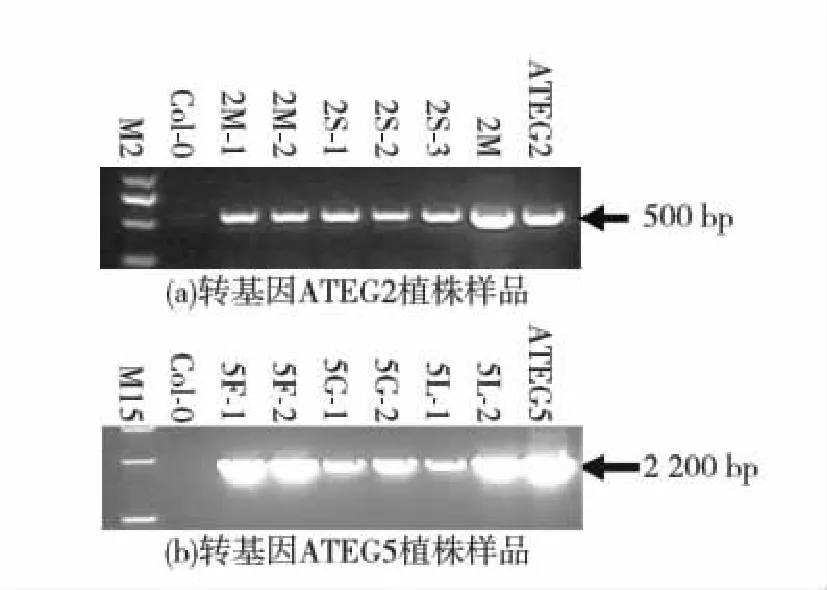
M2:DNA Marker 2000;M15:DNA Marker 15 000;2M:以ATEG2 轉基因擬南芥(T2代)基因組DNA為模板的PCR產物;ATEG2、ATEG5:分別轉化ATEG2、ATEG5質粒后的大腸桿菌DB 3.1菌液為模板的PCR產物.圖3 轉基因擬南芥苗PCR反應鑒定Fig.3 PCR identification of transgenic A. thaliana seedlings
2.4 轉基因擬南芥植株Western blot鑒定
抗HA標簽抗體Western blot實驗表明:轉基因擬南芥ATEG-2(T3代)2M-1、2M-2、2M均有較明顯的特異條帶,2S-1、2S-2、2S-3則條帶較弱(本圖中未能顯示)(圖4(a)),因此優(yōu)先選用ATEG-2M-2用于耐熱表型分析;轉基因擬南芥ATEG-5(T3代)5L-2、5G-2均有較明顯的特異條帶,5F-2、5L-1、5G-1條帶較弱,5F-1可能未表達(圖4(b)),因此優(yōu)先選用ATEG-5L-2、ATEG-5G-2 種子用于耐熱表型分析.在供試的轉基因菌株中目的基因的表達出現(xiàn)較明顯差異可能是由于不同菌株目的基因插入位置和拷貝數(shù)不同,導致蛋白表達差異.

蛋白質樣品:1:Col-0;2:2M-1;3:2M-2;4:2S-1;5:2S-2;6:2S-3;7:2M;8:Col-0;9:5F-1;10:5F-2;11:5G-1;12:5G-2;13:5L-1;14:5L-2.圖4 轉基因擬南芥苗蛋白質印跡驗證Fig.4 Western blot verification of transgenic A. thaliana seedlings
2.5 轉基因擬南芥植株耐熱表型分析
下胚軸熱激實驗表明,經過45 ℃熱激1 h處理后,再23 ℃恢復培養(yǎng)3 d,轉基因擬南芥ATEG-2M-2的下胚軸明顯繼續(xù)延伸,而野生型和轉基因擬南芥ATEG-5L-2不再延伸;說明過表達HSP20蛋白具有恢復擬南芥下胚軸伸長能力,但過表達4-氨基-4-脫氧分支酸合成酶(ADCS)蛋白不具有此能力(圖5(a)).幼苗熱激實驗同時表明:經過45 ℃熱激1 h 處理后,ATEG-2M-2還有部分存活苗,野生型和ATEG-5L-2則幾乎沒有存活苗,提示過表達HSP20蛋白可以提高幼苗的耐熱能力,但過表達ADCS蛋白并不能提高幼苗的耐熱能力(圖5(b)).
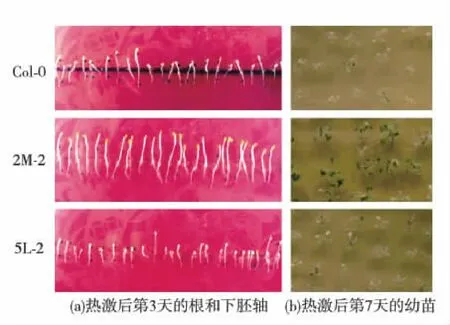
圖5 轉基因擬南芥苗耐熱表型鑒定Fig.5 Thermotolerance phenotype identification of transgenic A. thaliana seedlings
3 討 論
我們前期通過構建2個雙孢蘑菇抑制性差減雜交文庫,獲得了一批與熱脅迫相關的差異表達基因[4].通過抑制性差減雜交文庫Ⅰ(對照:熱處理8213菌株,樣品:熱處理02菌株),富集了熱脅迫后02菌株相對8213菌株的差異表達基因;通過抑制性差減雜交文庫Ⅱ(對照:常溫培養(yǎng)02菌株,樣品:熱處理02菌株),富集了02菌株自身熱脅迫差異表達基因.雙孢蘑菇作為食用真菌形態(tài)上比酵母復雜,推測其適應環(huán)境溫度的變化可能進化為更復雜的調控系統(tǒng),與植物可能有些相似之處.為了分析這些差異表達基因是否與耐溫有關,本文建立了一種基于轉基因擬南芥耐熱表型的方法用于耐溫基因鑒定.通常來講,利用模式生物釀酒酵母鑒定耐溫基因方法比較簡單易行,使用擬南芥鑒定耐溫基因方法則相對復雜,本文使用擬南芥來鑒定雙孢蘑菇的耐溫基因是基于本實驗室盧鐘磊的研究基礎之上,特別之處在于其可用于今后評價轉基因蘑菇品種對農作物等高等植物的影響,同時也可以探索耐溫基因在進化上是否具有保守性,并借鑒模式植物擬南芥成熟的耐熱機制促進食用菌類的耐溫機制研究.
本文分別選用文庫I和文庫II中的顯著上調基因Adcs和Hsp20基因,分別鑒定其是否與耐溫有關.通過抗性篩選,轉基因擬南芥幼苗的侵染率在0.02%左右(數(shù)據(jù)未顯示),自交傳代至T3代.又分別選擇ATEG2和ATEG5幾個轉基因植株進行純合子、PCR和Western blot鑒定.挑選接近純合子并且明確表達標簽蛋白ATEG2M-2和ATEG5L-2植株用于耐熱表型分析.
熱激蛋白(heat shock proteins,HSP),又稱熱休克蛋白或應激蛋白(heat stress proteins),是生物在高溫刺激下產生的一組蛋白.研究表明,熱激蛋白普遍存在于從細菌到高等生物的整個生物界,而且它們幾乎在所有的活細胞中都起著重要的作用.根據(jù)其分子質量大小可分為HSP100、HSP90、HSP70、HSP60和小分子HSP.大量研究表明,將小分子熱激蛋白相關基因轉入生物體后,能提高生物的耐熱性[7,10].通過在野生型擬南芥中過表達雙孢蘑菇熱休克蛋白基因Hsp20發(fā)現(xiàn),轉Hsp20基因擬南芥正常培養(yǎng)時下胚軸延伸與野生型及轉Adcs基因擬南芥大致相同(見圖6(a)左側部分3個NC柱形圖),但在高溫脅迫后僅轉Hsp20基因擬南芥下胚軸能夠恢復生長,提示雙孢蘑菇Hsp20基因具有抗熱脅迫的功能(見圖6(a)右側部分3個HS柱形圖).
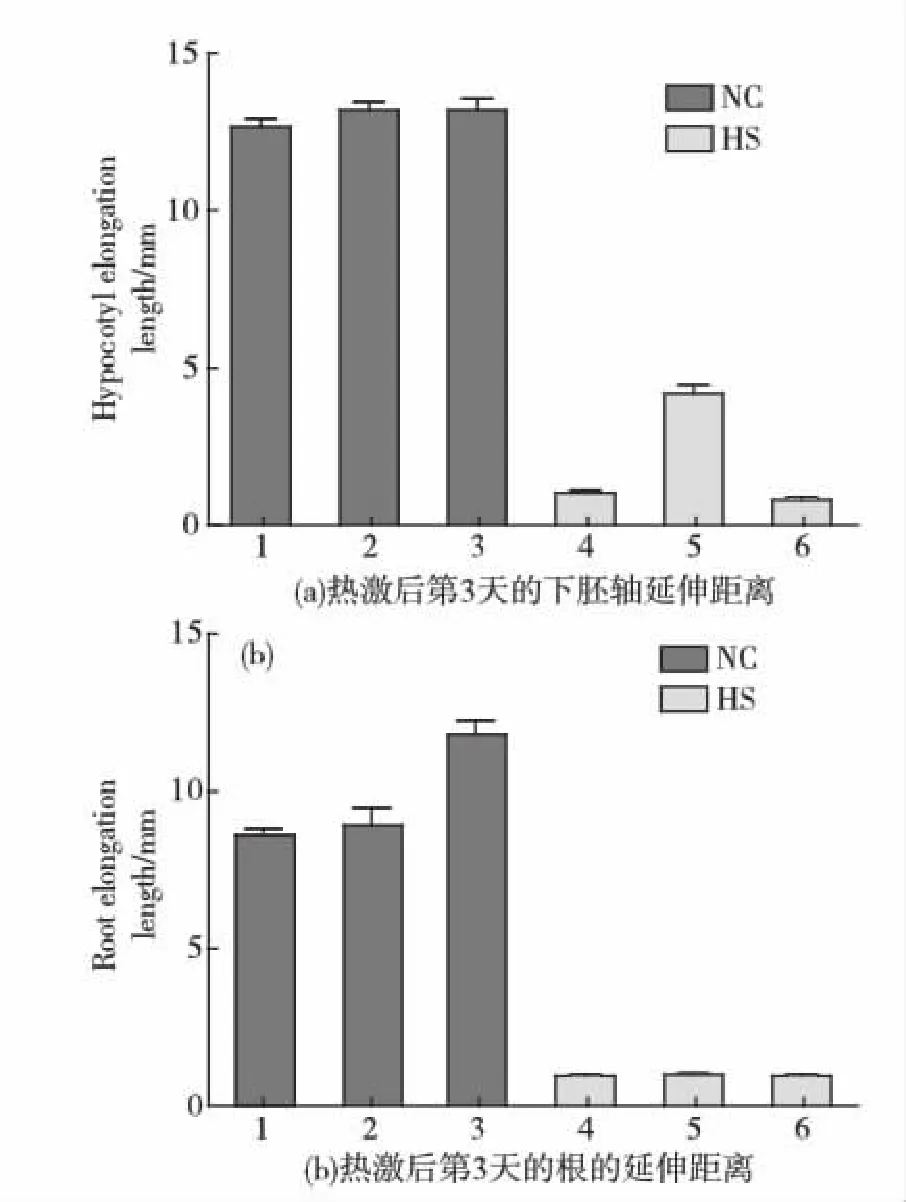
幼苗:1:Col-0;2:2M-2;3:5L-2;4:Col-0;5:2M-2;6:5L-2.1~3:NC,未經熱激處理組;4~6:HS,熱激處理組.圖6 轉基因擬南芥熱激后根和下胚軸延伸距離Fig.6 Roots and hypocotyls elongation length of transgenic Arabidopsis thaliana after heat-stress
本實驗室前期發(fā)現(xiàn)Pab基因(本文中表示為Adcs基因)在02菌株中組成性高表達并受熱誘導,通過轉基因蘑菇發(fā)現(xiàn),在高溫協(xié)迫下,高表達該基因的熱敏感8213菌株菌絲延伸距離明顯快于出發(fā)菌株8213,因此推測Adcs基因可能與02菌株的耐溫密切相關[4].體外功能實驗表明,Adcs基因表達蛋白預測為ADCS,ADCS催化分支酸和谷氨酰胺轉氨基反應得到ADC,后者經過酶促或自發(fā)裂解后得到對氨基苯甲酸(文章投稿中).對氨基苯甲酸是葉酸的前體,四氫葉酸由3個部分組成:分別稱為蝶啶環(huán),對氨基苯甲酸,以及長度多變的多聚谷氨酸鏈(1~8個殘基),其結合、運輸以及貢獻一碳單位的功能隨氧化狀態(tài)而不同(從最還原的狀態(tài)到最氧化的狀態(tài):甲基、亞甲基、次甲基、甲酰基)[11].由于葉酸輔酶的看家功能,在幼苗的發(fā)育過程中葉酸可能具有關鍵作用,滿足種子發(fā)芽以及發(fā)芽后生長對甲基,也即甲基-四氫葉酸的巨大需求[12].在我們的實驗過程中,正常培養(yǎng)條件下,轉基因擬南芥ATEG5根的延伸略快于野生型和轉基因ATEG2植株(見圖6(b)左側部分3個NC柱形圖),可能正是由于過表達ADCS促進了葉酸的生成,但是經過熱脅迫處理,轉基因ATEG5植株與野生型植株一樣不能恢復下胚軸和根的生長(見圖6(a)和(b)右側部分HS柱形圖).分析其可能原因有:1)45 ℃熱激后ADCS完全失活,無法在隨后的23 ℃正常培養(yǎng)下恢復酶活(通過大腸桿菌中表達雙孢蘑菇ADCS酶,體外活性分析其最適溫度在25 ℃,一旦溫度超過30 ℃時,酶活力就迅速下降);2)ADCS酶本身可能與耐熱無關.因此認為轉基因擬南芥耐熱表型結果尚未能說明Pab基因(本文以Adcs表示)與蘑菇耐溫直接相關.盧鐘磊[4]提到:“如圖3.32所示,對照組(未熱處理)中野生型植株和Pab轉基因株的下胚軸延伸長度基本相同;而在實驗組中(45 ℃高溫處理),野生型與轉基因株的下胚軸延伸距離呈極顯著的差異性,轉基因株(如ATEG-5A、AT25-L7)的下胚軸長度為10~13 mm,而野生型的下胚軸延伸要短得多,約5 mm.”這里的轉基因株下胚軸長度為10~13 mm可能是以下胚軸實際距離表示的.因為我們發(fā)現(xiàn),經過45 ℃ 1 h后恢復正常培養(yǎng)3 d,下胚軸基本不延伸,即使是ATEG2轉基因株下胚軸延伸距離也僅僅在5 mm左右.當然不同的轉基因株系(本文使用ATEG-5L)會存在一定的差別.綜上所述,本文研究提示,在高溫脅迫過程中,與大多數(shù)生物一樣,雙孢蘑菇體內蛋白要保持正常的活性,關鍵是需要HSP這一類分子伴侶協(xié)助蛋白質正常折疊,以維持其功能.
致謝:感謝廈門大學生命科學學院植物發(fā)育實驗室陶懿老師和中科院昆明植物研究所胡向陽老師為本實驗提供條件!
[1] 蔡衍山,呂作舟,蔡耿新.食用菌無公害生產技術手冊[M].北京:中國農業(yè)出版社,2003.
[2] Goltapeh E M,Danesh Y,Kamal S,et al.Biology and molecular approaches in genetic improvement of cultivated button mushroom (Agaricusbisporus)[J].Symbiotic Fungi,Berlin Heidelberg,Germany:Springer,2009:403-421.
[3] Romaine C.Transgenic breeding ofAgaricusbisporus:the next frontier[J].Acta Edulis Fungi,2005,12:174-184.
[4] 盧鐘磊.雙孢蘑菇耐熱分子機理研究及相關基因的克隆與功能驗證[D].廈門:廈門大學,2010.
[5] Hong S W,Vierling E.Mutants ofArabidopsisthalianadefective in the acquisition of tolerance to high temperature stress[J].Proceedings of the National Academy of Sciences,2000,97(8):4392-4397.
[6] 李春光,陳其軍,高新起,等.擬南芥熱激轉錄因子 AtHsfA2 調節(jié)脅迫反應基因的表達并提高熱和氧化脅迫耐性[J].中國科學:C輯,2005,35(5):398-407.
[7] 張路,胡偉娟,張啟翔,等.報春 PF sHSP 17-1 基因轉化擬南芥及耐熱鑒定[J].生物技術通報,2011(11):177-181.
[8] Clough S J,Bent A F.Floral dip:a simplified method forAgrobacterium-mediated transformation ofArabidopsisthaliana[J].The Plant Journal,1998,16(6):735-743.
[9] Earley K W,Haag J R,Pontes O,et al.Gateway-compatible vectors for plant functional genomics and proteomics[J].Plant Journal,2006,45(4):616-629.
[10] Sanmiya K,Suzuki K,Egawa Y,et al.Mitochondrial small heat-shock protein enhances thermotolerance in tobacco plants[J].FEBS letters,2004,557(1):265-268.
[11] Scott J,Rébeillé F,Fletcher J.Folic acid and folates:the feasibility for nutritional enhancement in plant foods[J].J Sci Food Agric,2000,80(7):795-824.
[12] Jabrin S,Ravanel S,Gambonnet B,et al.One-carbon metabolism in plants.Regulation of tetrahydrofolate synthesis during germination and seedling development[J].Plant Physiol,2003,131(3):1431-1439.

