PSMA對JNK/SAPK通路的激活及對前列腺癌細胞凋亡的調控*
黃 海, 賴義明, 何 旺, 董 文, 朱定軍, 張一鳴, 劉 皓, 于 浩, 畢良寬, 林天歆, 黃 健, 郭正輝, 杜 濤
(中山大學孫逸仙紀念醫院 1泌尿外科, 2產前診斷中心,廣東 廣州 510120)
前列腺特異性膜抗原(prostate-specific membrane antigen, PSMA)是一種前列腺上皮細胞Ⅱ型跨膜糖蛋白,由前列腺上皮細胞分泌,其氨基端位于細胞膜內,分子量約為100 kD,共含750個氨基酸,其中胞外段707個,跨膜段24個,胞內段19個。PSMA表達水平與前列腺癌病情的進展有明顯相關性,是前列腺癌天然的靶點,在前列腺癌診治及研究中有重大意義。近年來研究發現,PSMA具有信號轉導、細胞遷移、受體效應、營養攝取等功能[1-2]。其中信號轉導的機制并非完全清楚。c-Jun氨基末端激酶/應激激活的蛋白激酶(c-Jun N-terminal kinase/stress activated protein kinases, JNK/SAPK)信號通路是細胞內重要信號通路之一,在細胞增殖及凋亡中發揮關鍵作用,并與人類多種腫瘤的發生發展密切相關[3]。本研究中,我們以阻斷或增強PSMA表達的前列腺癌細胞LNCaP細胞株作為研究對象,在一般培養基及JNK/SAPK信號通路抑制劑SP600125作用下,發現在LNCaP細胞PSMA的表達與p-JNK/SAPK水平及細胞增殖、細胞周期具有一定聯系,推測PSMA可能通過JNK/SAPK信號通路對前列腺癌的增殖及凋亡起到調控作用。
材 料 和 方 法
1 材料
利用前期研究中建立的高效阻斷PSMA表達的shRNA慢病毒載體,阻斷前列腺癌細胞中PSMA的表達作為實驗的干擾組(shPSMA)[4];同時利用前期構建的PSMA真核表達載體pcDNA3.1-PSMA轉染前列腺癌細胞,促進前列腺癌細胞中PSMA的表達作為陽性實驗組(pcDNA-PSMA)[5-6];不做任何處理的LNCaP細胞株(購自中山大學實驗動物中心)作為空白組(control);加入JNK/SAPK抑制劑SP600125作為陰性對照研究。
RPMI-1640培養基和胎牛血清(HyClone);0.25%胰酶(吉瑪公司);Cell Counting Kit-8(Dojindo Laboratories);兔抗人磷酸化JNK多克隆抗體(CST);兔抗人PSMA單克隆抗體(Abcam);3-磷酸甘油醛脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)內參照抗體(Santa);辣根過氧化物酶(peroxidase horseradish, HRP)標記的羊抗兔抗體(ICL); SP600125 (CST);BCA法蛋白定量試劑盒(上海申能博采);柯達黑白膠片;增強化學發光(enhanced chemiluminescence,ECL)試劑盒(Thermo);超敏ECL試劑盒(Millipore);免疫組化染色試劑盒和濃縮型DAB試劑盒(中杉金橋);Annexin V-FITC細胞凋亡檢測試劑盒(Keygen)。
2 方法
2.1細胞培養 各組細胞分別于含100 mL/L FBS、1×105U/L青霉素、100 mg/L鏈霉素的RPMI-1640培養基中培養,置于37 ℃、5% CO2培養箱培養;細胞每2 d換液,約5~6 d(細胞80%融合后)按1∶4傳代,每天觀察記錄掌握細胞基本生長規律。SP600125溶于DMSO中(25 mmol/L),分裝備用。部分細胞凍存,備以下實驗用。
2.2細胞內JNK/SAPK蛋白磷酸化水平檢測
2.2.1Western blotting 各組細胞按每孔3×106個細胞種于6孔板中,細胞貼壁后予無血清RPMI-1640培養基換液。24 h后,一部分細胞予同樣無血清培養基換液,另一部分細胞予含25 μmol/L SP600125的無血清培養基更換,全部細胞再于培養箱中孵育30 min,即用蛋白提取試劑盒提取細胞總蛋白,BCA法蛋白定量,12% SDS-PAGE行3組細胞PSMA和磷酸化JNK蛋白分離,轉于PVDF膜上,封閉后,孵PSMA(1∶1 000)Ⅰ抗、p-JNK(1∶1 500)Ⅰ抗和GAPDH (1∶10 000)過夜,次日孵HRP標記Ⅱ抗(1∶1 000)1 h,暗室中加入發光液,其中PSMA使用超敏ECL發光液;p-JNK使用ECL發光液。黑白膠片曝光。
2.2.2細胞免疫化學 每組細胞按照每孔5×104個細胞接種于24孔板中培養1 d。予無血清RPMI-1640培養基換液孵育24 h,再使用一般培養基及含SP600125的培養基,外環境處理同Western blotting,多聚甲醛固定后滴入非免疫山羊血清封閉。滴入1∶1 000稀釋兔抗人p-JNK單克隆抗體100 μL;將該24孔板放入自制保濕盒中,4 ℃過夜。次日洗滌后滴入生物素標記羊抗兔IgG 1 滴/孔,室溫孵育20 min,洗滌。滴入辣根酶標記鏈酶卵白素工作液后,加入DAB液,洗脫后滴入蘇木素Mayor染核。鏡下觀察及統計分析:鏡下觀察各組細胞的染色情況,每孔隨機選取5個高倍視野(10×20)。確定細胞陽/陰性染色較為主觀,因此選取一個較為淺染的細胞為標準細胞,濃于標準細胞為陽性細胞,淺于標準細胞為陰性細胞,并對3組細胞p-JNK的表達進行統計學分析(SPSS 17.0軟件)。
2.3各組細胞增殖、細胞周期、凋亡的檢測
2.3.1CCK-8法檢測細胞的增殖 取各組細胞,消化分離后分別用含10%FBS的RPMI-1640培養基和加入含25 μmol/L SP600125的上述培養基重懸離心細胞后,通過細胞計數板人工計數,以2 000 cells/well接種于96孔板,每孔體積100 μL,每組設3個復孔,每2 d予相應的培養基換液1次(分別使用一般RPMI-1640培養基及含有SP600125的RPMI-1640培養基)。到檢測時點時取出需檢測的培養板,往培養孔中每孔加入CCK-8 試劑10 μL,后培養2 h,在酶標儀上測各組細胞的A450值,分別測24 h、48 h、72 h、96 h、120 h、144 h和168 h 7個時點,復孔檢測結果取均值并繪制生長曲線。
2.3.2流式細胞儀檢測細胞周期 各組細胞實驗前分別使用含10% FBS的RPMI-1640培養基及含SP600125的上述培養基培養48 h。消化、重懸后移入流式管,加入2 mL 于-20 ℃預冷的70%乙醇,密封后置于4 ℃冰箱過夜。次日送入流式細胞儀室對各組細胞S期、G0-G1期、G2-M期的百分比作檢測。
2.3.3流式細胞儀檢測細胞凋亡 將各組細胞制作細胞懸液(5×105個細胞),具體方法同上,后加入1.25 μL Annexin V-FITC,室溫(18~24 ℃)避光反應15 min后離心去上清。0.5 mL預冷的1×結合緩沖液輕輕重懸后加入10 μL 溴化丙啶(propidium iodide,PI),冰上避光保存,流式細胞術檢測分析。
3 統計學處理
計量資料用均數±標準差(mean±SD)表示,并采用單因素方差分析或者Kruskal-Wallis檢驗;計數資料采用Pearson2檢驗。統計分析軟件使用SPSS 17.0。以P<0.05為差異有統計學意義。
結 果
1 JNK/SAPK蛋白磷酸化水平檢測結果
1.1Western blotting 如圖1所示,在PSMA高表達時,p-JNK/SAPK高表達;在PSMA低表達時,p-JNK/SAPK低表達,與空白對照組相比,均存在明顯的統計學差異。而在加入SP600125的培養基中,各組細胞中p-JNK/SAPK表達沒有顯著差異,但較常規培養組低。
1.2細胞免疫化學 圖2為用免疫細胞化學的方法觀察各組細胞p-JNK/SAPK的表達情況。對陽/陰性細胞的計數和統計表明,在RPMI-1640培養基中,shPSMA組的p-JNK/SAPK表達明顯低于control組(P<0.05),而pcDNA-PSMA組的p-JNK/SAPK表達明顯高于control組(P<0.05);在含有SP600125的培養基中,3組細胞p-JNK/SAPK的表達接近,無明顯差異,見圖2。

Figure 1. The expression of PSMA, JNK and p-JNK in different groups tested by Western blotting.Lane 1: shPSMA+SP600125; Lane 2: pcDNA-PSMA+SP600125; Lane 3: control+SP600125; Lane 4: shPSMA; Lane 5: pcDNA-PSMA; Lane 6: control group. Mean±SD. n=3.*P<0.05, **P<0.01 vs control group.
2 細胞增殖、周期、凋亡的檢測結果
2.1細胞生長曲線 在RPMI-1640培養基中,shPSMA組的增殖能力明顯較control組低(P<0.05),而pcDNA-PSMA組較control組高(P<0.05),并在120 h后有顯著差異;在含有SP600125的培養基中,3組細胞增殖能力均處于低水平,但在144 h后比在RPMI-1640培養基中的shPSMA組水平更低,見圖3。
2.2流式細胞術檢測細胞周期結果 在RPMI-1640培養基中,shPSMA組、pcDNA-PSMA組和control組處于S期細胞的百分比是29.58%、42.36%和36.10%;在含有SP600125的培養基中,shPSMA組、pcDNA-PSMA表達組和control組處于S期細胞的百分比是27.51%、29.21%和28.82%。在一般RPMI-1640培養基中,shPSMA組S期細胞的百分比明顯低于control組,而pcDNA-PSMA組則高于control組;而在含SP600125培養基中,3組處于S期細胞的百分比均在較低水平,3組間無明顯差異,見圖4。

Figure 2. The expression of p-JNK/SAPK in different groups tested by immunocytochemistry (×400).Mean±SD.n=3.*P<0.05, **P<0.05 vs control group.
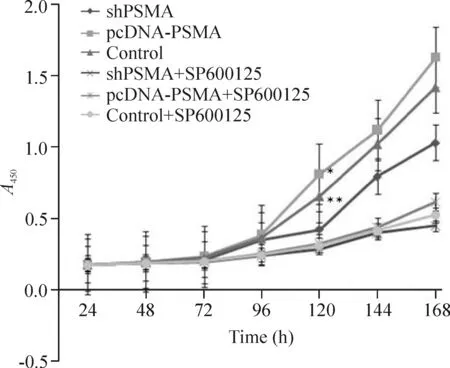
Figure 3. Cell growth curve of each group. Mean±SD.n=3.*P<0.05, **P<0.01 vs control group.

Figure 4. The percentage of cells in S phase detected by flow cytometry. Mean±SD.n=3.*P<0.05, **P<0.05 vs control group.
2.3流式細胞術檢測細胞凋亡的結果 如圖5所示,常規培養條件下,shPSMA組、pcDNA-PSMA組和control組中凋亡率分別為9.6%、3.4%和4.7%;在加入SP600125時,各組的凋亡率分別為7.7%、2.1%和3.5%。在shPSMA組中,前列腺癌細胞的凋亡率明顯高于control組,這與是否加入JNK抑制劑SP600125無關;而在pcDNA-PSMA表達組,細胞凋亡率明顯低于control組;加入JNK抑制劑SP600125后,細胞凋亡率均低于常規培養組,但是PSMA對凋亡的調控趨勢未改變。因此,PSMA可以抑制前列腺癌細胞的凋亡,JNK通路是其一條重要的通路,但是并不是唯一的通路,應該還存在其它的信號通路對細胞的凋亡進行調控。

Figure 5. Apoptotic rate of each group tested by flow cytometry.Mean±SD.n=3.*P<0.05, **P<0.01 vs control group.
討 論
PSMA是基因位于染色體11p11~12的橫跨細胞膜的Ⅱ型糖蛋白[7-8]。它是一種高特異性的前列腺癌瘤標,和腫瘤惡性程度相關。在正常的前列腺細胞中,PSMA少量表達于基底細胞[9],在前列腺癌細胞中廣泛表達,在轉移性的雄激素非依賴性前列腺癌中有更高表達[10-11]。此外,PSMA在去勢治療后表達上調[12]。我們前期的研究也表明PSMA在前列腺癌的發生、發展中其重要作用,可以促進前列腺癌細胞的增殖、侵潤能力,抑制凋亡發生[13],但是關于PSMA對前列腺癌細胞調控的具體機制和細胞信號通路目前還不清楚,因此我們進行了后續的研究。
JNK是絲裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)家族重要成員之一,由于它可以調控細胞內的應激反應,因此也被稱為應激激活蛋白激酶。JNK信號通路能介導多種胞外刺激誘導的細胞凋亡,參與了包括前列腺癌細胞在內的多種細胞的凋亡發生,在調控細胞凋亡中發揮著重要作用。JNK 位于胞漿,由3 個基因編碼,它們分別是:JNK1、JNK2 和JNK3。JNK1 和JNK2 基因在全身廣泛表達,而JNK3 則是呈限制性表達。這3種基因都能編碼產生46 kD和55 kD 的蛋白產物,因為3種基因的不同分布,執行的細胞功能也各有差異[14]。目前認為,JNK 促進細胞凋亡的機制主要有2點:(1)上調促凋亡蛋白的表達:JNK 通過使轉錄因子復合物AP-1 活性增強進一步促進p53、Bax、FasL、TNF 等促凋亡蛋白的表達;(2)作用于線粒體:如Bax、Bak 等促使細胞色素C釋放進入胞漿,細胞色素C和caspase-9結合,最終作用于caspase-3,激活的caspase-3與凋亡底物結合引起細胞凋亡。
PSMA是位于前列腺細胞中的一種跨膜糖蛋白,而JNK是MAPK通路中最重要的信號分子,兩者都與前列腺癌的進展相關。我們早期的研究提示,在前列腺癌細胞中,抑制PSMA表達后,前列腺癌細胞增殖、侵襲、凋亡等均受到影響[13, 15-16],對于其具體的機制我們進行了初步探討,并證明PSMA可以對p38/MAPK通路進行調控,作為前列腺癌細胞中對p38通路調控的一個新的靶點[17]。同時,PSMA還可以對ERK通路進行調控,ERK通路同樣參與了PSMA對前列腺癌細胞生物學影響的過程[18]。那么作為MAPK通路中另一個重要的通路JNK是否也受到PSMA的影響?為了確定PSMA和JNK磷酸化是否存在關聯,以及是否對前列腺癌細胞起作用,我們設立了抑制PSMA表達的LNCaP組,增強PSMA表達組及空白組。3組分別在一般培養基和存在JNK通路抑制劑SP600125的培養基中孵育。通過檢測3組細胞在2種培養條件下的JNK/SAPK通路及細胞增殖、細胞周期、凋亡等情況來驗證PSMA對JNK/SAPK通路的調控及是否通過JNK/SAPK通路對前列腺癌細胞的凋亡產生調控。
與其它2組相比,抑制PSMA蛋白表達后,p-JNK/SAPK水平下降;增強PSMA表達后,p-JNK/SAPK水平升高;而在SP600125的作用下,3組JNK磷酸化水平均下降。細胞免疫組化結果也證明兩者之間的關系。這個結果表明PSMA參與了p-JNK/SAPK通路的激活。此外,我們檢測了3組細胞在有無JNK抑制劑情況下的增殖、細胞周期、凋亡情況。通過LNCaP細胞生長曲線表明,抑制PSMA組的生長增殖能力明顯低于空白對照組,而增強PSMA表達組則高于空白對照組;但在使用SP600125培養基組中3組生長曲線相近,而且明顯低于一般培養基組。通過流式細胞術評估各組細胞周期變化情況顯示,在常規培養條件下,抑制PSMA表達后細胞S期百分比少于空白對照組;增強PSMA表達后則高于空白對照組;在SP600125培養基條件下,3組的S期百分比幾乎相同。這個細胞周期檢測的結果顯示PSMA通過激活JNK通路來調控前列腺癌細胞周期。關于凋亡的檢測顯示在抑制PSMA表達組中,前列腺癌細胞的凋亡率明顯高于增強PSMA表達組和空白對照組,這與是否加入JNK抑制劑SP600125無關;而在增強PSMA表達組,細胞凋亡率明顯低于空白對照組;加入JNK抑制劑SP600125后,細胞凋亡率均低于常規培養組,但是PSMA對凋亡的調控趨勢未改變。因此,結合我們前期的研究結果可以推斷PSMA可以抑制前列腺癌細胞的凋亡,JNK通路是其中一條重要的通路,但是并不是唯一的通路,應該還存在其它的信號通路對細胞凋亡進行調控,比如ERK、p38、Akt等[19]。而這些通路之間的相互作用關系還不清楚,我們后期的研究將進一步進行該方面的深入研究,以闡明PSMA下游的信號通路網。
[參 考 文 獻]
[1] Rajasekaran AK, Anilkumar G, Christiansen JJ. Is prostate-specific membrane antigen a multifunctional protein?[J]. Am J Physiol Cell Physiol,2005,288(5):C975-C981.
[2] O’Keefe DS, Bacich DJ, Heston WD. Comparative analysis of prostate-specific membrane antigen (PSMA) versus a prostate-specific membrane antigen-like gene[J]. Prostate,2004,58(2):200-210.
[3] Yan KH, Yao CJ, Hsiao CH, et al. Mefloquine exerts anticancer activity in prostate cancer cells via ROS-mediated modulation of Akt, ERK, JNK and AMPK signaling[J]. Oncol Lett,2013,5(5):1541-1545.
[4] 郭正輝,黃 海,杜 濤,等. 靶向于前列腺癌特異性膜抗原shRNA的篩選與鑒定[J]. 中華實驗外科雜志,2008,25(9):1190-1192.
[5] 黃 海,黃 健,潘秋輝,等. 中國人前列腺特異性膜抗原基因的克隆及鑒定[J]. 中山大學學報:醫學科學版,2005,26(1):84-87.
[6] 黃 海,黃 健,林天歆,等. 人前列腺特異性膜抗原cDNA的克隆、原核表達、鑒定和抗原初步純化[J]. 中華泌尿外科雜志,2004,25(8):533-536.
[7] Israeli RS, Powell CT, Fair WR, et al. Molecular cloning of a complementary DNA encoding a prostate-specific membrane antigen[J]. Cancer Res,1993,53(2):227-230.
[8] O’Keefe DS, Su SL, Bacich DJ, et al. Mapping, genomic organization and promoter analysis of the human prostate-specific membrane antigen gene[J]. Biochim Biophys Acta,1998,1443(1-2):113-127.
[9] Kawakami M, Nakayama J. Enhanced expression of prostate-specific membrane antigen gene in prostate cancer as revealed byinsituhybridization[J]. Cancer Res,1997,57(12):2321-2324.
[10] Mhawech-Fauceglia P, Zhang S, Terracciano L, et al. Prostate-specific membrane antigen (PSMA) protein expression in normal and neoplastic tissues and its sensitivity and specificity in prostate adenocarcinoma: an immunohistochemical study using mutiple tumour tissue microarray technique[J]. Histopathology,2007,50(4):472-483.
[11] Wright GJ, Grob BM, Haley C, et al. Upregulation of prostate-specific membrane antigen after androgen-deprivation therapy[J]. Urology,1996,48(2):326-334.
[12] Hughes C, Murphy A, Martin C, et al. Molecular pathology of prostate cancer[J]. J Clin Pathol,2005,58(7):673-684.
[13] Guo Z, Huang H, Zeng L, et al. Lentivirus-mediated RNAi knockdown of prostate-specific membrane antigen suppresses growth, reduces migration ability and the invasiveness of prostate cancer cells[J]. Med Oncol,2011,28(3):878-887.
[14] Tang YQ, Jaganath I, Manikam R, et al. Phyllanthus suppresses prostate cancer cell, PC-3, proliferation and induces apoptosis through multiple signalling pathways (MAPKs, PI3K/Akt, NFκB, and hypoxia)[J]. Evid Based Complement Alternat Med,2013,2013:609581.
[15] 黃 海,黃 健,林天歆,等. 前列腺癌噬菌體抗體庫的構建及抗特異性膜抗原抗體的篩選[J]. 中華泌尿外科雜志,2007,28(9):609-613.
[16] 黃 海,黃 健,林天歆,等. 前列腺特異性膜抗原人源Fab抗體可變區基因的篩選與鑒定[J]. 中華男科學雜志,2007,13(7):601-604.
[17] Zhang Y, Guo Z, Du T, et al. Prostate specific membrane antigen (PSMA): a novel modulator of p38 for proliferation, migration, and survival in prostate cancer cells[J]. Prostate,2013,73(8):835-841.
[18] 郭正輝,黃 海,杜 濤,等. PSMA對LNCaP細胞生長、遷移及ERK蛋白活性的影響[J]. 中國病理生理雜志,2011,27(6):1090-1096.
[19] Hour MJ, Tsai SC, Wu HC, et al. Antitumor effects of the novel quinazolinone MJ-33: inhibition of metastasis through the MAPK, AKT, NF-κB and AP-1 signaling pathways in DU145 human prostate cancer cells[J]. Int J Oncol,2012,41(4):1513-1519.

