胞外高濃度ATP誘導SH-SY5Y細胞的自噬和凋亡*
盧 娜, 白瑞櫻, 魏林郁, 李超堃, 李新娟, 趙紅崗, 李東亮
(新鄉醫學院基礎醫學院生理學與神經生物學教研室,河南 新鄉 453003)
腺苷三磷酸(adenosine triphosphate,ATP)不僅是體內儲能供能物質,還是細胞間傳遞信息的重要活性分子,中樞神經系統(central nervous system,CNS)神經細胞釋放的ATP作為遞質,對神經功能的作用越來越受到關注[1]。生理條件下胞外ATP濃度在μmol/L水平,它通過核苷轉運形式釋放至突觸間隙,可選擇性地作用于相應嘌呤受體發揮遞質調節、突觸修飾和神經營養等作用。而當CNS遭受各類應激,如缺氧缺血、炎癥損傷后,受損細胞釋放大量ATP,胞外達到mmol/L的高水平,可引起神經元繼發性死亡[2]。因此,研究ATP對神經元毒性作用的特點及規律,揭示神經元死亡方式,有可能為腦損傷和腦卒中的防治策略提供新思路。人神經母細胞瘤細胞(SH-SY5Y細胞)來自于神經發育過程中的神經嵴,表現出與神經元相似的生化、藥理和功能方面的特性,提供了一個可以用來研究神經元功能、分化及死亡的良好體外模型。本實驗以SH-SY5Y細胞為對象,觀察ATP誘導的細胞凋亡和自噬,以及兩者的時間順序特點。
材 料 和 方 法
1 材料
人神經母細胞瘤SH-SY5Y細胞株由上海中科院典型細胞培養庫提供;DMEM培養液、新生牛血清購于HyClone;細胞增殖與毒性檢測試劑盒(Cell Counting Kit-8,CCK-8)購于廣州晶欣生物科技有限公司;annexin V-FITC細胞凋亡檢測試劑盒、單丹磺酰戊二胺(monodansylcadaverine,MDC)、細胞凋亡與壞死檢測試劑盒、鼠抗β-actin多克隆抗體及兔抗caspase-3單克隆抗體均購自碧云天生物技術有限公司;鼠抗微管相關蛋白1輕鏈3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ, LC3-Ⅱ)單克隆抗體購自Abgent;FITC標記驢抗鼠IgG(H+L)購自Laboratories;蛋白marker購自Fermentas。
2 主要方法
2.1SH-SY5Y細胞培養 細胞置于含體積分數為10%胎牛血清的DMEM中,在37 ℃、5% CO2的飽和水汽培養箱中培養,每隔48 h換培養液,當單層細胞融合后,行傳代處理。傳代后隨機分為對照組和ATP作用1 h、3 h、6 h組,ATP各組培養液均更換為終濃度含6 mmol/L ATP 的培養液,放入培養箱中繼續培養。每次每組設5 個平行復孔,實驗重復3 次。
2.2CCK-8比色法檢測細胞存活率 取對數生長期細胞,調整細胞密度,以5×107/L接種于96孔板,每孔細胞懸液100 μL。在37 ℃、5%CO2的飽和水汽培養箱中培養24 h,棄去培養液,分別置換成終濃度含3、6、9、12和15 mmol/L ATP 的培養液。ATP 作用3 h后,每孔加10 μL CCK-8溶液,避光孵育2 h,酶標儀在波長450 nm 處讀取吸光度(absorbance,A),用5孔A值的均數計算存活率。將對照組的A值表示為ACon,ATP 各組樣本的A值表示為AATP,存活率按下式計算: 存活率(%)=AATP/ACon×100%。本實驗對照組的細胞存活率定為100.0%。
2.3MDC染色檢測自噬空泡 MDC是一種自噬空泡的標志物, 可以通過MDC染色觀察判斷細胞自噬過程的發生[3]。采用Biederbick 等[4]實驗方法,各組細胞爬片處理后,去培養基,用PBS 洗2 遍;然后加入0.05 mmol/L的MDC染色液,37 ℃孵育60 min;吸去染料后用4 ℃、4% 多聚甲醛固定5 min,PBS 洗2 次;晾干后立刻用熒光顯微鏡觀察,激發波長365 nm,阻斷波長430 nm;在200倍視野下,隨即取5個視野,用ImageJ軟件分析熒光強度值,代表細胞自噬表達的相對水平。重復3 次,計算平均值。
2.4Hoechst染色凋亡細胞 取對數生長期細胞,調整細胞密度,以5×107/L接種于24孔板,每個孔細胞懸液500 μL;培養24 h后,置換成終濃度含6 mmol/L ATP 的培養液;ATP 作用1 h、2 h、3 h、6 h后棄培養液,每孔加1 mL細胞染色緩沖液和5 μL Hoechst 33258,冰浴染色30 min;PBS洗滌1次,立即在熒光顯微鏡下觀察。在200倍視野下,隨機取100個細胞,計數呈現強藍光的凋亡細胞,并計算凋亡比率= 呈現強藍光的細胞/100 個細胞,重復3 次,計算平均值。
2.5流式細胞術檢測細胞凋亡率 取對數生長期SH-SY5Y細胞,經消化制成細胞懸液, 以5×106細胞數接種于培養瓶中, 細胞貼壁后加入ATP,終濃度為6 mmol/L,分別在1 h、2 h、3 h、6 h后, PBS洗2遍,收集細胞,棄上清,分別加入1 mg/L PI和anne-xin V-FITC, 37 ℃孵育15 min,PBS洗2遍,流式細胞術檢測細胞凋亡率。
2.6Western blotting法檢測caspase-3和LC3-2表達 收獲細胞,4 ℃預冷的PBS洗1次,加入適量的細胞裂解液,用細胞刮子刮下細胞,低溫離心機12 000 ×g離心10 min,取上清液,棄沉淀。用BCA法測定各組蛋白含量,每孔上樣25 μL蛋白,經15% SDS-PAGE 80 V電泳2 h后,300 mA恒流轉膜40 min,5% 脫脂牛奶常溫下封閉1 h后,在4 ℃孵育Ⅰ抗(兔抗人caspase-3滴度為1∶1 000、小鼠抗人LC3-Ⅱ滴度均為1∶2 000、小鼠抗人β-actin滴度均為1∶3 000);5%脫脂牛奶常溫下封閉Ⅱ抗(羊抗兔辣根過氧化物酶IgG 和羊抗小鼠辣根過氧化物酶IgG 滴度均為1∶5 000,5% 脫脂牛奶配制),ECL 顯影顯示目的條帶和內參,用SIGMA Photo Pro 5.0軟件分析光密度值,代表蛋白表達的相對水平。
3 統計學處理
用SPSS 11.0統計軟件分析。數據用均數±標準差(mean±SD)表示,多組間比較采用單因素方差分析(ANOVA),組間兩兩比較采用最小顯著性差異法(LSD法)。以P<0.05 為差異有統計學意義。
結 果
1 不同濃度 ATP作用3 h對SH-SY5Y細胞形態的影響
倒置相差光學顯微鏡下觀察SH-SY5Y細胞形態的變化,正常SH-SY5Y 細胞大部分呈梭形、三角形,少數呈多邊形,胞漿內有大量顆粒,多數可見細胞突起,折光性好,貼壁能力強; 隨著ATP作用濃度增加,細胞貼壁數量逐漸減少,細胞形態逐漸變為圓形,體積皺縮,突起減少或消失,折光性逐漸減弱;脫壁的細胞增加,表明ATP對SH-SY5Y 細胞損傷作用有濃度依賴性,見圖1。

Figure 1. Effect of different concentrations of ATP on the morphology of SH-SY5Y cells (×200). A: 0 mmol/L; B: 3 mmol/L; C: 6 mmol/L; D: 9 mmol/L; E: 12 mmol/L; F: 15 mmol/L.
2 不同濃度 ATP作用3 h對SH-SY5Y細胞存活率的影響
CCK-8法檢測結果以空白對照組細胞存活率為100.0%,則3、6、9、12和15 mmol/L ATP組存活率分別為72.6%、55.8%、40.3%、20.8%和8.1%,與對照組比較差異均有統計學意義(P<0.05),隨胞外ATP濃度增高,細胞存活率逐漸降低,呈劑量依賴性,見表1。

表1 不同濃度ATP對SH-SY5Y 細胞存活率的影響
3 ATP(6 mmol/L)對SH-SY5Y 細胞存活率的影響
CCK-8法檢測結果顯示,6 mmol/L ATP作用1 h、2 h、3 h和6 h,SH-SY5Y 細胞存活率分別為對照組的69.4%、62.3%、54.7%和53.1%,差異均有統計學意義(P<0.05);隨著ATP作用時間的延長,細胞存活率呈時間依賴性逐漸降低,3 h達高峰,3 h和6 h組之間差異無統計學意義(P>0.05),見表2。
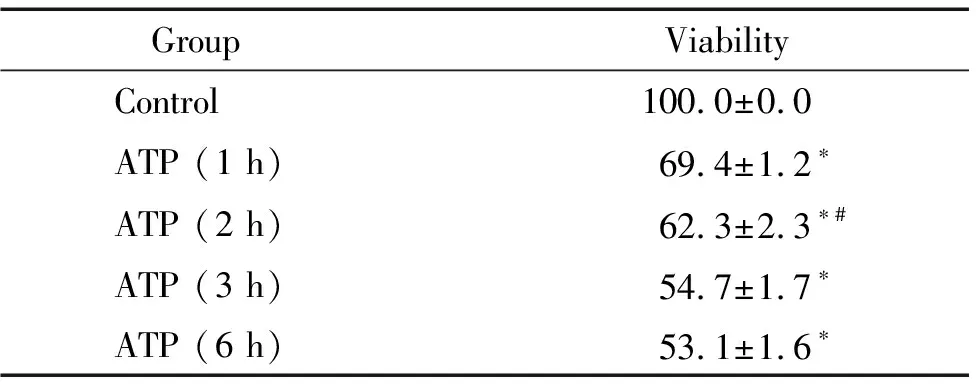
表2 ATP作用不同時間對SH-SY5Y細胞存活率的影響
4 MDC染色檢測細胞自噬空泡
MDC染色結果表明,與正常對照組相比, 6 mmol/L ATP作用1 h,細胞內MDC點狀熒光信號明顯增強,提示細胞出現大量自噬空泡;而2 h、3 h和6 h后MDC熒光信號逐漸減弱,提示細胞內自噬泡減少,見圖2。

Figure 2. Effect of ATP (6 mmol/L) treatment for different time on the formation of autophagic vacuoles (MDC staining,×400).Mean±SD.n=5.*P<0.05 vs control group; ##P<0.05 vs 1 h group.
5 熒光染色檢測細胞凋亡率
Hoechst染色結果表明,正常對照組細胞染色質均勻,發出均勻淺藍色熒光,核呈正常結構; 6 mmol/L ATP作用后,大量細胞染色質固縮,胞核致密深染,胞內可見亮藍色熒光。3 h凋亡率達高峰,見圖3。
6 流式細胞術檢測細胞凋亡率
與正常對照組相比,6 mmol/L ATP作用后,早期凋亡率明顯增加,并呈時間依賴性,3 h凋亡率達高峰。ATP作用1 h、2 h、3 h和6 h后凋亡率分別為(12.33±0.43)%、(30.27±0.24)%、(41.65±0.36)% 和(40.71±0.29)%,見圖4。
7 Western blotting法檢測 caspase-3和LC3-Ⅱ蛋白表達的變化
蛋白質印跡結果顯示,與正常對照組比較,6 mmol/L ATP作用后,各組cleaved caspase-3蛋白表達量均增加(P<0.05),6 h達高峰;LC3-Ⅱ蛋白表達量在作用1 h、2 h和3 h明顯增加(P<0.05),1 h表達量最高,然后隨時間延長而逐漸降低,見圖5。

Figure 3. Effect of ATP (6 mmol/L) treatment for different time on the changes of apoptotic rates of SH-SY5Y cells (Hoechst 33342 staining,×200). The arrows indicate the apoptotic cells with sapphirine color. Mean±SD.n=5.*P<0.05 vs control group; #P<0.05 vs 3 h group.
討 論
自噬(autophagy)是細胞利用溶酶體降解自身受損細胞器和大分子物質的過程,是真核細胞特有的生命現象[5], 這一過程在細胞清除廢物、重建結構、生長發育、維持內環境穩定中起重要作用[6];并參與了如腦損傷、神經退行性改變、精神分裂癥等多種疾病的發病過程[7]。細胞在受到外界因素刺激,如饑餓、缺氧、高溫,或在細胞內部應激等多種情況下,均可誘導自噬的發生[8]。LC3是目前觀察自噬現象是否存在、研究自噬活性較為可靠的生物學標志物,它哺乳動物細胞中酵母ATG8(Aut7/Apg8)基因的同源物,定位于前自噬泡和自噬泡膜表面,參與自噬體的形成。LC3 有Ⅰ型和Ⅱ型之分,未發生自噬時,細胞內合成的LC3 經過加工,成為胞質可溶性的LC3-Ⅰ,常規表達。當自體吞噬發生時,LC3-Ⅰ經泛素樣加工修飾過程,與自噬膜表面的磷脂酰乙醇胺結合,形成LC3-Ⅱ。LC3-Ⅱ結合并始終位于胞內自噬體的膜上,其含量的多少與自噬泡數量的多少成正比。因此LC3-Ⅱ表達強度與自噬活性密切相關[9]。目前,大多數研究證實自噬具有腦保護作用,當神經元遭遇應激時,自噬最先被激活,當自噬不能維持神經元穩態后,細胞再繼發凋亡,最后進入壞死;且自噬與凋亡可同時存在于神經元[10],推測自噬在腦損傷后可能發揮清除受損細胞及降低正常細胞損害的作用。

Figure 4. ATP (6 mmol/L) induced apoptosis of SH-SY5Y cells detected by flow cytometry with annexin V-FITC/PI staining.Mean±SD.n=5.*P<0.05 vs control group; #P<0.05 vs 3 h group.

Figure 5. Effect of ATP (6 mmol/L) treatment for different time on the protein expression of cleaved caspase-3 and LC3-Ⅱ in SH-SY5Y cells. Mean±SD.n=5. *P<0.05 vs control group; #P<0.05 vs 6 h group; △P<0.05 vs 1 h group.
凋亡是由基因控制的細胞主動死亡的一種過程。Caspase是一大類凋亡調控基因,對神經元的凋亡起著非常關鍵的作用,而caspase-3被稱為死亡蛋白酶,是caspase家族中最重要的細胞凋亡執行者之一[11]。 Caspase-3正常狀態下以酶原(32 kD)的形式存在于胞漿中,在凋亡的早期階段,它被激活,活化的caspase-3由2個大亞基(17 kD)和2個小亞基(12 kD)組成,裂解相應的胞漿胞核底物,最終導致細胞凋亡。很多學者將活化的caspase-3作為指標來檢測凋亡[12]。腦組織缺血、缺氧后,神經細胞內能量代謝障礙,大量氧自由基的產生、興奮性氨基酸的蓄積和釋放及內質網應激等均可誘導自噬的發生。自噬發揮著雙刃劍的作用。一方面,自噬的過度激活可能介導細胞程序性死亡[13],另一方面,自噬的啟動可能有助于維持神經元穩態,減少繼發損傷,清除已經被損傷的細胞器而保護神經元[14]。那么SH-SY5Y細胞在ATP的損傷下,自噬能否被激活?和凋亡有何關系?
本研究CCK-8結果表明, 隨胞外ATP濃度增高,細胞存活率逐漸降低,呈劑量依賴性(表1);同時隨胞外6 mmol/L ATP作用時間延長,細胞存活率逐漸降低,呈時間依賴性,3 h達高峰(表2)。這提示ATP損傷過程中細胞的增殖過程受到影響。通過Hoechst染色及流式細胞術檢測細胞凋亡率均顯示, 與正常對照組相比, 應用6 mmol/L ATP作用后,細胞凋亡率增加(P<0.05),并呈時間依賴性,3 h凋亡率達高峰(圖3、4),表明ATP作用SH-SY5Y細胞啟動了凋亡程序。同時我們檢測了ATP在作用SH-SY5Y細胞時自噬的變化, 熒光顯微鏡MDC染色結果表明, ATP能夠引起SH-SY5Y細胞發生自噬并且在1 h時就可以觀察到自噬空泡明顯增多(P<0.05), 而2 h、3 h和6 h后MDC熒光信號逐漸減弱,細胞內自噬泡減少(圖2),提示自噬對細胞損傷結構的清理修復作用在進行;而細胞凋亡則在3 h達高峰,表明ATP誘導的SH-SY5Y細胞損傷中自噬增強發生在凋亡高潮之前。
我們進一步通過Western blotting對凋亡相關蛋白caspase-3及自噬特異性蛋白LC3-Ⅱ的表達進行檢測, 發現與正常對照組相比,cleaved caspase-3蛋白表達量隨時間逐漸增高,6 h達高峰;同時發現LC3-Ⅱ蛋白表達量在1 h達最高值,而后隨時間延長而逐漸降低(圖5),與相關研究結果基本相符[15]。說明ATP同時激活SH-SY5Y細胞發生自噬和凋亡,自噬增強在前,凋亡高潮在后。有研究表明,自噬空泡的積聚出現在凋亡之前并且不被凋亡抑制劑所影響, 而自噬被抑制后, 細胞凋亡蛋白caspase-3活化水平顯著增加[16]。因此, 我們推測ATP損傷的早期, 很可能優先啟動細胞自噬機制,降解受損的細胞器等胞內物質, 以提供維持細胞生存的氨基酸和能量等, 來延緩細胞凋亡過程的發生,對細胞的存活起一定的保護作用[17], 但隨著ATP作用時間的延長, 凋亡逐漸占主導地位, 自噬失去其拮抗凋亡作用, 從而表現細胞死亡加速[10]。
綜上所述本研究提示,胞外高濃度ATP啟動SH-SY5Y細胞自噬和凋亡,自噬增強在前,凋亡高潮在后。研究ATP這種神經系統廣泛存在的膠質遞質(gliotransmitter)啟動和調控自噬與凋亡機制,或許能夠為應對神經元損傷提供新的策略。
[參 考 文 獻]
[1] Butt AM. ATP: a ubiquitous gliotransmitter integrating neuron-glial networks [J]. Semin Cell Dev Biol, 2011, 22(2):205-213.
[2] Skaper SD, Debetto P, Giusti P. The P2X7 purinergic receptor: from physiology to neurological disorders [J]. FASEB J, 2010, 24(2):337-345.
[3] Perry CN, Kyoi S, Hariharan N, et al. Novel methods for measuring cardiac autophagyinvivo[J]. Methods Enzymol, 2009, 453:325-342.
[4] Biederbick A, Kern HF, Els?sser HP. Monodansylcada-verine (MDC) is a specificinvivomarker for autophagic vacuoles[J]. Eur J Cell Biol, 1995, 66(1):3-14.
[5] Klionsky DJ, Emr SD. Autophagy as a regulated pathway of cellular degradation[J]. Science,2000, 290(5497):1717-1721.
[6] Zou W, Wang X,Vale R, et al. Autophagy genes promote apoptotic cell corpse clearance[J]. Autophagy, 2012, 8(8):1267-1268.
[7] Shpcilka T, Elazar Z. Shedding light on mammalian microautophagy[J]. Dev Cell, 2011, 20(1):1-2.
[8] Feng Y, He D, Yao Z, et al. The machinery of macroautophagy[J]. Cell Res, 2014, 24(1):24-41.
[9] Mizushima N. Methods for monitoring autophagy[J]. Int J Biochem Cell Biol,2004, 36(12): 2491-2502.
[10] Wang P, Guan YF, Du H, et al. Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyltransferase in cerebral ischemia [J]. Autophagy, 2012, 8(1):77-87.
[11] Jan CR, Su JA, Teng CC, et al. Mechanism of maprotiline-induced apoptosis: role of [Ca2+]i, ERK, JNK and caspase-3 signaling pathways[J]. Toxicology, 2013, 304:1-12.
[12] 周天恩, 張 萌, 楊正飛, 等. 亞低溫減輕氧糖剝奪所致的大鼠海馬神經元損傷[J]. 中國病理生理雜志, 2013, 29(7):1165-1170.
[13] Balduini W, Carloni S, Buonocore G. Autophagy in hypoxia-ischemia induced brain injury[J]. J Matern Fetal Neonatal Med, 2012, 25(Suppl 1):30-34.
[14] Zhao Y, Chen G, Zhang W, et al. Autophagy regulates hypoxia-induced osteoclastogenesis through the HIF-1α/BNIP3 signaling pathway[J]. J Cell Physiol, 2012, 227(2):639-648.
[15] Wei Q, Zhang Y, Sun L, et al. High dose of extracellular ATP switched autophagy to apoptosis in anchorage-depen-dent and anchorage-independent hepatoma cells[J]. Purinergic Signal,2013, 9(4):585-598.
[16] Fayaz SM, Suvanish Kumar VS, Rajanikant GK. Necroptosis: who knew there were so many interesting ways to die?[J]. CNS Neurol Disord Drug Targets, 2014, 13(1):42-51.
[17] Zeng R, He J, Peng J, et al. The time-dependent auto-phagy protects against apoptosis with possible involvement of Sirt1 protein in multiple myeloma under nutrient depletion[J]. Ann Hematol, 2012, 91(3):407-417.

