基于ITS序列的紫芝分子鑒定
蘇春麗,唐傳紅,張勁松*(1.成都醫學院公共衛生系,成都 610500;.上海市農業科學院食用菌研究所,上海 01403)
·論 著·
基于ITS序列的紫芝分子鑒定
蘇春麗1,2,唐傳紅2,張勁松2*
(1.成都醫學院公共衛生系,成都 610500;2.上海市農業科學院食用菌研究所,上海 201403)
目的 建立基于ITS序列的紫芝分子鑒定方法。 方法 分析20株靈芝屬菌株ITS序列,設計紫芝的特異性引物。 結果 用此引物對20株靈芝屬菌株的DNA進行擴增,只有2株紫芝菌株有目的擴增條帶。 結論 設計的特異性引物有很高的專屬性,能高度特異地鑒定紫芝菌株。
紫芝;ITS序列;分子鑒定
紫芝(Ganodermasinense)又稱黑芝、中國靈芝等,是中國特有的食藥用真菌之一。紫芝氣味甘、性溫、無毒,具有治耳聾、利關節、保神、益精氣、堅筋骨、好顏色以及久服輕身延年不老的作用。紫芝是《中國藥典》(2010年版)記載的兩種可藥用靈芝之一,也是衛生部發布的可用于保健食品的三種靈芝之一[1-5]。
隨著對紫芝生物學功效的不斷了解和認識,其市場需求也在不斷增加,紫芝原料的質量越來越受到重視。但是由于靈芝屬菌株種類多,傳統鑒定主要依據形態學特征來進行,容易出現混淆。
ITS是rDNA的內轉錄間隔區,不加入成熟核糖體,受到的選擇壓力較小,進化速度較快,在絕大多數真核生物中有著極為廣泛的序列多態性;ITS序列長度適中,能從不太長的序列中獲得充分的信息;同時ITS區在核基因組中是中等重復的,由于協同進化,各重復單位高度相似或者一致,從而使得PCR產物可以直接測序;另外,ITS序列種內同源性非常高,在種間又有不同程度的變異。這些優點使得ITS序列成為理想的種間鑒定分子標記,并已廣泛應用于真菌的分子分類學、遺傳多樣性及菌株鑒定等方面的研究[6-8]。本文擬通過分析靈芝屬菌株ITS序列間的差異,設計紫芝的特異引物,建立紫芝的分子鑒定方法。
1 材料與方法
1.1 供試菌株
本研究共收集了靈芝(Ganodermalucidum)、密紋薄芝(Ganodermatenue)、紫芝(Ganodermasinense)、樹舌(Ganodermaapplanatum)、松杉樹芝(Ganodermatsugae)、近擬鹿角靈芝(Ganodermasubamboinense)、紫光靈芝(Ganodermaoerstedii)及無柄靈芝(Ganodermaresinaceum)等8個種共20株靈芝屬菌株(見表1)。
1.2 培養基
馬鈴薯液體培養基(每1 000 mL中馬鈴薯200 g,葡萄糖20 g)。
1.3 主要試劑和儀器
引物(Invitrogen合成)、Taq酶(promega)、DNA分子量標準(天為時代D2000)和PCR儀(effendorf)。
1.4 方法
1.4.1 菌絲培養和DNA提取方法 菌種經活化后接種于馬鈴薯液體培養基中,28 ℃振蕩(150 r/ min)培養10~15 d,收集菌絲,-20 ℃保存備用。DNA提取參照唐傳紅等[9]的方法進行,經0.8%瓊脂糖凝膠電泳檢測DNA質量,-20 ℃保存備用。
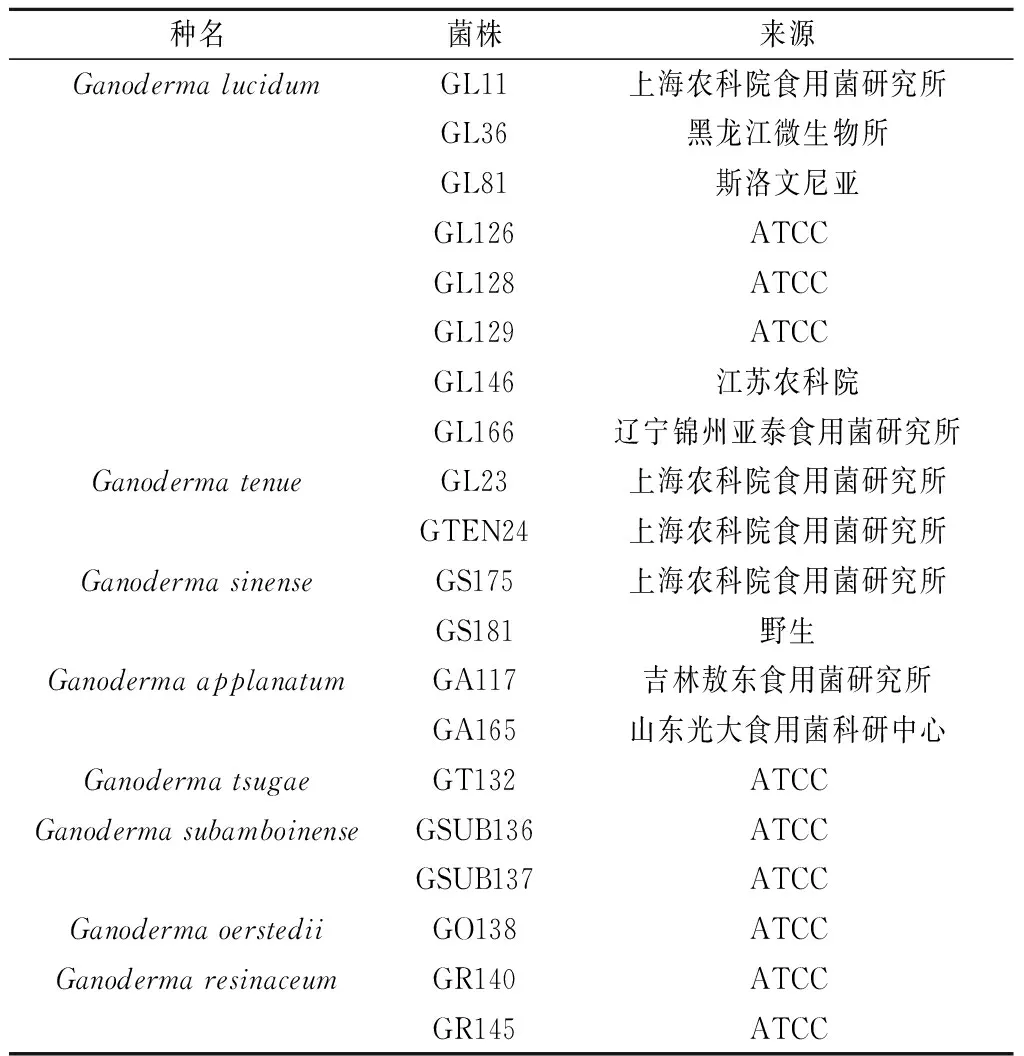
表1 供試菌株
ATCC:美國典型培養物保藏中心
1.4.2 ITS序列分析方法 根據Genbank中已有的靈芝屬菌株ITS序列信息,確定ITS1、ITS2和5.8S的序列范圍。依據常用的兼并堿基代碼將ITS序列中所含的雜合位點重新編碼,用DNAStar軟件將DNA序列轉換成FastA格式,再利用ClustalX 1.8軟件進行排列分析。
1.4.3 DNA模板的檢驗 用真菌ITS區通用引物ITS1F/ITS4對所有DNA模板進行擴增,驗證DNA的質量能否滿足PCR反應的要求。擴增反應體系(25 μL):10×PCR buffer 2.5 μL,MgCl2(25 mmol/L)2 μL,dNTP(10 mmol/L)0.5 μL,引物ITS1F/ITS4(10 μmol/L)各1 μL,Taq酶(5 U/μL)0.25 μL,DNA模板10 ng,用無菌雙蒸水補足。PCR擴增程序:94 ℃ 2 min;94 ℃ 15 s,62 ℃ 30 s,72 ℃ 1 min,共28個循環;72 ℃ 5 min。
1.4.4 紫芝特異性引物的設計及驗證 根據20個菌株ITS序列比對的結果,尋找紫芝的序列特異位點,設計紫芝的特異性引物,進而對所有菌株的DNA進行擴增,驗證引物的特異性。紫芝鑒定PCR的反應體系除引物為GS1/GS2外,其他與ITS區相同;PCR擴增程序中的退火溫度為65 ℃,其他與ITS區相同。
2 結果
2.1 基于ITS序列設計紫芝的特異性引物
對20株靈芝屬菌株的ITS序列進行比對分析[10,11],尋找紫芝ITS序列的特異位點,設計出紫芝的特異引物。引物名稱與序列分別是GS1: ACG GAC TGT GGA GCG GGC TCT G;GS2:GTC ATA AGC TTT GTC TCC ATA C。
2.2 DNA模板的檢驗
用真菌ITS區通用引物ITS1F/ITS4對所有DNA模板進行擴增,驗證DNA的質量能否滿足PCR反應的要求。結果顯示,所有菌株DNA均能擴增出清晰的目的條帶(見圖1),表明所用的DNA能滿足PCR反應的要求。

圖1 引物ITS1F/ITS4對20個靈芝屬菌株的PCR擴增產物的瓊脂糖凝膠電泳圖M:分子量標記;CK:陰性對照;代碼 1~20:GL11、GL23、GTEN24、GL36、GL81、GA117、GL126、GL128、GL129、GT132、GSUB136、GSUB137、GO138、GR140、GR145、GL146、GA165、GL166、GS175、GS181
2.3 紫芝的PCR鑒定
用設計出的紫芝特異性引物GS1/GS2對20個靈芝屬菌株進行PCR擴增,當退火溫度為62 ℃時,紫芝菌株GS175和GS181有清晰的目的擴增條帶,但11、12泳道的近似鹿角靈芝菌株GSUB136和GAUB137有較弱的大小約1 000 bp的非目的條帶,其他菌株均無擴增條帶。當退火溫度升至65 ℃時,紫芝菌株GS175和GS181有清晰的目的擴增條帶,而其他菌株均未出現擴增條帶(見圖2)。本文設計出紫芝的特異性引物,對20株靈芝屬菌株進行擴增,只有2株紫芝菌株有清晰的目的條帶,其他菌株在同等PCR條件下均無擴增產物出現。結果表明,本研究設計的特異性引物有很高的專屬性,能對紫芝菌株進行分子鑒定。

圖2 引物GS1/GS2對20個靈芝屬菌株PCR擴增產物的瓊脂糖凝膠電泳圖M:分子量標記;CK:陰性對照;圖中代碼同圖1
3 討論
傳統的紫芝等靈芝屬菌株的鑒定主要建立在形態學基礎之上,但子實體的很多形態學特征往往因生長條件的不同而發生改變,并且許多特征經常是幾個種所共有的,這給傳統的紫芝鑒定帶來了很大的困難。因此,建立起不受環境因素影響,快速可靠的紫芝鑒定方法,對保證紫芝原料的質量顯得非常迫切和必要。
分子生物學的發展,為研究者對紫芝進行分子鑒定提供了技術支持。分子鑒定以菌株的遺傳物質為基礎,不受環境因素的影響,因而鑒定結果更為可靠。rDNA的ITS序列是用于探討真菌種內變異和屬內種間分子系統關系的重要分子標記。前期研究[10]中發現,ITS序列在靈芝屬種內同源性非常高,但種間的同源性相對較低,說明ITS區的堿基變異為區分靈芝屬的不同種提供了充分的信息。為此,可以ITS為靶基因,建立快速鑒定紫芝菌株的特異性PCR法。
本研究通過對20株靈芝屬菌株ITS序列進行比對分析,設計出紫芝的特異性引物,并對20株菌株進行擴增,結果顯示,只有2株紫芝菌株有目的條帶,表明該方法能夠快速鑒定紫芝菌株。
研究結果表明,基于ITS序列的真菌分子鑒定技術具有準確性高、特異性好和樣品需求量少的特點,該方法易操作、成本低且實用性強。該鑒定技術為真菌的鑒定提供了新的思路和方法,可望為經濟真菌的開發利用提供有益幫助。
[1] 趙繼鼎,張小青.中國真菌志(第18卷,靈芝科)[M].北京:科學出版社,2000:1-204.
[2] 李時珍.本草綱目(第3冊,28卷)[M]. 北京:人民衛生出版社,1978:147-148,1708-1712.
[3] 中華人民共和國國家藥典委員會. 中國藥典[M].北京:中國醫藥科技出版社,2010:174.
[4] 林志彬.靈芝的現代研究[M]. 3版. 北京:科學出版社,2007:3-8.
[5] 張小青.靈芝分類淺釋及應用簡述[J].江蘇食用菌,1993,14(5):28-29.
[6] Samad Jamali, zia Banihashemi. Species-specific ITS primers for the identification ofpicoajuniperiandpicoalefebvreiand using nested-PCR for detection ofp.juniperiin planta[J]. Molecular Biology Reports, 2013, 40(10): 5701-5712.
[7] Chang SC, Macêdo DP, Souza-Motta CM,etal. Use of molecular markers to compareFusariumverticilloidespathogenic streins isolated from plants and humans[J]. Genetics and Molecular Research, 2013, 12(3): 2863-2875.
[8] Bakri Y, Arabi Ml, Jawhar M. Heterogeneity in the ITS of the ribosomal DNA ofPyrenophoragramineaisolates differing in xylanase and amylase production[J]. Mikrobiologiia, 2011, 80(4): 486-489.
[9] 唐傳紅,張勁松,陳明杰,等. 靈芝屬菌株遺傳多樣性的初步研究[J]. 南京農業大學學報,2005,28(2):133-136.
[10] 蘇春麗,唐傳紅,張勁松,等.基于rDNA ITS序列探討中國栽培靈芝菌株的親緣關系[J].微生物學報,2007,47(1):11-16.
[11] 唐傳紅,蘇春麗,張勁松,等. 基于rDNA ITS和beta-tubulin gene部分序列分析靈芝屬菌株的遺傳關系[J]. 食用菌學報,2012,19(3): 37-41.
Molecular Detection ofGanodermasinenseBased on Nuclear Ribosomal DNA ITS Sequence
SUChun-li1,2,TANGChuan-hong2,ZHANGJing-song2*
(1.DepartmentofPublicHealth,ChengduMedicalCollege,Chengdu610500,China; 2.InstituteofEdibleFungi,ShanghaiAcademyofAgriculturalSciences,Shanghai201403,China)
Objective To build a molecular detection method to identifyGanodermasinenseisolates. Methods Based on phylogenetic analysis of rDNA ITS sequences, A pair of specific primers were designed for identifying theGanodermasinenseby PCR. Results 20 isolates ofGanodermawere amplified by the primer pairs, only twoGanodermasinenseisolates had PCR amplification products. Conclusion It is demonstrated that the primer pairs have a high specificity, and can be used to specifically identifyGanodermasinenseisolates.
Ganodermasinense; ITS Sequences; Molecular Detection
上海市農委重點攻關項目(NO:農科攻字2002-1-4-3);成都醫學院學科建設項目(NO:CYXK2012010)
張勁松, E-mail:Zhangjs888@etang.com
http://www.cnki.net/kcms/detail/51.1705.R.20140410.1540.010.html
10.3969/j.issn.1674-2257.2014.02.004
R282.5
A

