利用鉛冶煉煙塵制備超細氧化鉛粉末
楊 勰 李宏煦 李 超 王 帥 王喻玥
(1.北京科技大學冶金與生態工程學院,北京 100083;2.稀貴金屬綠色回收與提取北京市重點實驗室,北京 100083;3.生態與循環冶金教育部重點實驗室,北京 100083)
·綜合利用·
利用鉛冶煉煙塵制備超細氧化鉛粉末
楊 勰1,2,3李宏煦1,2,3李 超1,2,3王 帥1,2,3王喻玥1
(1.北京科技大學冶金與生態工程學院,北京 100083;2.稀貴金屬綠色回收與提取北京市重點實驗室,北京 100083;3.生態與循環冶金教育部重點實驗室,北京 100083)
河南某底吹爐煉鉛煙塵Pb含量達44.99%,可作為生產高質量超微細氧化鉛粉末的重要資源。試驗采用硫酸化焙燒預處理—NaCl浸出酸浸渣—氧化鉛前驅體合成—氧化鉛粉末生成工藝對超微細氧化鉛粉末加工技術條件進行了研究。結果表明:試驗確定條件下硫酸化焙燒預處理—水浸工藝的Pb、Cd、As去除率分別達2.67%、96.98%、100.00%,初步實現了鉛與鎘、砷等雜質元素的分離;NaCl浸出酸浸渣工藝的鉛、鎘作業浸出率為97.89%和98.12%;氧化鉛前驅體合成工藝的鉛轉換率為97.88%;氧化鉛粉末生成工藝徹底改變了晶體的形貌,生成物具有短棒狀海綿疏松的微觀形貌,長度小于2 μm,氧化鉛含量達98.31%,屬優質超細氧化鉛粉末。因此,該工藝為鉛冶煉煙塵的回收和超細氧化鉛粉末的制造提供了一種新的思路。
鉛冶煉煙塵 硫酸化焙燒 NaCl溶液浸出 氧化鉛前驅體合成 超細氧化鉛粉末
據統計,2012年全世界產鉛量達1 056萬t,中國約占世界總產鉛量的43%,成為世界第一鉛生產和消費國[1-3]。富氧底吹煉鉛工藝是我國火法煉鉛的主要工藝之一,在高溫強化熔煉過程中,會有大量的鉛等金屬揮發,造成煙塵率較高,國內煉鉛企業為了減少資源流失、控制煙塵對環境的污染,通常將這些煙塵返回與原料混合繼續冶煉,如此循環往復,將造成富氧底吹爐煙塵中多種有價元素大量富集[4-7],進而影響煉鉛原料的品質。隨著近年煉鉛用鉛精礦品位的下滑、雜質含量的上升,煙塵返回冶煉對爐況的影響越來越嚴重。因此,對含鉛煙塵進行單獨處理意義重大。
氧化鉛在工業上有廣泛的用途,可用作顏料鉛白、鉛皂、冶金助溶劑、油漆催干劑、陶瓷原料、鉛鹽塑料穩定劑、鉛玻璃工業原料以及鉛鹽類工業的中間原料等。隨著經濟的發展,氧化鉛的需求也隨之增長[8-10]。目前從固體廢物中提取氧化鉛的方法有火法和濕法,而濕法冶金技術有較強的選擇性,在水溶液中可通過控制生產條件實現不同元素的有效分離,且生產環境友好、生產成本低[11-13]。李磊等人[14-15]在低溫下用檸檬酸與鉛膏反應合成檸檬酸鉛,再焙燒得到氧化鉛;朱新鋒等人[16]以Na2CO3、NaHCO3和(NH4)2CO3為脫硫劑與鉛膏反應制得堿式碳酸鉛,再焙燒得氧化鉛;Hassam Karami等人[17]用硝酸鉛與氫氧化鈉反應得到氫氧化鉛,焙燒得氧化鉛。然而,以鉛冶煉煙塵為原料生產氧化鉛的研究卻未見報道。考慮到鉛煙塵中的鉛化合物組成與鉛膏相似,因此,本試驗采用濕法冶金工藝,以鉛冶煉煙塵為原料,對通過合成前驅物、再焙燒脫水來制備氧化鉛的工藝進行了研究。
1 試驗原料
試驗原料為河南某底吹爐煉鉛煙塵,主要化學成分分析結果見表1,XRD分析結果見圖1,SEM圖片見圖2。
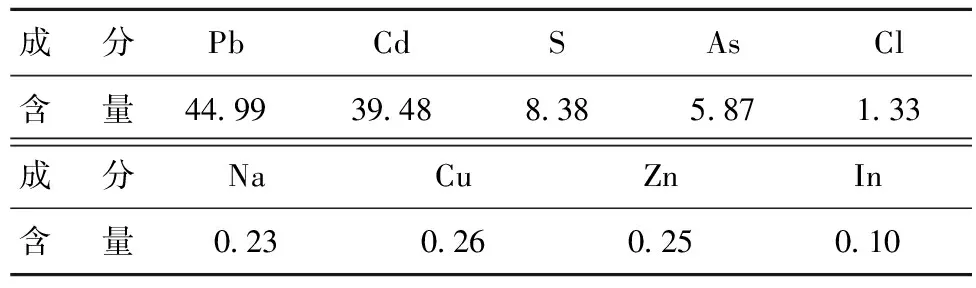
表1 試驗原料主要化學成分分析結果

圖1 試驗原料的XRD圖譜
從表1可以看出,試驗原料中Pb、Cd含量高,分別為44.99%和39.48%;非金屬S、As含量次之,分別為8.38%和5.87%;其他金屬元素Na、Cu、Zn等含量較低,均在0.23%~0.26%之間。
從圖1可以看出,試驗原料的XRD圖譜中主要可見Pb3O4、Pb2O3、PbO以及PbSO4和PbCl2等鉛礦物的衍射峰;鎘礦物中CdS、CdSO4和CdAs的衍射峰也較強。

圖2 試驗原料的SEM圖片
從圖2可以看出,試驗原料大多由聚合物組成,經高溫冷凝后相互黏結,粒度在1~10 μm之間。
2 試驗步驟及原理
氧化鉛粉末制備主要分硫酸化焙燒預處理、NaCl浸出酸浸渣、氧化鉛前驅體合成和氧化鉛粉末的生成等4大步。
(1)硫酸化焙燒預處理。鉛冶煉煙塵中主要為金屬氧化物和金屬硫化物、砷化物,其中部分金屬氧化物可用酸浸出、部分硫化物和砷化物難溶于酸。要高效實現鉛與其余金屬的分離,必須完成金屬硫化物和砷化物的氧化,且使鉛保留在渣相中,其余金屬盡可能進入溶液中,最有效的辦法是硫酸化焙燒—水浸。該部分的主要反應有(Me代表Pb、Cd、Zn):

(1)
MeO+H2SO4=MeSO4+H2O,
(2)
2MeS+2H2SO4+3O2=2MeSO4+2SO2+2H2O,
(3)
Me3As2+3H2SO4+3O2=3MeSO4+As2O3+3H2O,
(4)
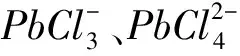

(5)
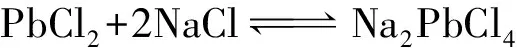
(6)
(3)氧化鉛前驅體合成。PbCl2冷卻結晶后從溶液中析出,結晶后溶液返回繼續浸出,析出的PbCl2,經洗滌,得到的純度較高的PbCl2與NaOH反應生成Pb(OH)2,其反應式為
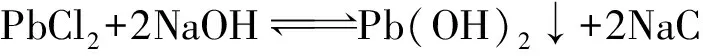
(7)
(4)氧化鉛粉末的生成。Pb(OH)2在一定條件下焙燒后得到氧化鉛粉末,其反應式為

(8)
3 試驗結果與討論
3.1 硫酸化焙燒預處理—水浸試驗
由于鎘和砷是制備硫酸鉛渣的主要雜質元素,氯鹽、鈉鹽為可溶鹽,而銅、鋅、銦含量遠小于鎘、砷,因此不予研究。硫酸化焙燒采用濃硫酸,焙燒產物水浸的液固比為30mL/g、水浸溫度為60 ℃、時間為120min。
3.1.1 焙燒溫度對鉛、鎘、砷去除率的影響
硫酸化焙燒溫度對鉛、鎘、砷去除率影響試驗的酸料比為0.6mL/g,焙燒時間為120min,試驗結果見表2。

表2 硫酸化焙燒溫度試驗結果
從表2可以看出,升高焙燒溫度,鉛去除率微幅上升,但鎘、砷的去除率先顯著上升后顯著下降,高點在500 ℃時。這是因為,一方面,溫度升高有利于鎘的氧化物、硫化物或砷化物在空氣中與硫酸反應生成易溶的硫酸鎘;另一方面,濃硫酸的沸點為330 ℃,高于此溫度會加速硫酸分解為三氧化硫和水,溫度不太高的情況下,硫酸分解生成的三氧化硫可繼續發揮硫酸的作用,與反應對象發生化學反應,但溫度過高,三氧化硫會大量揮發,從而影響易溶硫酸鎘的生成。因此,確定焙燒溫度為500 ℃。
3.1.2 酸料比對鉛、鎘、砷去除率的影響
酸料比對鉛、鎘、砷去除率影響試驗的焙燒溫度為500 ℃,焙燒時間為120 min,試驗結果見表3。

表3 酸料比試驗結果
從表3可以看出,提高酸料比,鎘、砷的去除率先上升后維持在高位,鉛去除率變化很小。因此,確定酸料比為0.6 L/g。
3.1.3 焙燒時間對鉛、鎘、砷去除率的影響
焙燒時間對鉛、鎘、砷去除率影響試驗的焙燒溫度為500 ℃,酸料比為0.6 mL/g,試驗結果見表4。

表4 焙燒時間試驗結果
從表4可以看出,延長焙燒時間,鎘、砷的去除率上升,鉛去除率變化很小。因此,確定焙燒時間為120 min。
3.1.4 硫酸化焙燒—水浸試驗結果
在酸料比為0.6 mL/g、焙燒溫度為500 ℃、焙燒時間為120 min情況下的焙燒產物,在60 ℃下攪拌水浸120 min,浸出渣主要化學成分分析結果見表5。

表5 硫酸化焙燒—水浸渣主要化學成分分析結果
從表5可以看出,硫酸化焙燒—水浸具有較好的除雜效果,但酸浸渣中仍含有少量的鎘。
在酸料比為0.6 mL/g、焙燒溫度為500 ℃、焙燒時間為120 min情況下的焙燒產物,在60 ℃下攪拌水浸120 min,Pb、Cd、As的去除率分別達2.67%、96.98%、100.00%,產物中Pb、Cd、As的含量分別為67.10%、0.68%、0.03%。
3.2 酸浸渣NaCl溶液浸出—結晶試驗
將酸浸渣烘干、研磨、過200目篩,討論在氯化鈉濃度、浸出溫度、浸出時間、液固比等不同反應條件對鉛、鎘浸出率的影響。反應控制溶液的pH在4以下(防止水解),浸出完成后,浸出液趁熱過濾,濾渣用與反應溫度相同的熱水沖洗3次,濾液經室溫靜置12 h結晶,得氯化鉛。
3.2.1 NaCl溶液濃度對鉛、鎘浸出率的影響
NaCl溶液濃度試驗的浸出溫度為90 ℃、浸出時間為90 min、液固比為30 mL/g,試驗結果見圖3。
從圖3可以看出,隨著氯化鈉濃度的提高,硫酸鉛不斷轉化為溶解度更大的鉛配合物Na2PbCl4,由于鎘含量遠低于鉛,氯化鎘的溶解度又高于氯化鉛,所以鎘的浸出更易達到平衡,因此鎘、鉛浸出率呈幅度不同的上升趨勢。為了獲得較高的鉛浸出率,確定氯化鈉溶液的濃度為250 g/L。
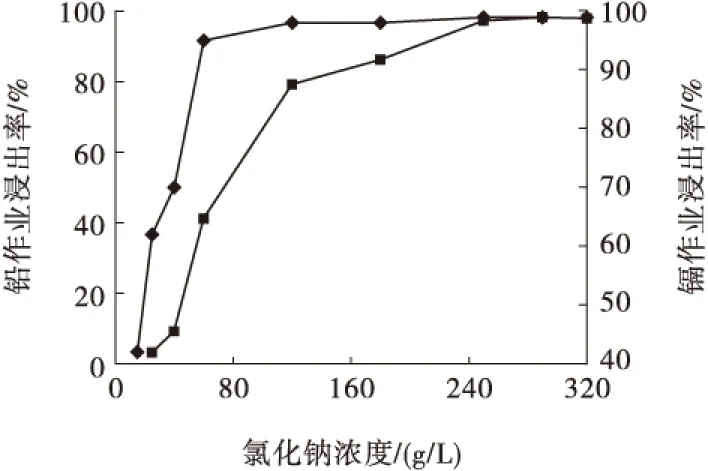
圖3 NaCl濃度對鉛、鎘浸出率的影響
3.2.2 浸出溫度對鉛、鎘浸出率的影響
浸出溫度試驗的NaCl溶液濃度為250 g/L、浸出時間為90min、液固比為30 mL/g,試驗結果見圖4。

圖4 浸出溫度對鉛、鎘浸出率的影響
從圖4可以看出,隨著浸出溫度的升高,鉛、鎘浸出率均上升。溫度升高有利于提高氯化鉛的溶解度,對鎘的浸出影響較小。綜合考慮,確定浸出溫度為90 ℃。
3.2.3 浸出時間對鉛、鎘浸出率的影響
浸出時間試驗的NaCl溶液濃度為250 g/L、浸出溫度為90 ℃、液固比為30 mL/g,試驗結果見圖5。
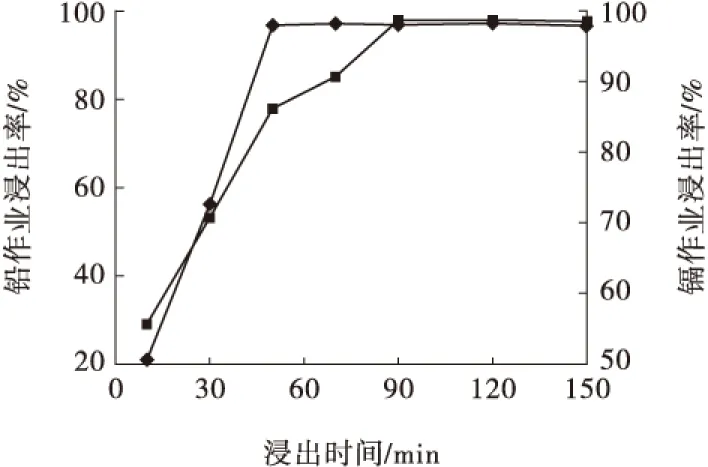
圖5 反應時間對鉛、鎘浸出率的影響
從圖5可以看出,隨著浸出時間的延長,鉛、鎘浸出率均上升。綜合考慮,確定浸出時間為90 min。
3.2.4 液固比對鉛、鎘浸出率的影響
液固比試驗的NaCl溶液濃度為250 g/L、浸出溫度為90 ℃、浸出時間為90 min,試驗結果見圖6。
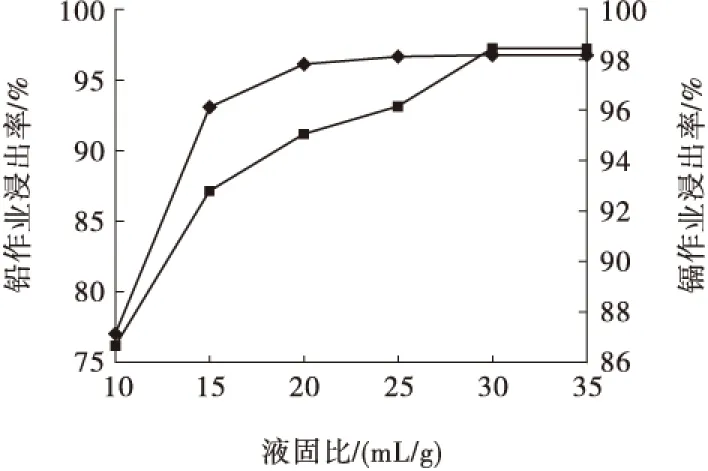
圖6 液固比對鉛、鎘浸出率的影響
從圖6可以看出,隨著液固比的增大,鉛、鎘浸出率上升。因為反應式(5)是可逆反應,溶液不斷積累的硫酸根離子會抑制反應進行,液固比增大,有利于緩沖溶液中硫酸根離子濃度的上升。綜合考慮,確定液固比為30 mL/g,對應的鉛、鎘浸出率為97.89%和98.12%。
3.2.5 氯化鉛結晶試驗
酸浸渣用濃度為250 g/L的NaCl溶液按液固比30 mL/g、在90 ℃、浸出90 min,將濾液室溫下靜置12 h進行結晶,結晶率為92.13%,結晶體的SEM圖片見圖7。

圖7 氯化鉛結晶體的SEM圖片(放大500倍)
從圖7可以看出,氯化鉛結晶體微觀形貌為細棒狀,長度在10~200 μm之間。
3.3 氧化鉛前驅體合成中氫氧化鈉用量試驗
氯化鉛與氫氧化鈉反應生成的氫氧化鉛屬兩性化合物,與過量的堿溶液反應生成可溶鹽Na2PbO2,因此,控制氫氧化鈉的用量非常重要。
將干燥后的氯化鉛晶體磨細、過200目篩,加入氫氧化鈉溶液,液固比為30∶1,反應溫度為90 ℃、反應時間為60 min,反應結束后過濾,所得沉淀在80 ℃下真空烘干24 h,稱重并分析其中氯、鉛含量,氫氧化鈉實際用量與理論用量之比(r)對氧化鉛前驅體合成試驗結果見表6,XRD圖譜見圖8。
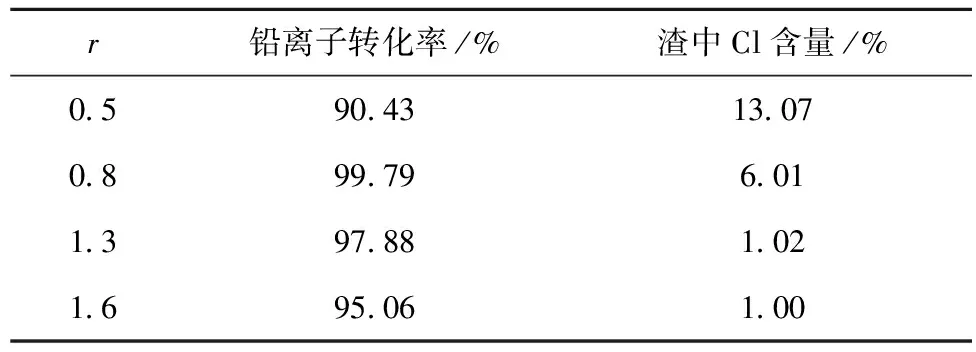
表6 氫氧化鈉用量對氧化鉛前驅體合成的影響
注:鉛離子的轉化率是指所得產物中鉛總量與反應之前氯化鉛中鉛總量的比值。

圖8 不同氫氧化鈉用量情況下沉淀物的XRD圖譜
從表6可以看出,隨著氫氧化鈉用量的增大,鉛轉化率先上升后下降,而產物中的氯離子含量先下降后維持在低位。綜合考慮,確定氫氧化鈉的實際用量為理論用量的1.3倍。
從圖8可以看出,當r=0.5時,由于堿量不足,反應生成了PbCl(OH);而當r=0.8時,堿式氯化鉛衍射峰減少,出現了所需產物Pb(OH)2和3PbO·H2O的衍射峰,少量的氯以PbOHCl形式存在;而當r=1.3~1.6時,PbOHCl的衍射峰也不可見,產物中僅可見Pb(OH)2和3PbO·H2O的衍射峰,產物的分子形式可表示為mPbO·nH2O,因而氯的含量很低,這一結論與表6的結果一致。
3.4 氧化鉛粉末的制備
用差熱分析儀分析合成的氧化鉛前驅體在25~800 ℃下的熱反應變化,結果見圖9。
從圖9可以看出,在25~800 ℃范圍內,共出現2個吸熱峰,分別對應著2個明顯的熱重變化,對應的溫度分別為102 ℃和504 ℃,推測這2個溫度下發生了脫水反應。因此,用馬弗爐分別在102 ℃和504 ℃下,對氧化鉛前驅體加熱焙燒120 min,所得產物的XRD圖譜見圖10。

圖9 氧化鉛前驅體的差熱分析結果

圖10 不同溫度下焙燒產物的XRD圖譜
從圖10可以看出,不同焙燒溫度下,產物的特征峰單一:102 ℃時呈現出Pb(OH)2的特征峰,說明該溫度下氧化鉛前驅體mPbO·nH2O脫除了部分結晶水;504 ℃時Pb(OH)2的特征峰消失,出現了PbO的特征峰,說明在此溫度下Pb(OH)2進一步發生脫水反應,得到最終所需的產物PbO粉末。因此,氧化鉛前驅體制備PbO的適宜焙燒溫度為504 ℃。
氧化鉛前驅體、102 ℃和504 ℃焙燒產物的SEM照片見圖11。
從圖11可以看出,從氧化鉛前驅體到504 ℃的焙燒產物氧化鉛,產品的粒度越來越小,結晶形態越來越不規則。圖11(a)、圖11(d)中的前驅體的形狀類似圖5中氯化鉛晶體的棒狀,但尺寸明顯變少,長度一般為10 μm,這種形貌的形成是由于在前驅物的合成過程中,有氯化鈉產生,而氯離子有很強的配位能力,能吸附在產物的晶體表面,阻止這些晶面的生長,使得晶體的生長有了定向性,從而產物分子被有序排列成棒狀,這也就是前驅物中一直有1%左右氯離子存在的原因。圖11(b)、圖11(e)為氧化鉛前驅體脫除部分結晶水的產物,因而尺寸較前驅體有所減小,但沒有打亂晶體排布的規律,顆粒長約2 μm。圖11(c)、圖11(f)為氧化鉛前驅體完全脫水的產物,晶體的形貌改變很徹底,規律排布的短棒狀消失,呈現的是海綿狀疏松的微觀形貌,長度小于2 μm,主要化學成分分析結果見表7。

圖11 氧化鉛前驅體及不同溫度下焙燒產物的SEM照片

表7 超細氧化鉛粉末的主要化學成分分析結果
從表7可以看出,超細氧化鉛粉末純度較高,氧化鉛含量達98.31%。
4 結 論
(1)河南某底吹爐煉鉛煙塵Pb含量達44.99%,是重要的二次資源,其中雜質Cd、As的含量為39.48%、5.87%,采用硫酸化焙燒預處理—NaCl浸出酸浸渣—氧化鉛前驅體合成—氧化鉛粉末生成工藝可獲取高質量的超微細氧化鉛粉末,實現二次鉛資源的高效利用。
(2)硫酸化焙燒預處理—水浸工藝的焙燒過程酸料比為0.6 mL/g、焙燒溫度為500 ℃、焙燒時間為120 min,焙燒產物水浸過程的液固比為30 mL/g、水浸溫度為60 ℃、水浸時間為120 min,該工藝的Pb、Cd、As去除率分別達2.67%、96.98%、100.00%,產物中Pb、Cd、As的含量分別為67.10%、0.68%、0.03%,初步實現了鉛與鎘、砷等雜質元素的分離。
(3)NaCl浸出酸浸渣工藝的NaCl溶液濃度為250 g/L、浸出溫度為90 ℃、液固比為30∶1 mL/g、浸出時間為90 min,對應的鉛、鎘作業浸出率為97.89%和98.12%。
(4)氧化鉛前驅體合成工藝中氯化鉛晶體與氫氧化鈉溶液的液固比為30∶1、氫氧化鈉實際用量與理論用量之比為1.3、反應溫度為90 ℃、反應時間為60 min,產物中僅可見Pb(OH)2和3PbO·H2O的衍射峰,鉛轉換率為97.88%,氯含量很低。
(5)氧化鉛粉末生成工藝的適宜焙燒溫度為504 ℃,脫水過程使晶體的形貌發生了徹底改變,具有短棒狀海綿疏松的微觀形貌,長度小于2 μm,氧化鉛含量達98.31%,屬優質超細氧化鉛粉末。
[1] 李衛鋒,張曉國,郭學益,等.我國鉛冶煉的技術現狀及進展[J].中國有色冶金,2010,4(2):29-33. Li Weifeng,Zang Xiaoguo,Guo Xueyi,et al.Status and process of lead smelting technology in China[J].China Nonferrous Metallurgy,2010,4(2):29-33.
[2] 李衛鋒,楊安國,郭學益,等.河南鉛冶煉的現狀及發展思考[J].中國金屬通報,2009(15):34-37. Li Weifeng,Yang Anguo,Guo Xueyi,et al.The present situation and development of Henan lead smelting industry[J].China Metal Bulletin,2009(15):34-37.
[3] 崔雅茹,李凱茂,何江山,等.液態高鉛渣還原過程爐渣熔化溫度的研究[J].稀有金屬,2013,37(3):473-478. Cui Yaru,Li Kaimao,He Jiangshan,et al.Melting point of molten high-lead slag in direct reduction process [J].Chinese Journal of Rare Metals,2013,37(3):473-478.
[4] 李衛鋒,賈著紅.硫化鉛精礦富氧底吹及富氧頂吹熔煉技術[M].長沙:中南大學出版社,2010. Li Weifeng,Jia Zhuhong.Smelting Technology of Lead Sulfide Concentrate Rich Oxygen Bottom Blowing Top-blown[M].Changsha:Central South University Press,2010.
[5] 邵 戈,曾小冬.水口山煉鉛底吹爐煙灰綜合回收試驗研究[J].中國有色冶金,2010,8(4):43-45. Shao Ge,Zeng Xiaodong.Test of comprehensive recovery ash from bottom-blowning furnace of lead smelting in Shuikoushan[J].China Nonferrous Metallurgy,2010,8(4):43-45.
[6] 鄭時路.復雜鉛煙塵濕法處理新工藝研究[D].長沙:中南大學,2004. Zheng Shilu.New Technology of Complex Lead Smoke Wet Processing Research[D].Changsha:Central South University,2004.
[7] Martins F M,Neto J M d R,Cunha C J d.Mineral phases of weathered and recent electric arc furnace dust[J].Journal of Hazardous Materials,2008,154:417-425.
[8] 鐘 晨.從硫化鉛精礦中制備紅丹和黃丹[J].有色冶煉,1997,12(4):52-54. Zhong Chen.The preparation of yellow lead and red lead from the lead sulfide concentrate[J].China Nonferrous Metallurgy,1997,12(4):52-54.
[9] 宋劍飛,李立清,李 丹.用廢鉛蓄電池制備黃丹和紅丹[J].化工環保,2004,24(1):52-54. Song Jianfei,Li Liqing,Li Dan.Preparation of yellow lead and red lead from used lead batteries[J].Environmental Protection of Chemical Industry,2004,24(1):52-54.
[10] 陳槐隆.綜合利用鉛渣濕法生產優質黃丹[J].有色金屬:冶煉部分,1992,25(1):5-8. Chen Kuilong.The comprehensive utilization of lead slag to produce quality yellow lead[J].Nonferrous Metals:Extractive Metallurgy,1992,25(1):5-8.
[11] 李洪桂.濕法冶金學[M].長沙:中南大學出版社,2011. Li Honggui.Hydremetallurgy[M].Changsha:Central South University Press,2011.
[12] Havlik T,Bernardes A M,Schneider I A H,et al.Hydrometallurgical processing of carbon steel EAF dust[J].Journal of Hazardous Materials,2006,135(1) :311-318.
[13] Jha M K,Kumar V,Singh R.Review of hydrometallurgical recovery of zinc from industrial wastes[J].Resources,Conservation and Recycling,2001,33(2):1-22.
[14] Li L,Zhu X,Yang D,et al.Preparation and characterization of nano-structured lead oxide from spent lead acid battery paste[J].Journal of Hazardous Materials,2012,203:274-282..
[15] 朱新鋒,劉萬超,楊海玉,等.以廢鉛酸電池鉛膏制備超細氧化鉛粉末[J].中國有色金屬學報,2010,20(1):133-135. Zhu Xinfeng,Liu Wanchao,Yang Haiyu,et al.Preparation of ultrafine PbO powders from lead paste in spent lead acid battery[J].The Chinese Journal of Nonferrous Metals,2010,20(1):133-135.
[16] Zhu Xinfeng,Li Lei,Sun Xiaojiao,et al.Preparation of basic lead oxide from spent lead acid battery paste via chemical conversion[J].Hydrometallury,2012(117/118):24-31.
[17] Karami H,Karimi M A,Haghdar S,et al.Synthesis of lead oxide nanoparticles by sonochemical method and its application as cathode and anode of lead-acid batteries[J].Materials Chemistry and Physics,2008,108:7-9.
[18] Turan M D,Altundogan H S,Tümen F.Recovery of zinc and lead from zinc plant residue[J].Hydrometallurgy,2004,75:169-176.
[19] Guo Zhaohui,Pan Fengkai,Xiao Xiyuan,et al.Optimization of brine leaching of metals from hydrometallurgical residue[J].Transactions of Nonferrous Metals Society of China,2010(10):2000-2005.
[20] Farahmand F,Moradkhani D,Safarzadeh M S,et al.Brine leaching of lead-bearing zinc plant residue:process optimization using orthogonal array design methodology[J].Hydrometallurgy,2009,95(3):316-324.
(責任編輯 羅主平)
Preparation of Ultrafine PbO Powders with Lead Smelting Dust
Yang Xie1,2,3Li Hongxu1,2,3Li Chao1,2,3Wang Shuai1,2,3Wang Yuyue1
(1.SchoolofMetallurgicalandEcologicalEngineering,UniversityofScienceandTechnologyBeijing,Beijing100083,China; 2.BeijingKeyLaboratoryofGreenRecoveryandExtractionofPreciousMetals,Beijing100083,China;3.MinistryofEducationKeyLaboratoryofEcologyandCycleMetallurgy,Beijing100083,China)
A lead dust of bottom blowing furnace,Henan province,contains Pb 44.99%,which can be used as significant resource for preparing high quality ultrafine PbO powders.The optimal technological condition for preparing ultrafine PbO powders are investigated by adopting the process of sulfuric acid roasting-sodium chloride leaching-lead oxide precursor synthesis-generation of lead oxide powder.The results showed that the removing rate of Pb,Cd,As reached 2.67%,96.98%,100.00% through the process of pre-treatment of sulfuric acid roasting-water leaching process,preliminarily removing the impurities of Pb,Cd,As.The leaching rate of Pb and Cd were 97.89% and 98.12% separately by sodium chloride leaching acid process.The conversion rate of Pb was 97.88% by PbO precursor synthesis process.The product crystal morphology was thoroughly changed during generation process of PbO powder,and the product had short clavite sponge porous microstructure,with length of less than 2 μm and PbO of 98.31%,which is considered as high quality of ultrafine PbO powders.To sum up,this process provides a new idea for recycling of lead dust and preparation of ultrafine PbO powders.
Lead smelting dust,Sulfuric acid roasting,Sodium chloride leaching,Lead oxide precursor synthesis,Ultrafine PbO powder
2014-06-06
國家自然科學基金資助項目(編號:51234008) 。
楊 勰(1989—),女,碩士研究生。通訊作者 李宏煦(1971—),教授,博士研究生導師。
TF812
A
1001-1250(2014)-09-165-07

