近交系小鼠酒精性脂肪肝模型建立的分析
白云峰,李曉娟,李永綱,王立福,王睿林,李 蓓,李瑞生
(1.解放軍第302醫院中西醫結合肝病診療與研究中心,北京 100039;2.解放軍第302醫院實驗技術研究保障中心,北京 100039)
近年來酒精性肝病的發病率呈逐年上升趨勢,酒精性脂肪肝作為酒精性肝病的前期病變,屬于一種可逆轉的良性肝臟疾患[1]。目前國內外學者對酒精性脂肪肝的研究非常關注,但其發病機制尚不完全清楚,因此建立穩定可靠、簡單易行的動物模型對研究酒精性脂肪肝的發病機制尤為重要。小鼠因其體型小、操作簡便,而成為復制模型較為理想的實驗動物,但小鼠的品種品系較多,大量研究者[2-5]在使用不同品系小鼠復制酒精性脂肪肝模型時其實驗結果又盡相同。因此,本實驗選取BALB/c、C57和C3H三種常用的近交系小鼠,采用酒精灌胃法復制酒精性脂肪肝模型,并對其血清生化指標和病理學改變進行綜合對比分析,以期從中選擇一種最佳實驗動物來建立酒精性脂肪肝模型,為今后研究酒精性脂肪肝疾病及其發病機制提供良好的實驗保障。
1 材料和方法
1.1 實驗動物
選擇近交系BALB/c、C57和C3H小鼠,均為SPF級,雄性,各20只,單鼠體質量為20~22 g,BALB/c小鼠和C57小鼠來自軍事醫學科學院實驗動物中心,生產許可證【SCXK(軍)2012-0004】,C3H小鼠來自北京維通利華實驗動物技術有限公司,生產許可證【SCXK(京)2011-0009】。本實驗室具有SPF級實驗動物使用許可證【SYXK(軍)2012-0010】。
1.2 試劑及飼料
乙醇(分析純,純度>99.7%)(國藥集團化學試劑有限公司,批號:20130315);生理鹽水(解放軍第302醫院制劑室提供,批號:130527405,石家莊四藥有限公司);小鼠飼料(購自軍事醫學科學院實驗動物中心飼料室),生產許可證【SCXK(軍)2012-0003】。
1.3 動物分組及模型制備
各品系小鼠均在本實驗室SPF級屏障環境內飼養,動物自由飲水采食,3 d后將各品系小鼠隨機分為對照組(n=10)和模型組(n=10)。造模方法:各組小鼠每日給予50%乙醇灌胃,灌胃量為12 mL/(kg·bw),折合乙醇的劑量為4.8 g/(kg·bw)[6],持續30 d,小鼠正常飲水采食鼠蛋料。對照組給予等量的生理鹽水灌胃。
1.4 觀察指標及檢測方法
造模過程中每天觀察各組小鼠精神狀態和活動情況,每周稱重一次,于實驗結束前一天禁食12 h,次日稱重后經小鼠眶后靜脈叢采集血液,離心取血清,使用全自動生化儀檢測各組小鼠血清生化指標:天門冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)和甘油三酯(TG)。采集各組小鼠的肝臟稱重,計算其肝指數=肝臟重量(g)/小鼠體重(g)×100%,然后將所有采集的肝組織用10%的甲醛固定、脫水、包埋、切片和HE染色,在光學顯微鏡下觀察分析各組小鼠肝臟的組織病理學結果。
1.5 數據處理
各組的實驗數據均采用SPSS 12.0統計軟件進行t檢驗統計分析。
2 結果
2.1 各品系間小鼠體重增長量和肝指數的對比分析
通過對三種近交系小鼠體重增長量和肝指數的對比分析:BALB/c模型組體重增長量和肝指數均明顯小于對照組(P< 0.01,P< 0.05);C57模型組體重增長量小于對照組(P< 0.05),肝指數不具有統計學意義;C3H模型組體重增長量小于對照組(P< 0.01),肝指數也不具有統計學意義(表1)。
2.2 各品系間小鼠血清生化指標的對比分析
通過對三種近交系小鼠血清生化指標的檢測分析:BALB/c模型組ALT、AST與對照組相比均顯著升高(P< 0.01);C57模型組ALT、AST、TG與對照組相比均顯著升高(P< 0.01);C3H模型組與對照組的ALT、AST、TG之間不具有統計學意義(表2)。
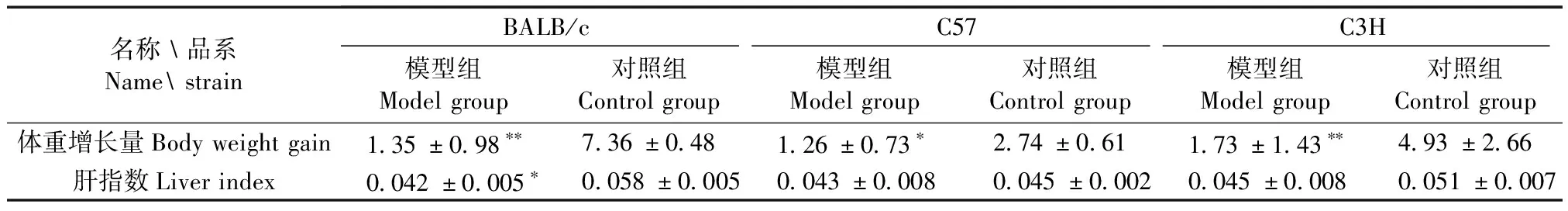
表1 三種近交系小鼠體重增長量和肝指數的對比分析

表2 三種近交系小鼠血清生化指標的對比分析
2.3 各品系間小鼠肝組織病理學的分析
各對照組小鼠的肝細胞索結構完整,肝小葉結構清晰,肝細胞胞漿均勻,無脂肪空洞和炎性浸潤。BALB/c模型組小鼠肝細胞胞質中出現大量散在的脂肪滴,脂肪變性明顯;而C57模型組小鼠肝細胞的胞質中脂肪滴更多,明顯多于BALB/c小鼠,而且脂滴融合成空泡,空泡又融合成較大的囊泡結構,匯管區出現炎性細胞浸潤,BALB/c和C57模型組均還未出現肝纖維化病變;C3H組小鼠肝臟組織幾乎不存在脂肪空泡,脂肪變不明顯(彩插6圖1)。
3 討論
酒精性肝病是由于長期大量飲酒所致的肝臟疾病,最初表現為脂肪肝,進而可發展為酒精性肝炎、酒精性肝纖維化和肝硬化。由于酒精性脂肪肝為可逆病變,因此研究酒精性脂肪肝的發病機制和預防措施顯得尤為重要。國內外研究者[7-9]為了闡明乙醇在體內所導致肝臟損傷的發病機制,采用小鼠、大鼠、家兔和犬等動物來復制酒精性脂肪肝動物模型,但小鼠因其自身獨特的優勢成為最佳的實驗動物,其中近交系BALB/c小鼠和C57小鼠最為常用。聶嬌等[10]利用C57小鼠對內毒素在酒精性脂肪肝形成過程中的作用進行了相關研究;Sung等[11]也利用C57小鼠探索了IL-22由于具有抗氧化、抗凋亡、抗脂肪變的作用而對酒精性肝損傷具有改善作用。而廖彩佶等[12]則研究表明骨髓源性肝干細胞對BALB/c小鼠酒精性肝纖維化病變結構和功能具有改善作用。但目前有關不同品種品系動物所建立的酒精性脂肪肝模型對于其研究結果是否存在差異還未見報道。
因此,本實驗選取BALB/c、C57和C3H小鼠來建立酒精性脂肪肝模型,通過對三種近交系小鼠體重增長量和肝指數的對比分析,其模型組體重增長量均明顯小于對照組,說明長期酒精灌胃對小鼠的體重增長有影響,因此小鼠在造模過程中會出現身體逐漸瘦弱的現象,甚至出現BALB/c模型組3只動物死亡,C3H模型組1只死亡的現象,可能是由于小鼠對酒精的耐受力不同以及酒精的毒性造成的死亡。而C57模型組未見死亡,說明C57小鼠對酒精的耐受性相對較強。在酒精性脂肪肝造模過程中,自由基、酶及脂質過氧化等在此過程中發揮著重要的作用,其中ALT和AST是肝細胞損傷最敏感的指標之一[13-14]。本實驗中BALB/c和C57模型組ALT、AST與對照組相比均顯著升高(P< 0.01),符合轉氨酶升高的基本特點,另外,C57模型組的TG與對照組相比也存在明顯的升高現象(P< 0.01),而C3H組的生化指標無差異。在病理學檢測中C57模型組小鼠肝細胞脂肪滴明顯多于BALB/c和C3H組,而且脂滴已經融合成囊泡結構,說明了C57模型組小鼠的脂肪病變最明顯,表明C57是復制酒精性脂肪肝模型最理想的實驗動物,這與Petrasek[15]、Tan[16]等選擇C57小鼠進行酒精性脂肪肝疾病研究的理念基本一致。
綜上所述,利用三種不同品系的小鼠可建立酒精性脂肪肝動物模型,但通過對其模型動物的體質量、肝指數、血清生化和組織病理學結果的綜合分析,證實了C57小鼠成為復制酒精性脂肪肝模型較為理想的實驗動物,這也為今后如何選擇實驗動物建立酒精性脂肪肝模型提供了理論參考,也為進一步研究酒精性脂肪肝疾病的發病機制、篩選最佳的臨床預防和治療藥物提供了可靠的實驗平臺。
參考文獻:
[1] Andrew M. Miller,Norio Horiguchi,Won-IL Jeong,et al.Molecular mechanisms of alcoholic liver disease: Innate immunity and cytokines[J].Alcohol Clin Exp Res,2011,35(5):787-793.
[2] 彭彥卿,張夢妍,黨好,等.不同醉酒度濃香型白酒對小鼠酒精性肝損傷的影響[J].現代預防醫學,2011,38(5):847-849.
[3] Lu Y,Wu D,Wang X,et al.Chronic alcohol-induced liver injury and oxidant stress are decreased in cytochrome P4502E1 knockout mice and restored in humanized cytochrome P4502E1 knock-in mice[J].Free Radic Biol Med,2010,49(9):1406-1416.
[4] Sun F,Xie M L,Zhu L J,et al.Inhibitory Effect of Osthole on Alcohol-induced Fatty Liver in Mice [J]. Digest Liver Dis,2009,41:127-133.
[5] 薛曉偉,豐平,董坤,等.槲芪散對小鼠酒精性肝損傷的干預作用[J].實驗動物科學,2010,27(4):27-32.
[6] 付萍,楊銘,陳穎麗,等.玉米肽對小鼠酒精性肝損傷保護作用的研究[J].中國中醫藥科技,2008,15(2):115-116.
[7] 劉安軍,孫海波,張國蓉,等.硒酸精氨酸對小鼠酒精性肝損傷的保護作用,中國比較醫學雜志,2007,17(9):533-538.
[8] 牛術仙,仲云,李勇.肝脂清治療酒精性脂肪肝大鼠的實驗研究[J].中西醫結合肝病雜志,2011,21(2):97-98.
[9] 李曉娟,張大鹍,隋麗華,等.超聲在評價大鼠酒精性脂肪肝模型中的應用[J].中國比較醫學雜志,2013,23(4):19-22.
[10] 聶嬌,李鑫,徐有青.內毒素在酒精性肝病腸損傷中的作用[J].實用肝臟病雜志,2012,15(3):206-208.
[11] Sung H K,Park O,Zheng M Q,et al.Interleukin-22 treatment ameliorates alcoholic liver injury in a murine model of chronic-binge ethanol feeding: Role of STAT3[J].Hepatology,2010,52(4):1291-1300.
[12] 廖彩佶,廖彩仙,廖欣鑫,等.骨髓單個核細胞移植對小鼠酒精性肝纖維化的影響[J].臨床醫學工程,2011,18(1):13-14.
[13] 鄭榮梁,黃中洋.自由基生物學[M].3版.北京:高等教育出版社,2007:95-108.
[14] 朱強,王科,錢曉鋒,等.改良小鼠酒精性肝損傷模型的建立[J].中華臨床醫師雜志(電子版),2010,4(9):1532-1536.
[15] Petrasek J, Dolganiuc A,Csak T,et al.Interferon regulatory factor 3 and Type I interferons are protective in alcoholic liver injury in mice via cross-talk of parenchymal and myeloid cells[J].Hepatology,2011,53(2):649-660.
[16] Tan X,Sun X,Li Q,et al.Leptin deficiency contributes to the pathogenesis of alcoholic fatty liver disease in mice[J].The American Journal of pathology[J].2012,181(4):1279-1286.

